干预NF-κB信号通路对鼠脑皮层神经元自噬的影响
莫伟 陈兵 龙霄翱 邹新辉 梁远生
干预NF-κB信号通路对鼠脑皮层神经元自噬的影响
莫伟 陈兵 龙霄翱 邹新辉 梁远生
目的 研究观察干预NF-κB信号途径对脑皮层神经元自噬的影响。方法 用PMA及PDTC作用于体外培养的大鼠脑皮层神经元, 分别应用免疫细胞化学荧光法测定细胞核因子κB(nuclear factor kappa B, NF-κB)蛋白的表达, 应用Western blot检测自噬蛋白Beclin1表达情况。结果 PMA干预下神经元NF-κB蛋白表达及自噬指标均呈相关性升高, 而经PDTC处理后上述变化均受不同程度的抑制。各指标激活及抑制程度均与药物作用剂量与时间相关。结论 NF-κB通路活化可能是启动大鼠脑皮层神经元不同程度的自噬进程的中心环节, 而PDTC能够通过抑制NF-κB通路而抑制这些进程,但不能完全阻断这些进程。
PMA;PDTC;神经元;细胞核因子κB
创伤性脑损伤(traumatic brain injury, TBI)的高发生率和高致残率所造成的社会、经济和医疗护理负担越来越重。因此, 创伤性脑损伤后病人的神经功能恢复越来越受到重视。创伤性脑损伤可因脑挫裂伤、颅内血肿、导致颅内压升高、缺氧、水肿诱发脑组织酸中毒及微循环障碍等一系列的病理生理变化[1]。损伤后神经元中的NF-κB通路被激活并表达NF-κB[2]。但是, 颅脑损伤的病理生理机制及治疗方面仍存在许多争议。本实验研究采用神经元体外培养技术, 排除了颅脑外伤后众多因素的影响, 独立研究NF-κB通路对神经元自噬的影响, 探讨NF-κB通路参与神经元死亡的机制,为以后临床用药提供新的思路。现报告如下。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物 Speague-Dawley(SD)大鼠200只, 由广东医学院动物实验中心提供, SPF级, 鼠龄为24 h, 雌雄不限,体重5~8 g。
1.1.2 主要试剂 胎牛血清(四季青公司), Neuronbasal培养基、DMEM/F12培养基(GIBCO公司), PMA、PDTC、NF-κB免疫荧光试剂盒(Sigma公司)。
1.1.3 主要仪器 荧光显微镜(美国Kodak公司).5417R型高速台式冷冻离心机(德国eppendorf公司), PH140A型培养箱、干燥器(上海一恒科技有限公司), Serial垂直转移电泳槽、分光光度计(Bio-RAD公司)。
1.2 方法
1.2.1 新生大鼠星形胶质细胞的纯化培养:取出生24 h内的SD大鼠, 参照McCarthy的方法加以改良建立大鼠脑星形胶质细胞的原代培养, 冰冻无菌条件下取大脑皮质, 仔细的剥除软脑膜和血管, 剪碎后经0.125%胰蛋白酶37℃消化15 min,终止消化并吹打分散;100目滤网过滤后1000 r/min×10离心取沉淀, 用含2%B27的Neuronbasal培养基制成单细胞悬液,以1×10-6ml密度接种在经左旋多聚赖氨酸处理过的培养板,于37℃、相对体积分数为5%的CO2培养箱中进行培养。以后每隔3 d以Neuronbasal/B27半量换液。采用免疫细胞化学NSE染色进行神经元的鉴定, 纯度达到95%以上的可用于实验。
1.2.2 建立体外可调控NF-κB的细胞模型:取培养满意的神经元细胞, 将每批细胞平均分成3组, 每组各重复3次实验:①空白组:先加入2 μl PBS液1 h后, 再加入2 μl PBS液;②激活组:先加入2 μl PBS液1 h后, 加入2 μl浓度100 ng/ml的NF-κB激活剂PMA;③抑制组:先加入2 μl浓度25 mol/mL的NF-κB阻断剂PDTC预处理1 h后再加入2 μl浓度100 ng/ml的PMA。各组细胞分别处理1、6、12、24、48 h。
1.2.3 神经元细胞NF-κB蛋白表达检测:①应用免疫细胞化学荧光法测定NF-κB蛋白的表达。一抗为兔抗鼠NF-κB多克隆抗体(1∶1 000)4℃孵育过夜, 二抗为辣根过氧化物酶(1∶500) 标记的山羊抗兔IgG,37 ℃孵育30 min。加入碘化丙啶(PI)标记细胞核。②结果判断标准:高倍镜下随机观察每组细胞5个以上有代表性视野(≥1000个细胞),用Leica激光共聚焦显微镜下照相, 并用Leica Confocal图像分析软件检测核区荧光值, 每组计数阳性细胞(细胞浆呈绿色荧光)与细胞总数(所有细胞的细胞核呈红色荧光)的比值计数。评分标准:0分, 没有阳性细胞;1分, 阳性细胞百分比<10%;2分, 阳性细胞百分比≥10%但<30%;3分,阳性细胞百分比≥30%但<60%;4分, 阳性细胞百分比≥60%。在此基础上通过染色或荧光强度按阴性、弱、中,强染色分别加成0~3分。
1.2.4 神经元细胞自噬检测 取各干预时间下的各组细胞提取蛋白, 使用BCA蛋白定量试剂盒对蛋白提取物进行蛋白定量, 调蛋白浓度一致, 按Towbin 等报道的蛋白印迹法进行检测自噬标志性蛋白Beclin1。一抗为兔抗鼠Beclin1多克隆抗体(1∶1 000)37 ℃孵育1 h, 二抗为辣根过氧化物酶(1∶500)标记的山羊抗兔IgG,37 ℃孵育1 h。以β-肌动蛋白(β-actin)作为内对照, 用TBST进行洗膜;化学发光法进行膜片的显影。取检测蛋白与内参灰度值的比值作为Beclin1的表达水平。
1.3 统计学方法 采用SPSS13.0统计学软件对数据进行统计分析。计量资料以均数±标准差( χ-±s)表示, 采用t检验;计数资料采用χ2检验。P<0.05为差异具有统计学意义。
2 结果
2.1 神经元细胞培养情况 免疫细胞化学染色后, 镜下含神经元细胞特异抗原NSE的胞体和轴突为橙红色, 标记为阳性细胞。本实验中培养的星形胶质细胞的纯度在95%以上。2.2 NF-κB蛋白的表达情况 实验结果显示, 在本实验中, NF-κB蛋白的荧光表达主要在胞浆中, 部分在细胞核中, 在各组中的表达程度不同。激活组从6 h开始的NF-κB蛋白表达均高于抑制组和空白组的NF-κB表达, 差异有统计学意义(P<0.01);激活组从1~24 h, NF-κB表达逐渐增加,24 h达到高峰,48 h稍下降。见图1。抑制组从6~48 h时间点NF-κB蛋白表达均小于激活组高于空白组, 差异有统计学意义(P<0.01)。见表1。
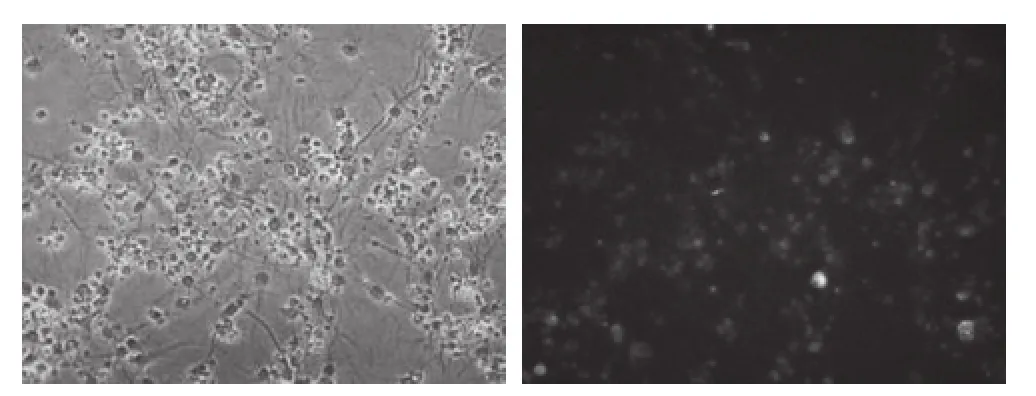
图1 神经元NF-κB表达免疫细胞荧光显色(×200)
2.3 自噬情况 实验结果显示,1 h时间点内激活组和抑制组分别与空白组比较差异有统计学意义(P<0.05).6、12、24、48 h各组两两比较差异有统计学意义(P<0.01)。Beclin1蛋白在激活组与抑制组中随着时间的增加而表达增加, 激活组表达整体高于抑制组和空白组, 在24 h达到高峰, 差异有统计学意义(P<0.01)。见表2。

表1 各组细胞不同时间点NF-κB蛋白荧光计分比较( χ-±s, 分)

表2 各不同时间点各组大鼠神经元Beclin1表达情况( χ-±s, 位)
3 讨论
Nonaka等实验研究表明:脑损伤早期(1~2 h)NF-κB在轴突被激活,24 h~1周在神经元的细胞质及细胞核内以及受伤皮质的小胶质细胞、巨噬细胞及星形胶质细胞内被激活[3]。在体内, NF-κB的活化过程受到精细调控, 其中反馈调节是主要的调节方式。正反馈调节可通过细胞外机制进行, 其作用是增强炎症信号。脑创伤后NF-κB启动了或调节相关蛋白转录, 参与各种细胞炎症反应和细胞死亡。自噬的双面性在创伤性脑损伤中的研究意义重大, 一方面它本身可以诱导自噬性细胞死亡和凋亡信号之间的交互作用;另一方面自噬可能在受损神经细胞中帮助清除受损的细胞器, 防止细胞凋亡程序的启动[4]。
在本实验中, 实验结果NF-κB蛋白表达在1 h时间点内激活组与空白组比较差异无统计学意义(P>0.05), 激活组从6 h开始的NF-κB蛋白表达均高于抑制组和空白组的NF-κB蛋白表达, 差异有统计学意义(P<0.01)。从而说明PMA能够激活神经元表达NF-κB蛋白, 激活组中从1~24 h时间点NF-κB蛋白表达逐渐增加,24 h达到高峰,48 h稍下降。在抑制组中NF-κB蛋白表达从12 h开始就高于空白组, 比较差异有统计学意义(P<0.05), 说明PDTC能够抑制NF-κB的表达, 结合激活组的情况, 作者推断NF-κB激活后炎性因子在早期(6 h)就开始表达, 而PDTC能够在早期就抑制NF-κB通路, 从而抑制了炎性因子对NF-κB通路的再刺激作用, 因此能够减少NF-κB蛋白的表达量。而抑制组6~48 h时间点NF-κB蛋白表达均小于激活组高于空白组,差异有统计学意义(P<0.01), 也更有力地为作者的推断提供了依据。激活组与抑制组在多个时间点内NF-κB蛋白的表达均高于空白组, 也同时说明了PDTC不能完全抑制神经元表达NF-κB蛋白。
应用NF-κB激活剂PMA和NF-κB抑制剂PDTC不同时间点分别加入体外培养的神经元中, 并分别与空白组比较Beclin1蛋白的表达, 以此来观察NF-κB信号通路是否参与自噬体形成过程。Beclin1蛋白是自噬的标志性蛋白之一,它的表达表现了自噬在早期(1 h开始)就开始发生, 并随时间的推移不断增加, 在24 h时间点到达高峰, 之后稳定于这一表达量水平。从实验结果分析, 激活组中的Beclin1蛋白处于较高的表达, 并随着NF-κB表达量的增加而不断增加,这也证明了NF-κB信号通路参与了自噬体形成的过程并起到促进自噬的发生。
在抑制组中各个时间点的Beclin1蛋白表达均低于激活组, 这说明PDTC 能够抑制NF-κB信号通路的作用, 机制可能是抑制了NF-κB信号通路激活后炎性因子的表达从而抑制自噬发生。抑制组中仍有较少量的Beclin1蛋白表达,这也说明PDTC不能完全抑制NF-κB信号通路引起的自噬发生, 同时NF-κB通路是否通过其它机制参与自噬, 这仍需进一步的实验证明。
[1] Jill Wong, Ng Wai Hoe, Feng Zhiwei, etal. Apoptosis and traumatic brain injury. Neurocritical Care,2005,3(2):177-182.
[2] Petite CK, Chung MC, Verkhovsky IM, etal. Brain glutamine synthetase increase following cerebraI ischemia in the rat. Brain Res,1992.569(2):275-280.
[3] Nonaka M, Chen XH, Pierce JE, etal. Prolonged activation of NF-kappaB following traumatic brain injury in rats. J Neurotrauma,1999,16(11):1023-1034.
[4] Clark RS, Bayir H, Chu CT, etal. Autophagy is increased in mice after traumatic brain injury and is detectable in human brain after trauma and critical illness. Autophagy,2008,4(1):88-90.
10.14164/j.cnki.cn11-5581/r.2015.11.182
2015-03-19]
2013年广东医学院科研基金项目(项目编号:XK1456)
524001 广东医学院附属医院神经外科
陈兵

