类胰蛋白酶通过PAR2激活JAK-STAT通路促进小鼠骨髓来源的巨噬细胞向M1表型转换
张亚东卢涵宇陈 亮李晓波殷莲华,王松梅△
(1复旦大学基础医学院医学实验教学中心,2生理与病理生理学系 上海 200032)
类胰蛋白酶通过PAR2激活JAK-STAT通路促进小鼠骨髓来源的巨噬细胞向M1表型转换
张亚东1卢涵宇1陈 亮1李晓波2殷莲华1,2王松梅1△
(1复旦大学基础医学院医学实验教学中心,2生理与病理生理学系 上海 200032)
目的研究类胰蛋白酶促进小鼠巨噬细胞表型转换的作用及其机制。方法体外分离培养小鼠巨噬细胞(对照组),并诱导为M1和M2亚型,经类胰蛋白酶和PAR2激动剂分别作用后,通过real-time PCR和Western blot检测巨噬细胞亚型标志物以及JAK-STAT信号通路的变化。结果成功分离培养小鼠骨髓来源的巨噬细胞,并诱导其分化为M1和M2亚型。PAR2激动剂(2-Furoyl-LIGRLO-amide)和类胰蛋白酶分别与M1型巨噬细胞分别作用后,M1型标记物iNOS和IL-12高于对照组,而M2型标记物arg1和mrc1与对照相比无明显变化,提示类胰蛋白酶和PAR2激动剂可以促进巨噬细胞向M1型转化,而不会促进M1型向M2型转化。PAR2激动剂和类胰蛋白酶分别与M2型巨噬细胞作用后,M2型标记物arg1和mrc1明显下降,而M1型标记物iNOS和iL-12有所增加,提示类胰蛋白酶和PAR-2激动剂均可促进M2型向M1型转化。类胰蛋白酶作用于M1型巨噬细胞后,JAK2磷酸化水平、STAT和p-STAT的表达水平均无明显变化。类胰蛋白酶作用于M2型巨噬细胞后,JAK2的磷酸化随着时间延长明显升高,STAT的磷酸化水平同时升高,提示类胰蛋白酶可以通过和PAR-2结合而激活JAK2-STAT信号通路,进而引起M2型向M1型转化。结论类胰蛋白酶可能通过与其受体PAR2相互作用后激活JAK-STAT通路,促进小鼠骨髓来源的巨噬细胞向M1亚型转化,起到促进炎症发展的作用,从而进一步加重动脉粥样硬化的发展。
类胰蛋白酶; PAR2; 巨噬细胞M1/M2; JAK-STAT; 小鼠
心血管疾病严重威胁人类生命健康,在我国每年约350万人死于心血管疾病,占疾病总死亡原因的41%,位居第一[1]。动脉粥样硬化是其最主要的病理生理学基础。动脉粥样硬化是一种慢性炎症性疾病,多种免疫细胞参与其发生发展。其中巨噬细胞和肥大细胞浸润通过分泌多种因子促进炎症反应在动脉粥样硬化的斑块形成、发展和破裂过程中起着重要作用。
巨噬细胞在体内不同的微环境中存在着2种分化亚型:M1型(经典活化型)和M2型(替代活化型)。M1型巨噬细胞能分泌NO、TNF-α、IL-6、IL-12等炎性因子,促进炎性反应,参与正向免疫应答。M2型则分泌一些抑炎性因子(如IL-10、TGF-β)和可溶性IL-1受体拮抗剂等,抑制炎性反应并下调免疫应答[2-3]。研究表明,Apo E基因敲除(ApoE-/-)小鼠的早期动脉粥样斑块中的巨噬细胞全部为抑炎的M2型。随着时间的推移和病变的进展,促炎的M1型巨噬细胞出现并成为ApoE-/-小鼠晚期动脉粥样硬化斑块中的主要巨噬细胞[4]。因此,巨噬细胞M2/M1类型转换与动脉粥样硬化斑块的发生发展密切相关[5]。
在动脉粥样硬化斑块中存在大量浸润的肥大细胞,被激活后可释放大量的内容物和因子,其中含量最多的是一种四聚体丝氨酸蛋白酶,即类胰蛋白酶(tryptase)。类胰蛋白酶可通过多个途径和环节参与并促进动脉粥样硬化发生发展[6-8]。肥大细胞和巨噬细胞之间存在着复杂的相互关系,研究发现巨噬细胞源性泡沫细胞周围有大量脱颗粒的肥大细胞及类胰蛋白酶存在[9],且肥大细胞的数量在不稳定斑块中远多于稳定斑块中,主要位于临近巨噬细胞的细胞外基质中。本课题组之前的研究还发现,类胰蛋白酶可通过激活巨噬细胞表面蛋白酶激活受体2(protease activated receptor 2,PAR2),抑制LXRα的活性,从而促进巨噬细胞的泡沫化[8]。而类胰蛋白酶是否能通过和PAR2受体的相互作用,促进巨噬细胞M1/M2两个亚型的转化,目前尚不明确。因此本研究利用类胰蛋白酶及PAR2激动剂作用于小鼠骨髓来源的巨噬细胞,探索类胰蛋白酶对M1和M2两个亚型相互转化的作用及其机制,探讨这一过程在动脉粥样硬化发生发展中的意义。
材料和方法
试验材料SPF级C57小鼠购自复旦大学实验动物科学部,饲养过程和实验过程符合《实验动物管理规范》;DMEM培养基购自美国Gibco公司;实时PCR试剂购自上海天根生物有限公司,抗体p-STAT、STAT、p-JAK2、Tublin、F4/80购自Santa Cruz公司。LPS、IFNγ、IL-4购自美国Sigma公司,二抗和荧光二抗购自上海天根生物有限公司。Trizol、RIPA购自日本TAKARA公司,引物由上海桑尼生物科技有限公司合成。PAR2激动剂2-Furoyl-LIGRLO-amide购自美国Sigma公司(批号F3681)。
小鼠骨髓巨噬细胞的分离、培养10周龄C57小鼠,雄性,体质量约20 g,4%水合氯醛麻醉,75%乙醇浸泡消毒15 min,无菌条件下取完整股骨。在股骨两端用针头打孔,DMEM培养液冲洗出全部骨髓细胞,制成单细胞悬液,离心洗涤,接种于事先配好的条件培养基内(DMEM+20%胎牛血清+20%L929细胞培养上清),置37℃、5%CO2培养箱中培养4天,换液去除悬浮细胞。继续用条件培养基培养3天,用免疫荧光法检测巨噬细胞表面标志F4/80以鉴定所分离出的巨噬细胞(对照组)。具体方法为:PBS清洗细胞,甲醇固定,1%Triton溶液作用30 min,F4/80抗体1∶100孵育2 h,PBS清洗5次,荧光二抗孵育1 h,PBS清洗5次,荧光显微镜检测。
M1和M2亚型巨噬细胞的诱导向培养的小鼠骨髓巨噬细胞中加入LPS(终浓度100 ng/m L)和IFN-γ(终浓度20 ng/m L)诱导培养16 h,通过形态学观察及real-time PCR检测M1标记物iNOS、IL-12,鉴定其分化成M1型;另外,向培养的小鼠骨髓巨噬细胞中加入IL-4(终浓度20 ng/m L)诱导培养48 h,通过形态学观察及real-time PCR检测M2标记物arg1、mrc1,鉴定其分化成M2型。
细胞总RNA的提取及real-timePCR用5~10 m L PBS清洗细胞1次,用Trizol裂解液提取RNA,用DEPC处理的水溶解。260 nm/280 nm测定RNA浓度和纯度。用天根公司通用型一步法RT-PCR试剂盒进行逆转录合成cDNA。采用两步法进行real-time PCR扩增,使用CFX96 PCR仪(美国Bio-Rad公司),退火延长温度为62℃,共25个循环,引物序列见表1。
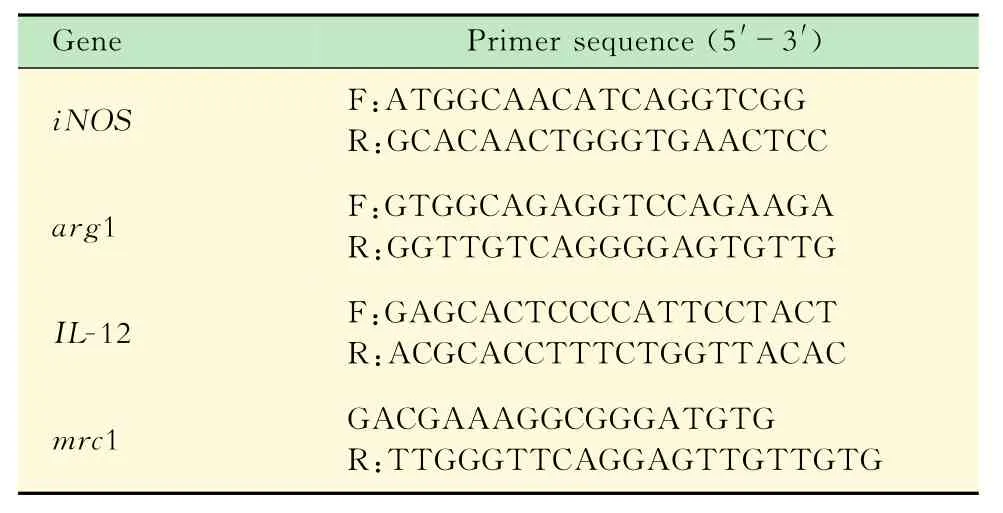
表1 real-time PCR引物序列Tab 1 Primer senses for real-time PCR
细胞总蛋白的提取及Westernblot分析用RIPA裂解液裂解细胞,4℃下9 600×g离心10 min,取上清,BCA法进行蛋白定量。取20~30μL样品进行SDS-PAGE电泳,转膜。用含5%脱脂奶粉的TTBS缓冲液4℃封闭过夜。将一抗1∶1 000室温孵育2 h。TTBS清洗膜5次,每次15 min。二抗1∶1 000室温孵育1 h,洗膜5次。最后用ECL发光系统显色,用图像分析软件BandScan 5.0进行图像扫描及相对定量分析。
统计方法 用SPSS 16.0软件进行t检验,分析基因、蛋白表达水平的差异,P<0.05为差异有统计学意义。
结 果
成功分离培养小鼠骨髓来源巨噬细胞并诱导其分化成M1型、M2型F4/80是一种细胞表面糖蛋白,也是成熟小鼠巨噬细胞的标记物。采用免疫荧光的方法检测细胞表面的F4/80表达情况,显微镜视野内可见90%以上的细胞均显示出荧光(图1),提示巨噬细胞分离培养成功。

图1 F4/80免疫荧光染色检测分离培养的小鼠来源的巨噬细胞Fig 1 Immunofluorescence staining of F4/80 in macrophages derived from murine bone marrow
培养的巨噬细胞中加入1∶1 000的LPS、IFN-γ诱导培养16 h后,细胞形态不规则,较多伪足,呈现M1亚型形态特征(图2B)。real time-PCR结果显示:M1亚型的标志基因iNOS、IL-12表达明显上调,而M2亚型标志基因arg1、mrc1表达没有变化(图2D),提示巨噬细胞已被成功诱导为M1亚型。
向培养的巨噬细胞中加入IL-4诱导24 h后,细胞形态多呈现圆形,少有伪足,表现出M2亚型的形态特征(图2C)。real-time PCR结果显示:M2亚型的标志基因arg1、mrc1表达明显上调,而M1亚型标志基因i NOS、IL-12表达没有变化(图2E),提示巨噬细胞已被成功诱导为M2亚型。
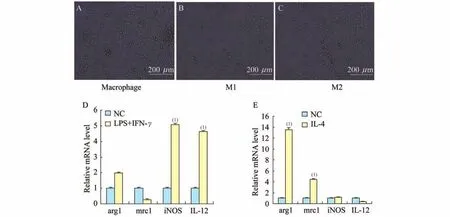
图2 LPS、IFNγ和IL-4分别诱导巨噬细胞分化为M1和M2亚型Fig 2 Macrophages induced into M1 and M2 subtype by LPS、IFNγand IL-4
PAR2激动剂和类胰蛋白酶对巨噬细胞向M1、M2亚型转化的影响为了观察类胰蛋白酶对巨噬细胞M1、M2亚型的转化作用,分别将PAR2激动剂2-Furoyl-LIGRLO-amide和类胰蛋白酶加入M1、M2巨噬细胞培养上清中,使其终浓度为10 ng/m L,分别作用6 h和12 h,收取细胞检测M1、M2标记物的m RNA表达水平(图3、4)。
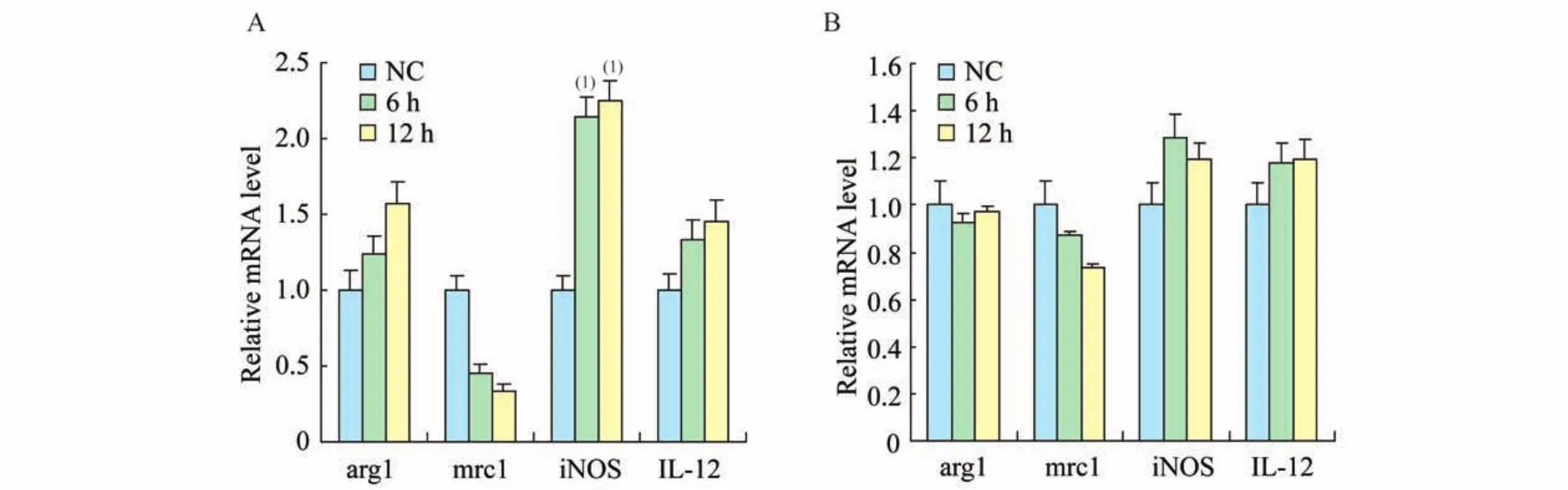
图3 2-Furoyl-LIGRLO-amide和类胰蛋白酶对M1型巨噬细胞的作用Fig 3 The effect of 2-Furoyl-LIGRLO-amide and tryptase on M1 macroghages

图4 2-Furoyl-LIGRLO-amide和类胰蛋白酶对M2型巨噬细胞的作用Fig 4 The effect of 2-Furoyl-LIGRLO-amide and tryptase on M2 macrophages
2-Furoyl-LIGRLO-amide和类胰蛋白酶分别与M1巨噬细胞作用后,均可见M1的标记物iNOS和IL-12的表达水平高于对照组。而M2的标记物arg1和mrc1与对照相比无明显变化(图3A、3B)。说明类胰蛋白酶和2-Furoyl-LIGRLO-amide处理后,具有M1亚型标记物的细胞有所增加,而具有M2亚型标记物的细胞数量无明显变化,提示类胰蛋白酶和2-Furoyl-LIGRLO-amide可以促进向M1巨噬细胞的分化,而不会促进M1向M2转化。
2-Furoyl-LIGRLO-amide和类胰蛋白酶分别与M2巨噬细胞作用后,M2标记物arg1和mrc1均明显下降。PAR2激动剂和类胰蛋白酶处理后,M1巨噬细胞的标记物iNOS和IL-12均有所增加(图4A、4B)。说明PAR2激动剂和类胰蛋白酶处理M2亚型巨噬细胞后,具有M2亚型标记物的细胞明显减少,而M1亚型标记物的细胞略有增多,提示类胰蛋白酶和PAR2激动剂明显促进了M2亚型向M1亚型的转化。
类胰蛋白酶对M1、M2巨噬细胞JAK-STAT信号通路的影响为了研究类胰蛋白酶促进M2型向M1型巨噬细胞转化的机制,我们检测了类胰蛋白酶处理后的M1、M2亚型巨噬细胞中磷酸化JAK2(p-JAK2)以及磷酸化STAT(p-STAT)的蛋白水平(图5)。

图5 类胰蛋白酶分别作用于M1和M2亚型巨噬细胞后p-JAK2、STAT和p-STAT的表达水平的变化Fig 5 The expressions of p-JAK2,STAT and p-STAT in M1 and M2 macrophages treated with tryptase
类胰蛋白酶作用于M1亚型后,JAK2磷酸化水平无明显变化,同时STAT和p-STAT的表达水平变化也不明显(图5);而M2亚型经类胰蛋白酶作用后,JAK2的磷酸化水平随着时间有明显的升高,在处理后45 min时达到最高峰,同时STAT的磷酸化水平也有升高,提示类胰蛋白酶可以通过和PAR2结合,激活JAK2-STAT信号通路,进而引起M2型向M1型转化,起促炎作用。
讨 论
近年来,肥大细胞类胰蛋白酶在动脉粥样硬化中的作用越来越受到关注。本课题组之前的研究发现类胰蛋白酶可作为一个前炎性因子,促进参与动脉粥样硬化形成的血管内皮细胞中IL-1、IL-6、IL-8、TNF-α及SCF等促炎因子的表达与释放,而且该作用是类胰蛋白酶激活内皮细胞表面PAR2,通过PI3K-PKB-NF-κB或p38/MAPK-AP-1信号通路实现的[7]。类胰蛋白酶可以通过抑制核受体LXRα (Liver X receptorα)活化来促进巨噬细胞泡沫化;此外,类胰蛋白酶可通过影响凝血与抗凝血平衡,促进血管新生等途径来促进粥样斑块内出血。类胰蛋白酶还可以通过激活基质金属蛋白酶MMPs促进粥样斑块纤维帽的降解,进而导致不稳定斑块的形成及急性血管事件的发生。可见类胰蛋白酶在动脉粥样硬化的多个环节中起到不同的作用,对动脉粥样硬化的发生发展有很大的影响。
在众多动脉粥样硬化发病机制中,免疫炎症学说一直都得到大家公认和肯定,免疫系统包括先天性和适应性免疫两种,巨噬细胞属于先天性免疫系统,巨噬细胞的亚型分化现象在肿瘤、肥胖、心血管疾病等疾病的发生发展过程中广泛存在,并具有多种调节机制。研究表明,与磷脂酰肌醇3-激酶相关的细胞激酶和磷酸酶能调节M1、M2的定向分化[10]。在肥胖的研究中,全长脂联素可以通过脂联素受体激活IL-4/STAT6通路,促进巨噬细胞向M2抗炎表型的转化[11]。由此提示,在不同的生理病理炎症环境中,调控巨噬细胞亚型分化的因素可能不同。
巨噬细胞在动脉粥样硬化的发生发展中具有重要作用。研究表明,如果缺少巨噬细胞,Apo E基因敲除导致的严重高胆固醇血症尚不足以使小鼠发生动脉粥样硬化病变。斑块中巨噬细胞的增多与动脉粥样硬化的发生发展密切相关,主要表现在:(1)进入动脉内膜下的巨噬细胞可产生许多物质如脂肪酶、活性氧或自由基,进一步使LDL分子氧化形成氧化型LDL(ox-LDL),通过其表达的清道夫受体不断摄取ox-LDL,最终形成泡沫细胞,构成动脉粥样硬化的病理基础;(2)巨噬细胞还可分泌大量的细胞因子(如TNF、单核细胞集落刺激因子等),参与炎性反应,并可促进自身增殖和单核细胞进一步聚集;(3)巨噬细胞还可表达基质金属蛋白酶促进细胞外基质降解,增加斑块的不稳定性。
巨噬细胞是一种极具异质性的细胞群体,在动脉粥样硬化发生发展过程的微环境中存在一系列连续的功能状态,而M1型和M2型巨噬细胞是这一连续状态的两个极端。研究表明,在ApoE基因敲除(ApoE-/-)小鼠动脉粥样硬化的发展过程中,斑块中的巨噬细胞会从抑炎的M2型转变为促炎的M1型[4]。因此,巨噬细胞M2/M1类型转换与动脉粥样硬化斑块的发生发展密切相关。
在动脉粥样硬化的斑块周围存在大量的肥大细胞浸润,并分泌大量的颗粒物,包括类胰蛋白酶,这就是巨噬细胞存在的环境,因此巨噬细胞的亚型分化必然受到周围环境的影响。本研究发现类胰蛋白酶和2-Furoyl-LIGRLO-amide作用于小鼠骨髓来源的巨噬细胞,可以促进M1型上调和M2型下降。进一步发现,这种表型的变化存在着不同的调节机制,类胰蛋白酶可以使M2亚型细胞中JAK2/STAT的磷酸化水平增高,从而激活了这一通路,而对于M1亚型却没有这种作用。因此,类胰蛋白酶可能通过激活M2型巨噬细胞的JAK/STAT信号通路,促进巨噬细胞向炎性亚型M1的转化,这一发现将为继续研究类胰蛋白酶和巨噬细胞在动脉粥样硬化发生发展中的作用提供一个新的方向。
[1]王文,朱曼璐,王拥军,等.中国心血管病报告2012摘要[J].中国循环杂志,2013,28(6):408-412.
[2]Mantovani A,Sica A,Sozzani S,et al.The chemokine system in diverse forms of macrophage activation and polarization[J].Trends Immunol.2004,25(12):677-686.
[3]Gordon S.Alternative activation of macrophages[J].Nat Rev Immunol,2003,3(1):23-35.
[4]Khallou-Laschet J,Varthaman A,Fornasa G,et al. Macrophage plasticity in experimental atherosclerosis[J]. PLoS ONE,2010,5(1):e8852.
[5]Johnson JL,Newby AC.Macrophage heterogeneity in atherosclerotic plaques[J].Curr Opin Lipidol,2009,20 (5):370-378.
[6]Lu C,Zhao F,Li X,et al.Up regulation of interleukin-8 expressions induced by mast cell tryptase via protease activated receptor-2 in endothelial cell line[J].Chin Med J(Engl),2005,118(22):1900-1906.
[7]Ma Y,Zhang B,Qian R,et al.Tryptase activates PKB in inflammatory reaction in ECV304 cells[J].Biochim Biophys Acta,2006,1763(3):313-321.
[8]Yeong P,Ning Y,Xu Y,et al.Tryptase promotes human monocyte-derived macrophage foam cell formation by suppressing LXRαactivation[J].Biochimica Biophys Acta,2010,1801(5):567-576.
[9]Kaartinen M,PenttiläA,Kovanen PT.Mast cells of two types differing in neutral protease composition in the human aortic intima.Demonstration of tryptase and tryptase/chymase-containing mast cells in normal intimas,fatty streaks,and the shoulder region of atheromas[J]. Arterioscler Thromb,1994,14(6):966-972.
[10]Martinez FO.Regulators of macrophage activation[J]. Eur J Immunol,2011,41(6):1531-1534.
[11]Mandal P,Pratt BT,Barnes M,et al.Molecular mechanism for adiponectin-dependent M2 macrophage polarization:link between the metabolic and innate immune activity of full-length adiponectin[J].J Biol Chem,2011,286(15):13460-13469.
Tryptase transforms murine bone marrow derived macrophages to M1 macrophages subtype by activating JAK-STAT pathway through PAR2 in mice
ZHANG Ya-dong1,LU Han-yu,CHEN Liang,LI Xiao-bo2,YIN Lian-hua1,2,WANG Song-mei1△
(1Training Center of Medical Experiments,2Department of Physiology and Pathophysiology,School of Basic Medical Sciences,Fudan University,Shanghai 200032,China)
ObjectiveTo investigate the effects and mechanism of tryptase in macrophages phenotype transformation in mice.MethodsThe molecular markers of macrophages subtype were detected by real-time PCR,and the activation of JAK-STAT pathway was detected by Western blot.ResultsThe murine bone marrow derived macrophages were isolated and induced to M1 or M2 subtype successfully.After PAR2 agonist(2-Furoyl-LIGRLO-amide)or tryptase were added into M1 macrophages,the expression levels of the M1 markers iNOSand IL-12 were increased obviously,while the M2 markers arg 1 or mrc1 had no obvious change.It suggested that tryptase and PAR2 agonistpromoted macrophages differentiating to M1,but did not promote the transformation from M1 to M2. On the other hand,after adding PAR2 agonist or tryptase into M2 macrophages,the expression levels of the M2 markers arg1 and mrc1 were decreased obviously,meanwhile the expression level of M1 markers iNOS and IL-12 increased.It indicated that tryptase or PAR-2 agonists promoted M2 transformating to M1.The expression levels of p-STAT,STAT or JAK2 were not change after tryptase incubated with M1 macrophages.However,incubated with tryptase,the phosphorylation levels of JAK2 and STAT were significantly increased in M2 macrophages,which indicated that tryptase may activated the JAK2-STAT signaling pathway by binding to PAR-2,and then resulted in the conversion M2 to M1 macrophages.ConclusionsTryptase may activate JAK-STAT pathway through the interaction with its receptor PAR2,which results in the murine bone marrow derived macrophages differentiating to M1.This effect plays a role in promoting the development of inflammation,further aggravates the development of atherosclerosis.
tryptase; PAR2; macrophage M1/M2; JAK-STAT; mouse
TQ 925+.2
A
10.3969/j.issn.1672-8467.2015.05.008
2015-04-04;编辑:段佳)
国家自然科学基金面上项目(81270490,81170253);复旦大学上海医学院项目(J1210041)
△Corresponding author E-mail:smwang2@fudan.edu.cn
*This work was supported by the General Project of National Natural Science Foundation of China(81270490,81170253)andthe Project of Shanghai Medical College,Fudan University(J1210041)

