褪黑激素的合成——介绍一个探索性有机化学实验
关玲 徐烜峰 边磊 高杨 张奇涵
(北京大学化学基础实验教学中心 北京 100871)
褪黑激素的合成——介绍一个探索性有机化学实验
关玲徐烜峰边磊高杨张奇涵*通讯联系人,E-mail:zqh@pku.edu.cn
(北京大学化学基础实验教学中心北京 100871)
摘要介绍一个面向大学二年级本科生的探索性实验。基于专利文献方法的合成路线较为适宜学生实验且具有良好训练价值:以邻苯二甲酰亚胺、1,3-二溴丙烷、乙酰乙酸乙酯、对甲氧基苯胺为基本原料,以Japp-Klingemann 反应和Fischer吲哚合成法联用构建吲哚环,经水解脱羧、乙酰化,合成了褪黑激素。对学生在实验中的条件优化探索进行了简要介绍。
关键词探索性实验褪黑激素Japp-Klingemann反应多步合成
The Synthesis of Melatonin
——An Exploratory Organic Chemistry Experiment
Guan LingXu XuanfengBian LeiGao YangZhang Qihan*
(ExperimentalChemistryCenter,PekingUniversity,Beijing100871,China)
AbstractThe synthesis of melatonin is an exploratory experiment completed by second-year undergraduates. The synthetic approach based on the procedure provided by the patent is a short, simple, and industrially feasible process suitable for organic chemistry laboratory. The formation of the indole ring is completed based on Japp-Klingemann reaction and Fischer indole synthesis using phthalimide, 1,3-dibromo-propane, ethyl acetoacetate and 4-anisidine as the main reactants. Melatonin forms after hydrolyzation, decarboxylation and acetylation of the indole ring. The optimization of conditions is also discussed briefly.
Key WordsExploratory experiment; Melatonin; Japp-Klingemann reation; Multi-step synthesis
褪黑激素(N-乙酰-5-甲氧基色胺(1),melatonin)是一种神经系统激素,它具有广泛的生理活性。最早由耶鲁大学的学者Aaron Lerner等人在1958年从松果腺中分离得到[1-2],因而又称松果腺素。研究资料表明褪黑激素具有多种生物活性和多方面的商业应用前景[3]。
褪黑激素的合成引起了很多有机合成化学家的兴趣,发展了多条合成路线。早期的合成方法是从3,5-二取代的吲哚出发进行的结构修饰[4],之后出现的一些以简单的取代苯化合物出发的合成,才是真正意义上的全合成。其中,Franco等人的路线[5]最为引人入胜,利用Japp-Klingemann反应和Fisher吲哚合成反应巧妙地设计了一条从简单易得的廉价原料制备褪黑激素的路线。 这条合成路线的每步收率都较高,且纯化方法多为重结晶,适于工业生产,是褪黑激素合成研究中的重要发现。基于此,我们选择了该合成路线作为基本方法,参考其他文献[6-7],并在教学过程中,通过学生实验逐步筛选出在反应试剂、反应条件、反应时间、纯化方法等各方面均适于有机化学实验教学的实验条件,具体介绍如下。
1实验原理
Franco等以邻苯二甲酰亚胺钾、1,3-二溴丙烷、对甲氧基苯胺为主要原料,经5步反应合成了褪黑激素(图1):以邻苯二甲酰亚胺钾与1,3-二溴丙烷反应得到N-(3-溴丙基)-邻苯二甲酰亚胺,在碱存在下与乙酰乙酸乙酯反应得到2-乙酰基-5-邻苯二甲酰亚氨基戊酸乙酯,与对甲氧基苯胺重氮盐偶联后环化,得到2-羧乙基-3-(2-邻苯二甲酰亚氨乙基)-5-甲氧基吲哚,再经氢氧化钠皂化水解、脱羧后,得到5-甲氧基色胺,经乙酰化后得到褪黑激素。实验教学中最早即按照此方法的路线及反应条件进行实验。实践证明,该方法具有较好的可重复性,但从实验课教学角度需要解决的问题是:减少反应投料量,在有效控制副反应、促使主反应进行得较为彻底的同时,尽量缩短反应时间、简化后处理,使得多数实验者可以在6~7次的实验中完成合成。
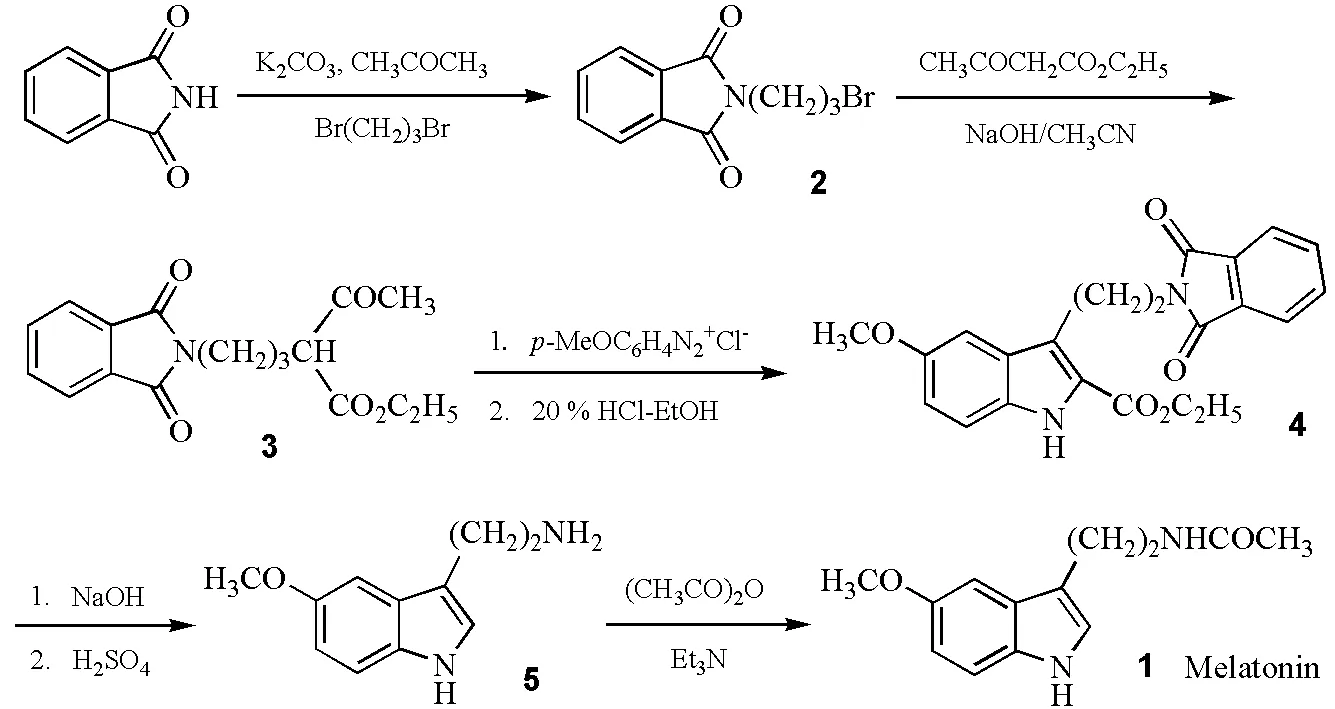
图1 褪黑激素的合成
2仪器与试剂
2.1 仪器
磁力搅拌器,循环水式多用真空泵,显微熔点仪,紫外分析仪,旋转蒸发仪,核磁共振仪,电子天平,一套小量半微量磨口玻璃仪器。
2.2 试剂
邻苯二甲酰亚胺,1,3-二溴丙烷,乙酰乙酸乙酯,无水乙酸钠,4-甲氧基苯胺,氢氧化钠,氢氧化钾,无水乙醇,丙酮,无水乙醚,二氯甲烷,甲醇,无水硫酸钠,无水氯化钙,浓盐酸,硫酸,亚硝酸钠。
3参考实验步骤
3.1 N-(3-溴丙基)邻苯二甲酰亚胺(2)
将4.4g(30mmol)邻苯二甲酰亚胺,6.7g(33mmol)1,3-二溴丙烷以及12.4g(90mmol)碳酸钾加入100mL圆底烧瓶中,加入30mL丙酮,搅拌回流2h,TLC检测原料基本转化完全。产物经硅胶短柱层析,洗脱液经旋蒸除去溶剂,得到白色固体。抽滤,用石油醚洗涤固体,再经重结晶或柱层析纯化,得白色晶体,收率70%~80%。mp72~75℃(EtOH)。
1H NMR(CDCl3):δ=7.80~7.90(m,2H),7.75(m,2H),3.85(t,2H),3.45(t,2H),2.30(m,2H)。
3.2 2-乙酰基-5-邻苯二甲酰亚氨基戊酸乙酯(3)
在100mL 圆底烧瓶中加入2.68g(10mmol)N-(3-溴丙基)-邻苯二甲酰亚胺,3.90g(30mmol)乙酰乙酸乙酯,0.60g(15mmol)NaOH,0.35g(2.5mmol)NaI,25mL CH3CN,搅拌回流1h。产物经硅胶柱层析分离,得到白色固体,收率约70%。mp56~58℃。
IR:1739,1713,1401,1244,1192,1145,1043,725cm-1。1H NMR(CDCl3):δ=7.75(m,4H),4.15(q,2H),3.7(t,2H),3.5(t,1H),2.25 (s,3H),1.5~2.0(m,4H),1.25(t,3H)。
3.3 2-羧乙基-3-(2-邻苯二甲酰亚氨基乙基)-5-甲氧基吲哚(4)
3.3.1对甲氧基苯胺重氮盐的制备
在锥形瓶中加入1.31g(10.6mmol)对甲氧基苯胺、6.1mL H2O、4.1mL浓盐酸,加热溶解成均相后用冰盐浴冷却,保持温度低于-3℃,搅拌下滴加2mL含0.80g(12mmol)NaNO2的水溶液。室温放置30min得到棕红色重氮盐溶液。
3.3.2Japp-Klingemann反应
在圆底烧瓶中加入3.1g(9.8mmol)2-乙酰基-5-邻苯二甲酰亚氨基戊酸乙酯、3.9g(48mmol)NaOAc、35mL EtOH,加热溶解后在搅拌下于冰浴中冷却。搅拌中滴加上述棕红色重氮盐溶液,冰浴下搅拌1h。室温下继续搅拌3h。将反应液倒入100mL水中,用150mL CH2Cl2萃取3次,合并有机相,水洗两次,无水硫酸钠干燥,旋蒸除去CH2Cl2,得棕色黏稠状液体。
3.3.3Fischer吲哚合成
向所得液体中加入5mL无水乙醇溶解,搅拌下缓慢滴加10mL 20% HCl-EtOH溶液,滴加完成后,回流反应2h。冰水浴冷却,过滤析出的固体,分别用甲醇、水、甲醇洗涤固体,得到浅褐色粉末状固体(4),收率约为80%。无需进一步纯化,可直接用于下步反应。
IR:3324,1772,1719,1683,1393,1261,1219,1017,716cm-1。1H NMR(DMSO+CDCl3):δ=11.3(brs,1H),7.8(m,4H),7.3(d,1H),7.0(s,1H),6.8(d,1H),4.3(q,2H),3.9(t,2H),3.8(s,3H),3.7(t,2H),1.4(t,3H)。
3.4 5-甲氧基色胺(5)
在圆底烧瓶中加入2.95g(7.5mmol)2-羧乙基-3-(2-邻苯二甲酰亚氨基乙基)-5-甲氧基吲哚(4),加入14mL 12% NaOH溶液,加热回流2h,得黄色澄清溶液。稍冷后搅拌下慢慢加入38mL 20%硫酸,回流5h,冰浴冷却,过滤,滤液用二氯甲烷萃取除去可溶性杂质。水溶液以冰浴冷却,搅拌下慢慢滴加30% NaOH至pH=9~10,二氯甲烷萃取,有机相水洗后用无水硫酸钠干燥,旋蒸除去二氯甲烷,得黄色固体,收率60%~70%。mp120~122℃。
IR:3349,3197,1662,1499,1215,1110,1024,808,776cm-1。1H NMR(CDCl3):δ=9.2(brs,1H),7.25(m,1H),7.0(m,2H),6.8(m,1H),3.8(s,3H),2.8~3.1(m,4H),2.5(brs,2H)。
3.5 褪黑激素 Melatonin(1)
将0.90g(4.7mmol)5-甲氧基色胺(5)溶于10mL二氯甲烷, 滴加2.1mL(15mmol)Et3N及1.0mL(10mmol)Ac2O,室温搅拌20~60min。TLC监测至反应完全。加入10mL水,分液,水相用二氯甲烷萃取两次,合并有机相,水洗,有机相用无水硫酸钠干燥,旋蒸除去溶剂,硅胶柱层析纯化,得褪黑激素黄色固体,收率约80%。mp116~117℃。
IR:3304,1629,1586,1555,1489,1212,1176,1041cm-1。1H NMR(CDCl3):δ=8.1(brs,1H),7.3(d,1H),7.05(brs,2H),6.9(d,1H),5.6(brs,1H),3.9(s,3H),3.6(m,2H),2.95(t,2H),1.95(s,3H)。
4讨论分析
纵观本实验所选的褪黑激素合成的各步反应,基本上均为较易完成的方法,实验成功率很高,一般不会出现彻底失败或收率极低的情况。问题集中在如何提高收率、减少副产物生成以及如何用简便高效的反应后处理纯化方法来快速得到足够量的中间体进行下步反应,且其纯度不会影响反应进行或带来影响下一步产物的纯化问题。其中探索得到的所谓理想条件,要求适于有机化学实验中的时间因素,即不能有过长反应时间,中间体纯化时间不能影响实验进程,能够达到中等收率60%~80%。以下分述各步反应中的主要影响因素,有关条件实验及初步结论均来源于学生实验。
(1)N-(3-溴丙基)邻苯二甲酰亚胺的合成。
最初依据的文献为采用邻苯二甲酰亚胺钾与大大过量的1,3-二溴丙烷反应,存在的问题一是多出一步邻苯二甲酰亚胺钾的制备(由邻苯二甲酰亚胺与氢氧化钾在无水乙醇中反应);二是反应时间较长;三是会生成二取代产物,同时1,3-二溴丙烷用量很大(价格较高,而回收之后的试剂学生往往不愿意使用)。因以上原因,在开设两年之后学生更倾向于探索以邻苯二甲酰亚胺在碳酸钾存在下与1,3-二溴丙烷反应的方法,主要探讨了反应溶剂(丙酮、DMF等)、反应温度及1,3-二溴丙烷使用量对反应时间及产率的影响,目前较为理想的反应条件如实验步骤中所示。
(2) 2-乙酰基-5-邻苯二甲酰亚氨基戊酸乙酯的合成。
文献方法最初为以乙醇钠为碱在无水乙醇中反应,其问题一是时间较长(4小时左右),二是需要使用金属钠,反应中会有氧代产物等。学生实验中探索了碱(碳酸钾、碳酸钠、叔丁醇钾、氢氧化钠、氢氧化钾、氢氧化锂等)、溶剂(丙酮、甲醇、乙醇、二氧六环、四氢呋喃、乙腈、DMF、甲苯等)、温度(60~100 ℃)等不同组合及碱、乙酰乙酸乙酯使用量对反应时间、收率、副反应控制、产物纯化过程的影响。目前较为理想的条件为氢氧化钠-乙腈体系。
(3) 2-羧乙基 -3-(2-邻苯二甲酰亚氨基乙基)-5-甲氧基吲哚的合成。
利用Japp-Klingemann 反应和Fischer吲哚合成法联用构建褪黑激素的吲哚环是本实验所选的合成路线的精华所在,学生普遍的反映是条件非常成熟,基本可以得到较好的实验结果,而产品可直接用于后面的水解脱羧,不需要进行特别的纯化。文献中一般是使用10% HCl-乙醇溶液进行关环反应,在本实验中采用的20% HCl-乙醇溶液具有更好的效果。
(4) 5-甲氧基色胺及褪黑激素的制备。
这两步反应问题较少,其中乙酰化需要注意可能会有二乙酰化的产物,反应需要在温和条件下进行,产品一般需要通过柱层析进行纯化。
限于篇幅,我们仅对学生实验中的探索进行了概要的说明,有很多细节不便展开。需要特别说明的是,以上所述条件优化及初步结果,均为历届学生在实验中的探索,其优化的条件自己可以较好地重现,但却经常出现前届学生的实验结果被后届学生否定、再重新进行优化条件探索的情况。我们教学组认为,实际上见于文献报道的实验条件以及学生自己优化的实验条件可能均具有良好的可行性,但因为学生是首次接触该实验,因其在实验中对实验条件把握的差别、实验操作习惯和能力的差别,导致出现重现性的差别。对于我们这样一个实验教学课而言,实验项目是一个训练的载体,我们期望学生在实验中能够有自己的探索空间,从中得到经验教训和收获;所以这种看似矛盾的情况却是我们乐于见到的。
感谢自2008年本实验开设以来参加实验教学的田世良、陈瀚、孙长亮、陈庆德、蒋星、张子旸、耿巍芝、王兮、蔡康、骆周扬、郝伟、窦锦虎、王婕妤、顾克骅等教师、研究生助教和2006~2013级选课学生的参与合作。
参考文献
[1]Aaron B L,James D C,Yoshiyata Takahashi,etal.JAmChemSoc,1958,80:2587
[2]Aaron B L,James D C,Richard V H.JAmChemSoc,1959,81:6084
[3]Michael E F,Thomas A C,James A C,etal.JMedChem,1979,22:63
[4]Szmuszkovicz J,Anthony W,Heinzelman R.JOrgChem,1960,25:857
[5]Fraschini F,Dibella L,Duranti E,etal.EurPatAppl,EP 330625,1989
[6]Prabhakar C,Kumar N V,Reddy M R,etal.OrgProcessResDev,1999,3:155
[7]王家旺,张慧.精细化工,1999,2:16
中图分类号O6;G64
doi:10.3866/pku.DXHX20150343

