细胞DNA定量分析在鉴别良恶性胸腹水中的应用价值
陶 伟,李俊
细胞DNA定量分析在鉴别良恶性胸腹水中的应用价值
陶 伟,李俊
目的通过与液基细胞学(LBC)诊断比较,探讨细胞DNA定量分析技术(DNA-ICM)在良恶性胸腹水诊断中的应用价值。方法收集417例胸腹水标本,分别采用LBC和DNA-ICM两种方法判定其良恶性,并将两种结果进行对比。结果417例胸腹水标本均经临床或病理诊断证实,213例为恶性,204例为良性。DNA-ICM在胸腹水良恶性诊断中的敏感度、特异度、准确度、阳性预测值、阴性预测值分别为89.7%、100%、94.7%、100%、90.3%;而LBC分别为63.4%、81.9%、72.4%、78.5%、68.2%;两者之间敏感度、特异度、准确度、阳性预测值、阴性预测值差异均有统计学意义(P<0.01)。结论DNA-ICM在诊断胸腹水良恶性方面有较大应用价值,与LBC联合使用可提高胸腹水阳性检出率,降低漏诊率。
DNA定量分析技术;液基细胞学;腹水;胸水
胸腹水是常见的临床体征,病因比较复杂,其良恶性的鉴别也是临床上的难点。恶性胸腹水常见于原发性或转移性肿瘤,恶性胸腹水的有无对临床医生在治疗上有指导意义。目前细胞学是鉴别浆膜腔积液良恶性的主要手段,液基细胞学(liquid-based cytology,LBC)检查简单易行,是临床上鉴别胸腹水良恶性的一种常规诊断方法,但主要是形态学定性诊断,对于高度增生的间皮细胞、良恶性间皮瘤细胞以及转移性腺癌细胞的鉴别诊断较为困难[1]。新兴的细胞DNA定量分析技术(DNA image cytometry,DNA-ICM)通过分析细胞核内DNA结构和含量的变化,判断细胞是否发生癌变。研究[2]显示在大多数恶性胸腹水中均可发现DNA倍体异常细胞。异倍体细胞的出现反映染色体结构和数目发生异常变化,也是细胞恶变的早期特征[3]。该研究通过与LBC诊断相比较,探讨DNA-ICM在良恶性胸腹水诊断中的临床价值。
1 材料与方法
1.1 病例资料收集2014年5月~10月安徽医科大学第一附属医院住院患者所送肿瘤内科细胞室的胸腹水标本417例,标本均经临床或病理诊断证实。其中恶性胸腹水213例(肺癌56例、乳腺癌41例、宫颈癌4例、子宫内膜癌14例、胃癌35例、十二指肠癌23例,结肠癌18例、直肠癌12例、肝癌9例、恶性间皮瘤1例),良性胸腹水204例(结核性胸膜炎27例、肺炎49例、支气管扩张5例、呼吸衰竭17例、冠心病26例、肝硬化55例、结核性腹膜炎8例、肠梗阻2例、盆腔结核15例)。男238例,女179例;年龄16~91岁,中位年龄57.9岁。对每例患者胸腹水标本同时采用DNA-ICM和LBC检查。
1.2 仪器与耗材液基沉降式染色机(广州安必平医疗科技有限公司);全自动细胞DNA图像定量分析系统(厦门麦克奥迪医疗诊断有限公司);细胞保存液以及相关制片试剂(厦门麦克奥迪医疗诊断有限公司)。
1.3 方法每例100~150 ml新鲜胸腹水标本采用沉降式LBC技术制成4张薄层细胞片,2张薄层细胞片行巴氏染色进行LBC检查。2张薄层细胞片行Feulgen染色行DNA-ICM。
1.3.1 LBC诊断 所有巴氏染色片由我科经验丰富的肿瘤细胞学专家做出诊断。胸腹水LBC诊断结果分为4级,Ⅰ级:未见肿瘤细胞;Ⅱ级:查见少数异型细胞;Ⅲ级:查见可疑癌细胞;Ⅳ级:查见癌细胞。作统计分析时将Ⅰ级和Ⅱ级定为阴性,Ⅲ级和Ⅳ级定为阳性。
1.3.2 DNA-ICM诊断 所有Feulgen染色片用全自动扫描图像分析系统进行扫描处理,该系统由全自动数码显微镜Motic BA600以及摄像头205C对每张玻片8 000个以上的细胞核进行扫描测定,以同张玻片上的正常细胞为标准对照,并依据细胞核及核内DNA的132个参数对被检细胞进行自动分类和计数,其中DNA指数(DNA index,DI)为最关键的参数,可表示细胞中DNA含量。如为正常细胞,DI值多为1左右。如为正常增生或疑似病变细胞,则1<DI<2.5。如为病变细胞,则DI≥2.5。根据DNA-ICM所做的分析结果分为3级,Ⅰ级:以正常二倍体细胞为主,未见异倍体细胞以及异倍体细胞峰;Ⅱ级:可见少量DNA异倍体细胞(1~2个细胞,DI≥2.5);Ⅲ级:可见大量DNA异倍体细胞(3个或3个以上细胞,DI≥2.5)以及异倍体细胞峰。只要出现DI≥2.5以上的细胞玻片,都要经过肿瘤细胞学专家在显微镜下进行核实,以排除系统将垃圾和重叠的细胞核误认为癌细胞或异常细胞。作统计分析时将Ⅰ级定为阴性,Ⅱ级和Ⅲ级定为阳性。
1.4 统计学处理采用SPSS 16.0软件进行分析,率的比较采用χ2检验。
2 结果
2.1 两种检查方法结果比较213例恶性胸腹水标本中,LBC检测135例阳性;DNA-ICM检测191例阳性,其中162例出现3个或3个以上DI≥2.5的异倍体细胞或异倍体细胞峰,29例出现1~2个DI≥2.5的异倍体细胞。LBC查见癌或疑癌细胞的135例患者标本中,DNA-ICM检测有129例出现DI ≥2.5的异倍体细胞。LBC查见少数异型细胞的55例标本中,DNA-ICM检测有44例出现DNA指数(DI)≥2.5的异倍体细胞。6例LBC检查为阳性而DNA-ICM检测为阴性。204例良性胸腹水中,LBC检测有37例出现假阳性,而DNA-ICM检测全部阴性。见表1、图1~3。
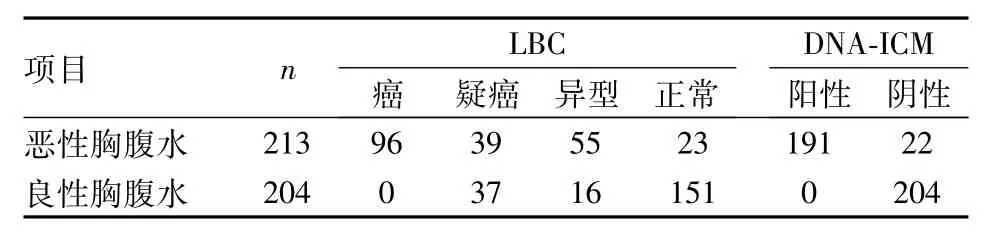
表1 417例良恶性胸腹水DNA-ICM与LBC诊断结果(n)
2.2 两种检查方法敏感度、特异度、准确度、阳性预测值、阴性预测值比较417例良恶性胸腹水标本中,DNA-ICM敏感度为89.7%(191/213)、特异度为100%(204/204)、准确度为94.7%[(191+204)/(213+204)]、阳性预测值为100%(191/191)、阴性预测值为90.3%[204/(22+204)],高于LBC敏感度63.4%[(96+39)/213]、特异度81.9%[(16+151)/204]、准确度72.4%[(96+39 +16+151)/(213+204)]、阳性预测值78.5%[(96+39)/(96+39+37)]、阴性预测值68.2%[(16+151)/(16+151+55+23)],差异均有统计学意义(P<0.01)。
2.3 两种检查方法与联合检查的比较DNA-ICM的敏感度为89.7%,LBC的敏感度为63.4%,联合检查的敏感度为92.5%[(191+6)/213]。联合检查的敏感度高于LBC,差异有统计学意义(P<0.01),提示联合检查优于LBC。联合检查的敏感度高于DNA-ICM,但差异无统计学意义。
3 讨论
LBC检查是临床上鉴别胸腹水良恶性的一种常规检查方法,其应用于胸腹水的诊断虽然克服了传统细胞学中细胞成分少、背景不清、涂片厚薄不一等缺点,但由于胸腹水中细胞数量比较少、细胞形态不典型,常常难以判断其良恶性。随着新的辅助诊断技术不断出现,在诊断的过程中可以借助免疫细胞学和肿瘤标志物检测方法,但由于其敏感度不高而易引起漏诊[4-5]。DNA是细胞生长、分化和繁殖的基础,当细胞发生癌变时,细胞内DNA的含量和DNA在细胞核内的分布以及排列方式均发生不同程度的改变,而这种改变是细胞癌变过程中最早期的变化[6]。正常细胞和肿瘤细胞在生长和增殖过程中,细胞内的DNA含量均可发生变化,但肿瘤细胞的恶性本质决定了其DNA含量变化的幅度和增殖的速度都与处于正常分裂周期的细胞有所区别,因此可以通过定量检测细胞DNA含量变化来判定细胞是否发生癌变。
人体90%细胞都处于细胞周期中的静止期,胸膜腔和腹膜腔表层的间皮细胞都属于这一期,其DI 为1。当间皮细胞处于分裂期时,其DI随着细胞核内DNA合成和染色体的分离发生变化,但应该都在1~2之间,因此细胞DNA含量变化可以直接反映细胞增殖的能力。恶性胸腹水中的肿瘤细胞具有无限增殖能力,其细胞核DNA的含量明显增加,测定细胞核DNA含量可以作为判断恶性胸腹水的客观依据[7]。
近年来应用DNA-ICM鉴别细胞的良恶性已经越来越受到临床医师的重视,并在宫颈癌、乳腺癌、食管癌、口腔肿瘤等多种肿瘤早期诊断中取得较高的诊断价值[8-11],但在浆膜腔积液中的研究报道较少。本研究中DNA-ICM检测胸腹水良恶性的敏感度、特异度分别为89.7%、100%,高于Kentrou et al[12]报道的85.1%、97.8%。同时研究显示恶性胸腹水中,LBC检测阳性的135例标本中,DNA-ICM检测129例为阳性,这是因为DNA-ICM只能对DNA倍体已经发生改变的肿瘤细胞做出诊断,对DNA倍体未发生改变的二倍体肿瘤检测呈假阴性。另外,本研究显示在恶性胸腹水中,LBC查见少数异型细胞的55例标本中,DNA-ICM测定44例为阳性。这可能是由于细胞在发生癌变的过程中,细胞核DNA的含量和结构的变化先于细胞形态的改变。
本研究中DNA-ICM检测的敏感度、特异度高于LBC的敏感度、特异度,检测效果优于LBC。DNAICM通过全自动数码显微镜进行阅片,仔细扫描每一个视野,降低了漏检的可能,提高了检测的敏感度[13];通过图像分析系统自主分析,测出每一个细胞DNA含量的具体数值,客观准确,提高了检测的特异度和准确度。
综上所述,DNA-ICM的敏感度、特异度均较LBC检查有优势,两种检查方法联合有较大的诊断价值,可应用于临床,指导治疗。
[1] Bisht B,Handa U,Mohan H,et al.Complementary value of DNA flow cytometry and image morphometry in detection of malignant cells in effusion fluids[J].Malays J Pathol,2014,36(2):83-90.
[2] Meng Z,Shi J,Zhu C,et al.Automated quantification of DNA aneuploidy by image cytometry as an adjunct for the cytologic diagnosis of malignant effusion[J].Anal Cell Pathol(Amst),2013,36 (3-4):107-15.
[3] 王永军,王 珩,刘世正,等.细胞DNA定量分析在脱落细胞学诊断中的应用[J].临床与实验病理学杂志,2011,27(2):150-3.
[4] Knoepp S M,Placido J,Fields K L,et al.The application of immunocytochemistry to direct smears in the diagnosis of effusions [J].Diagn Cytopathol,2013,41(5):425-30.
[5] Liu F,Kong X,Dou Q,et al.Evaluation of tumor markers for the differential diagnosisof benign and malignant ascites[J].Ann hepatol,2014,13(3):357-63.
[6] 田玉旺,刘 光,周 建,等.细胞DNA定量分析技术在宫颈癌及癌前病变早期筛查中的应用价值[J].诊断病理学杂志,2013,20(7):425-8.
[7] Carpagnano G E,Costantino E,Palladino G P,et al.Microsatellite alterations and cell-free DNA analysis:could they increase the cytology sensitivity in the diagnosis of malignant pleural effusion?[J].Rejuvenation Res,2012,15(3):265-73.
[8] Duarte C E,Carvalho C R,Silva-Filho A L,et al.Adaptation of image cytometry methodology for DNA ploidy analysis of cervical epithelium samples:a pilot study[J].Taiwan J Obstet Gynecol,2014,53(2):227-31.
[9] Ermiah E,Abdalla F,Buhmeida A,et al.Prognostic significance of DNA image cytometry in Libyan breast cancer[J].Oncology,2012,83(3):165-76.
[10]Zhao L,Wei W Q,Zhao D L,et al.Population-based study of DNA image cytometry as screening method for esophageal cancer [J].World J Gastroenterol,2012,18(4):375-82.
[11]Kämmerer P W,Koch F P,Santoro M,et al.Prospective,blinded comparison of cytology and DNA-image cytometry of brush biopsies for early detection of oral malignancy[J].Oral Oncol,2013,49(5):420-6.
[12]Kentrou N A,Tsagarakis N J,Tzanetou K,et al.An improved flow cytometric assay for detection and discrimination between malignant cells and atypical mesothelial cells,in serous cavity effusions[J].Cytometry B Clin Cytom,2011,80(5):324-34.
[13]Demirel D,Akyürek N,Ramzy I.Diagnostic and prognostic significance of image cytometric DNA ploidy measurement in cytological samples of cervical squamous intraepithelial lesions[J].Cytopathology,2013,24(2):105-12.
Application of DNA image cytometry in distinguishing benign and malignant pleuroperitoneal fluids
Tao Wei,Li Jun
(Dept of Oncology,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
ObjectiveTo investigate the value of DNA image cytometry in thediagnose of benign and malignant pleuroperitoneal fluids by comparing with the liquid-based cytological results.MethodsThere were 417 cases involved in this study.Pap stain for cytology analysis and feulgen stain for DNA image cytometry were used to identify benign and malignant pleuroperitoneal fluids respectively,then compared the results of the two methods.ResultsClinically or pathologically,213 were classified as malignant and the other 204 as benign.The sensitivity,specificity,accuracy,positive predictive value and negative predictivevalue of DNA image cytometry were 89.7%,100%,94.7%,100%,and 90.3%,respectively.However,the sensitivity,specificity,accuracy,positive predictive value and negative predictive value of liquid-based cytology were 63.4%,81.9%,72.4%,78.5%,and 68.2%,respectively.There were significant differences in thesensitivity,specificity,accuracy,positive predictive value and negative predictivevalue.ConclusionDNA image cytometry has great application value in the diagnosis of benign and malignant pleuroperitoneal fluids,and can increase the positive rate,reduce misdiagnosed rate with liquidbased cytology.
DNA image cytometry;liquid-based cytology;peritoneal effusion;pleural effusion
R 446.82
A
1000-1492(2015)07-1016-04
2015-03-27接收
卫生部医药卫生科技发展研究项目(编号:W2013GJ42)
安徽医科大学第一附属医院肿瘤内科,合肥 230022
陶 伟,男,硕士研究生;李 俊,女,教授,主任医师,硕士生导师,责任作者,E-mail:93lijun@163.com

