杨凌某羊场羊口疮病毒的分离鉴定
张 瑜,高晶晖,张立强,高 洋,贾云晓,陈德坤
(西北农林科技大学动物医学院,陕西杨凌 712100)
羊口疮(Orf)又叫羊接触传染性脓疱皮炎(Contagious pustular dermatitis),是由羊口疮病毒(Orf virus,ORFV)引起的一种接触性传染病。病毒主要感染绵羊和山羊,山羊比绵羊易感,羔羊比青年羊更易感,羊感染后口唇部产生增生性损伤[1]。3月龄~6月龄的羔羊发病率一般为95.4%左右,致死率一般在0~93%之间[2]。羊口疮在世界各养羊国家中分布较为广泛,对养羊业造成较大的威胁[3]。在我国青海、宁夏、新疆、陕西、吉林、四川、黑龙江、西藏和甘肃等地都有羊口疮流行的相关报道,给养羊业造成了较大的损失[4-6]。文献报道[7],近年来羊口疮病毒分离株出现了基因变异,这些变异是否会导致我国羊口疮弱毒疫苗免疫保护效果下降,还存在一些争议。因此,有必要对我国各地羊口疮野毒株进行分离和基因分析,以便为羊口疮防控策略和具体措施制定提供参考。
1 材料与方法
1.1 材料
1.1.1 试验用动物 具有典型羊口疮临床症状的山羊,来自杨凌某养殖场。
1.1.2 犊牛睾丸 采自1日龄犊牛。
1.1.3 主要试剂 M199培养基为Gibco公司产品;胎牛血清、胰酶、二甲基亚砜均为Amresco公司产品;乙醇、氯化钠、氯化钾、磷酸氢二钾、磷酸二氢钠、碳酸氢钠、葡萄糖、琼脂糖等为国产或进口分析纯;PCR相关试剂为TaKaRa公司产品。
1.1.4 主要仪器 CO2培养箱,高压蒸汽灭菌器,各量程移液器,离心机,电子分析天平,冰箱,恒温循环水浴锅,-70℃冰箱,超净工作台,倒置显微镜,PCR仪,电泳仪等。
1.2 方法
1.2.1 病料采集与处理 采集患病羔羊口唇部结痂,置5mL离心管中,加入10g/L青、链霉素的PBS液3mL,4℃放置过夜。用组织匀浆器将病料充分研磨,2 000r/min离心10min,取上清用0.22μm微孔滤膜过滤,收集滤液,置-20℃保存备用。
1.2.2 犊牛睾丸原代细胞的制备 将犊牛睾丸用750mL/L的酒精消毒,剪去筋膜组织,PBS冲洗睾丸实质组织。将组织剪成小块,加入2.5g/L胰酶于4℃放置14h后,用PBS液洗涤多次,直至胰酶冲洗干净,加入无血清M199培养基反复吹打组织至细胞完全散开。将犊牛睾丸细胞悬液移入细胞培养瓶,37℃、体积分数为5%CO2条件下培养。
1.2.3 病毒增殖 待培养的犊牛睾丸原代细胞铺满瓶底约80%时,弃培养基,接种500μL痂毒滤液,在37℃、体积分数为5%CO2培养箱中作用1h。再加入含50mL/L犊牛血清的M199培养基10mL,37℃、体积分数为5%CO2条件下继续培养。前4代未观察到明显的病变(CPE),接毒72h后反复冻融细胞3次,收集病毒液,盲传至第5代犊牛睾丸原代细胞出现明显CPE,当70%~80%的细胞发生病变、脱落时,将培养细胞反复冻融3次,收集病毒液。
1.2.4 病毒滴度测定 收集第5代细胞毒。参照本实验室建立的方法[8]测定病毒滴度。主要操作程序如下,用96孔细胞培养板培养犊牛睾丸原代细胞72h后,接种10倍稀释的病毒液,从10-1~10-10每个稀释度接种一列,每孔接种100μL,第11和12列作为细胞空白对照。然后置于37℃、体积分数为5%CO2培养箱中培养,连续7d观察发生细胞病变的孔数。根据Reed-Muench氏法计算病毒的TCID50。
1.2.5 B2L、F1L基因的PCR检测 用氯仿-异戊醇方法提取第5代病毒液的DNA,参照本实验室建立的羊口疮病毒B2L、F1L基因PCR检测方法[9]进行检测。B2L、F1L引物分别参照登录号为JN565696.1和HQ221964.1的羊口疮病毒基因序列设计。PCR反应体系为:dNTP 2μL,Ex Taq buffer 2.5μL,MgCl22μL,Ex Taq 0.25μL,模板(Template)2μL,引物(Primer)各1μL,ddH2O 18.25μL。PCR 反应程序为:95℃ 5min;94℃45s,56℃30s,72℃70s,共30个循环;最后72℃10min。反应结束后,用含15g/L的琼脂糖凝胶进行电泳检测。将PCR产物送往南京金斯瑞公司进行测序,测序结果与参照序列进行比对,以确定扩增的片段是否为羊口疮病毒的基因片段。
2 结果
2.1 发病羊的临床症状
此羊场发病羊为30日龄~45日龄,临床可见病羊口唇部周围产生红斑,伴有轻微肿胀。在感染3d~5d内产生水疱和脓疱,严重者脓疱破裂后暴露出出血创面。溃烂的脓疱最终融合形成灰色痂皮(图1)。由于口唇部的病变,引起羔羊采食和吮乳困难,羔羊严重消瘦,有的羔羊发生继发感染。

图1 羊口疮发病羊照片Fig.1 Photoes of lamb infected with Orf virus
2.2 分离病毒引起的细胞病变观察
研磨液接种至犊牛睾丸原代细胞,盲传至第5代时,接种的细胞产生明显病变。病变细胞出现折光性增强、变圆、聚堆等现象,后期细胞发生皱缩、脱落,CPE达90%(图2),而正常对照的犊牛睾丸原代细胞生长状态良好(图3)。

图2 接毒72h后发生细胞病变的犊牛睾丸原代细胞(20×)Fig.2 Cytopathic effects in calf testis primary cells 72hafter inoculation(20×)

图3 正常犊牛睾丸原代细胞(20×)Fig.3 Normal calf testis primary cells(20×)
2.3 第5代病毒滴度测定
取引起细胞病变的第5代病毒液100μL进行倍比稀释,将不同稀释度的羊口疮病毒液接种到犊牛睾丸原代细胞上,测定其 TCID50。按 Reed-Muench氏法,测得第5代病毒液滴度为107.66TCID50/mL(表1)。
2.4 分离毒株的PCR检测
分别用羊口疮病毒B2L基因和F1L基因的特异性引物扩增到540bp和437bp的基因片段,与预期扩增片段大小一致(图4和图5),将PCR扩增产物测序,测序结果用DNA Man进行比对,B2L基因片段与参比序列JN565696.1的基因序列的相似度为96.57%,F1L的扩增片段与参比序列HQ221964.1的基因序列的相似度为96.43%(图6和图7),确定分离到羊口疮病毒。
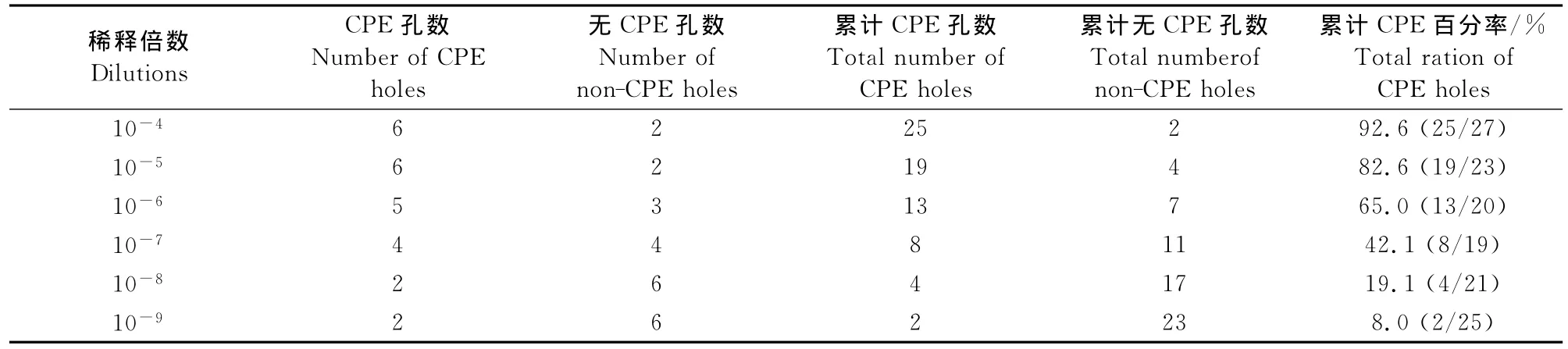
表1 第5代病毒TCID50的测定Table 1 TCID50determination of 5th generation virus

图4 B2L基因PCR产物电泳图Fig.4 Electrophoretic map of B2Lgene PCR products
3 讨论

图5 F1L基因PCR产物电泳图Fig.5 Electrophoretic map of F1Lgene PCR products
近年来,由于各地之间频繁引种及羊只交易,羊口疮在全国各地传播,给我国的养羊业造成了较为巨大的经济损失[10]。已有报道表明,不同羊口疮病毒分离株之间存在不同程度的基因差异[11]。为了获得大量的野毒株样本,本研究通过病毒分离、PCR检测和病毒滴度测定,获得了杨凌羊口疮病毒野毒株。何水林等[12]的研究表明,羊口疮病毒在犊牛睾丸原代细胞上连续传3代时,细胞病变(CPE)稳定出现在48h左右,詹述宣等[13]研究发现,羊口疮病毒在犊牛睾丸细胞上初代培养3d后即能见到明显的CPE。本研究所分离的羊口疮病毒在犊牛睾丸细胞上盲传至第5代才出现明显的CPE,其所表现的细胞变圆,折光性增强等细胞病变效应与其他研究者的结果是一致的。出现这样的结果可能与各分离株的强弱、接毒剂量和接毒方式存在一定的关系。
在测定病毒TCID50时,需要连续数日观察病变孔数,对病变孔的判定存在主观差异,需要多次测定最终确定病毒滴度。已有研究采用实时荧光定量PCR的方法测定病毒滴度,与传统方法相比较相关性较高,在后续的试验中可以采用此方法测定病毒滴度[14]。
B2L基因和F1L基因都编码羊口疮病毒表面囊膜蛋白,其中B2L基因的产物可刺激机体产生抗羊口疮病毒的抗体[15],F1L的产物能促使产生中和抗体[16]。两者均为羊口疮病毒的保守性基因,常被用作羊口疮病毒分子生物学诊断对象,因此本研究应用PCR技术检测羊口疮病毒的这两个基因能够保证检测结果的可靠性。B2L基因片段与设计引物的陕西株基因相似度为96.57%,而与福建株、广西株、四川株等的相似度为99%。F1L基因片段与设计引物的陕西株相似度为96.43%,与甘肃株、新疆株的相似性为99%[17]。这表明不同的羊口疮病毒的B2L和F1L基因高度保守,可分析其他毒力基因以深入研究各毒株的差异。

图6 B2L基因测序及比对结果Fig.6 The B2Lgene sequencing result and sequence alignment results

图7 F1L基因测序及比对结果Fig.7 The F1Lgene sequencing result and sequence alignment results
[1]Nandi S,De U K,Chowdhury S.Current status of contagious ecthyma or orf disease in goat and sheep-A global perspective[J].Small Ruminant Res,2011,96:73-82.
[2]范春玲,孙 斌,政 伟.羊传染性脓疱病的病理组织学观察[J].畜牧兽医科技信息,2007(8):32-33.
[3]李慧霞,朱学亮,骆学农.羊口疮病的研究进展[J].中国预防兽医学报,2013,35(5):426-430.
[4]颜新敏,张 强.羊口疮病毒的研究进展[J].中国动物检疫,2008,25(11):51-53.
[5]史宗勇,史新涛,古少鹏,等.羊传染性脓疱研究进展[J].养殖与饲料,2010(11):35-37.
[6]吴维忠.羊传染性脓疱[J].青海畜牧兽医杂志,1990(5):35-37.
[7]Bora D P,Barman N N,Das S K,et al.Identification and phylogenetic analysis of orf viruses isolated from outbreaks in goats of Assam,a northeastern state of India[J].Virus Gen,2012(45);98-104.
[8]田婷婷,李 杰,姚运亮,等.羊口疮病毒灭活疫苗的制备及免疫效果观察[J].动物医学进展,2013,34(6):17-20.
[9]李前瑞,李 杰,田婷婷,等.羊口疮病毒多重PCR检测方法的建立[J].动物医学进展,2013,34(6):36-38.
[10]张克山,何继军,尚佑军,等.羊传染性脓疱病毒湖北株的鉴定及分子特征分析[J].畜牧兽医学报,2010,41(9):1154-1157.
[11]苏高莉,赵 魁,孙秀萍,等.羊口疮病毒农安分离株的分离鉴定及Orf059(F1L)基因的序列分析[J].中国兽医学报,2013,33(1):4-8.
[12]何水林,陈 杰.羊口疮病毒的分离与鉴定[J].中国兽医科技,2002,32(9):22-23.
[13]詹述宣,薛双虎,薛掌林,等.犊牛睾丸细胞培养羊传染性脓疱皮炎病毒的研究[J].中国兽医科技,1983,13(7):5-7.
[14]Bora D P,Bhanuprakash V,Venkatesan G,et al.Quantitative polymerase chain reaction:another tool to evaluate viable virus content in live attenuated orf vaccine[J].Vet Italiana,2012(48):425-430.
[15]Schmidt C,Cargnelutti J F,Brum M,et al.Partial sequence analysis of B2Lgene of Brazilian orf viruses from sheep and goats[J].Vet Microbiol,2013(162):245-253.
[16]Su G,Zhao K,Sun X P,et al.Identification of an Orf virus isolated from sheep herd in Nongan district and sequence analysis of Orf059(F1L)gene[J].Chinese J Vet Sci,2013(1):3.
[17]张 瑜.羊口疮病毒杨凌与泸西野毒株的分离鉴定及毒力致弱研究[D].陕西杨凌:西北农林科技大学,2014.

