铜绿金龟子肠道链霉菌Streptomyces sp. BCa1菌体的抗菌成分研究
郭志凯 刘寿柏 马帅 王蓉


摘 要 为从昆虫来源的放线菌次级代谢产物中寻找药物先导分子,对铜绿金龟子幼虫肠道链霉菌Streptomyces sp. BCa1菌丝体化学成分进行了研究。通过活性跟踪,从其菌丝体的氯仿甲醇萃取物中分离得到主要成分1。利用高分辨质谱、一维和二维核磁波谱技术,将该主要成分1鉴定为具有双重旋转对称结构的不饱和大环内酯类抗生素阿扎霉素(elaiophylin),具有显著的抗金黄色葡萄球菌活性。该类化合物为首次从昆虫来源的放线菌中发现。
关键词 铜绿金龟子;链霉菌;菌体;阿扎霉素;抗菌活性
中图分类号 O629.9 文献标识码 A
Abstract In order to find drug leads from insect-associated actinomycetes,guided by antibacterial activity assay,a major bioactive constituent 1 was isolated from the organic solvent(chloroform and methanol mixture)extract of the mycelia of the cockchafer(Anomala corpulenta Motsch)-derived Streptomyces sp. BCa1. The compound was identified as elaiophylin(1), a symmetrical macrolide antibiotic with 16-membered unsaturated dilactone ring,on the basis of spectroscopic analyses including HR-ESI-MS,1D and 2D NMR experiments. Compound 1 showed significant antibacterial activity against Staphylococcus aureus. This kind of compound was firstly reported from an insect-derived Streptomyces.
Key words Anomala corpulenta Motsch; Streptomyces sp.; Mycelia; Elaiophylin; Antibacterial activity
doi 10.3969/j.issn.1000-2561.2015.07.020
与昆虫共生等特殊生境生活着次生代谢途径特殊的微生物[1-2],已成为药物先导化合物发现的重要来源。昆虫来源的放线菌和真菌能产生结构新颖的活性成分如抗真菌物质dentigerumycin[3]、mycangimycin[4-5]、sceliphrolactam[6]、resistomycin和tetracenomycin[7],以及骨架新颖的倍半萜类的抗细菌成分[8],昆虫共生菌正成为寻找结构独特、活性多样性天然药物分子的重要材料。作者曾从中华稻蝗肠道共生放线菌Amycolatopsis sp. HCa1的发酵液中发现了多个具有强抗肿瘤细胞活性的新型苯并蒽醌类化合物[9-10]并从其菌体中发现了具有免疫抑制活性的新型糖脂类化合物[11-12]。在持续筛选昆虫来源的微生物产活性成分研究中,从一株铜绿金龟子(Anomala corpulenta Motsch)幼虫肠道链霉菌Streptomyces sp. BCa1的发酵液中分离鉴定了Hsp90蛋白抑制剂格尔德霉素(geldanamycin)和萘醌型大环内酯类化合物hygrocin A及其类似物[13]。为充分挖掘铜绿金龟子肠道链霉菌Streptomyces sp. BCa1产结构新颖性活性分子的潜力,本研究对该菌菌体活性成分进行了分离,从其氯仿甲醇提取物中分离纯化得到化合物1,通过波谱解析以及与文献对照鉴定为具有双重旋转对称结构的不饱和大环内酯类抗生素阿扎霉素(elaiophylin)(图1)。该化合物对革兰氏阳性菌-金黄色葡萄球菌(Staphylococcus aureus)具有显著的体外抑制活性,但对革兰氏阴性菌-烟草青枯菌(Pseudomonas solanacearum)及白色念珠菌(Candida albicans)和尖孢镰刀菌(Fusarium oxysporum f. sp. cubense race 4)等真菌无抑制活性。该化合物为首次从昆虫来源的放线菌中发现。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂 由Agilent 6210 TOF LC-MS质谱仪(Agilent,美国)测定高分辨质谱(HR-ESI-MS)数据;化合物的一维和二维数据由布鲁克核磁共振波谱仪(Bruker DRX 500 MHz,德国)测定,以TMS为内标,化学位移以δ(ppm)表示;薄层层析硅胶(GF254)和层析柱硅胶(200~300目)均购自青岛海洋化工厂;Sephadex LH-20和ODS反相硅胶分别购自瑞典Pharmacia Biotech和日本京都Nacalai Tesque公司;分离实验中使用的试剂均为重蒸后的工业用试剂。
1.1.2 菌株 放线菌Streptomyces sp. BCa1菌株为先前作者从铜绿金龟子幼虫肠道中分离所得[13]。
1.2 方法
1.2.1 菌株的发酵 Streptomyces sp. BCa1菌株经高氏I号培养基平板(1.0 g/L KNO3,0.5 g/L MgSO4,
0.5 g/L K2HPO4,0.5 g/L NaCl,0.01 g/L FeSO4·7H2O,20 g/L可溶性淀粉,20 g/L 琼脂)活化,28 ℃培养 4 d,之后接种于液体高氏I号培养基中,于柜式摇床120 r/min,28 ℃ 培养3 d作为种子液。取30 mL种子液接种至装有400 mL液体麦芽培养基(20 g/L麦芽提取物,20 g/L蔗糖,1 g/L蛋白胨)的Erlenmeyer烧瓶(1 000 mL)中,共接种20瓶,于三层摇床上发酵12 d(120 r/min,28 ℃)。
1.2.2 化合物的分离和纯化 将发酵物过滤后得发酵液和菌体,菌体经等体积混合的氯仿-甲醇溶剂(3 L)于室温下浸提7 d,超声萃取3遍(3 L×3),合并萃取液后减压浓缩得黄色粗提物6.9 g。该粗提物经减压硅胶柱色谱,以CHCl3-MeOH梯度洗脱得7个流份(v/v 100 ∶ 0,100 ∶ 1,100 ∶ 2,100 ∶ 4,
100 ∶ 8,100 ∶ 16,0 ∶ 100),经抗金黄色葡萄球活性测试发现其中第5个流份(CHCl3-MeOH,100 ∶ 8)具有强烈的抑菌活性。该流份(242.6 mg)经ODS反相柱层析,以MeOH-H2O(v/v 40 ∶ 60,50 ∶ 50,60 ∶ 40,
70 ∶ 30,80 ∶ 20,100 ∶ 0)梯度洗脱得到6个流份,其中第3个流份(MeOH-H2O,60 ∶ 40)经Sephadex LH-20凝胶柱层析(甲醇为流动相)得到化合物1(24.5 mg)。
1.2.3 抗菌活性测试 体外测试抗菌活性所采用的方法与先前报道的文献一致[14]。供试菌株有金黄色葡萄球菌,烟草青枯菌,白色念珠菌和尖孢镰刀菌。
2 结果与分析
化合物1,正源高分辨电喷雾质谱显示其准分子离子峰为m/z 1047.5859[M+Na]+,推出其分子式为C54H88O18,不饱和度为11。化合物1的13C-NMR谱仅给出了27个碳信号峰,故判断该化合物存在对称结构。结合其1H-NMR和DEPT135谱可以看出该化合物的27个碳信号峰分别为2个季碳、6个甲基、3个亚甲基和16个次甲基(其中8个连氧次甲基)信号峰。其中,δC 167.1的季碳显示该分子中有酯羰基存在;δC 144.8,144.8,130.6和121.3的次甲基碳提示分子中的一半结构上含有2个双键;δC 99.2-64.9之间的碳提示该分子中含有糖环,且位于糖环上的δC 99.2和92.5的碳提示这2个碳上均可能连有2个氧;通过HMQC谱可判断该化合物中碳上所连接的质子情况。
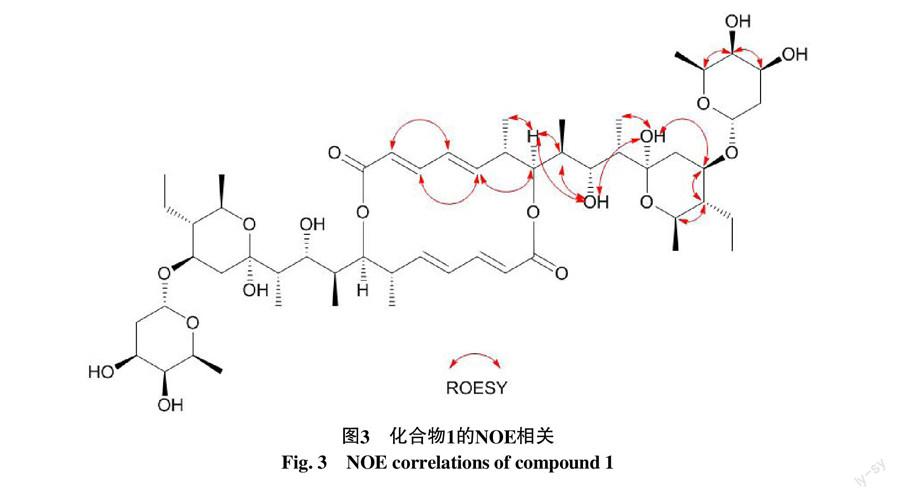
分析该化合物的1H-1H COSY谱(图2)相关信号可进一步推断并揭示该分子部分结构片段:H-3与H-2和H-4存在相关,H-5与H-4和H-6存在相关,H-6与H-7和H-17存在相关,H-13与H-12和H-14存在相关,H-15与H-14和H-16存在相关,H-20与H-14和H-21存在相关,H-23与H-24和H-22存在相关,H-25与H-24和H-26存在相关,H-26与H-27,以及H-8与H-18,H-10与H-19,H-9与OH-9,H-25与OH-25存在相关。进一步分析HMBC谱(图2)相关信号可揭示半个分子的结构:H-3与C-1,H-18与C-7和C-9,H-19与C-9和C-11,OH-11与C-10、C-11和C-12以及H-22与C-13和C-26存在相关。H-7与C-1的关键HMBC相关信号证实了该分子由两个上述推断出的半分子结构通过1位羧基与7位上的羟基成酯环合。上述结构片段连接整理即可得到化合物1的平面结构。该化合物的相对构型通过ROESY实验(图3)得到确定:H-2与H-4,H-5与H-3和H-7,H-7与H-17、H-8和OH-9,OH-11与OH-9、H-19和H-13,H-14与H-13和H-15均存在NOE相关,从而确定了化合物1的相对构型。
依据HMQC、HMBC 和1H-1H COSY实验结果,将该化合物的1H和13C-NMR数据归属如下:1H-NMR(DMSO-d6,500 MHz):δ 6.82(1H,dd,J =15.3,11.3 Hz,H-3),6.11(1H,dd,J=14.9,11.3 Hz,H-4),5.70(1H,d,J=15.3 Hz,H-2),5.65(1H,dd,J=14.9,10.1 Hz,H-5),5.42(s,11-OH),5.09(1H,d,J=10.4 Hz,H-7),4.91(1H,br s,H-22),4.51(d,J=5.9 Hz,24-OH),4.48(d,J=6.9 Hz,
9-OH),4.27(d,J=4.6 Hz,25-OH),3.79(1H,m,overlap,H-13),3.77(1H,m,overlap,H-26),3.75(1H,m,overlap,H-9),3.73(1H,m,overlap,H-15),3.72(1H,m,overlap,H-24),3.38(1H,m,overlap,H-25),2.48(1H,m,H-6),2.27(1H,brd,J=8.4 Hz,H-12a),0.95(1H,m,overlap,H-12b),1.82(1H,m,H-8),1.79(1H,m,H-23a),1.39(1H,m,H-23b),1.59(1H,m,H-20a),1.36(1H,m,H-20b),1.57(1H,m,H-10),1.08(3H,d,J=6.4 Hz,H-27),1.06(1H,m,overlap,H-14),1.05(3H,d,J=6.1 Hz,H-16),0.97(3H,d,J=6.4 Hz,H-17),0.86(3H,d,J=6.9 Hz,H-19),0.79(3H,d,overlap,J=6.8 Hz,H-18),0.79(3H,d,overlap,J=7.7 Hz,H-21);13C-NMR(DMSO-d6,125 MHz):δ 167.1 (s,C-1),144.8(d,C-3和C-5),130.6(d,C-4),121.3(d,C-2),99.2(s,C-11),92.5(d,C-22),75.8(d,C-7),70.3(d,C-25),69.4(d,C-9),68.4 (d,C-13),66.4(d,C-15),65.8(d,C-26),64.9(d,C-24),48.0(d,C-14),42.9(d,C-10),41.1(d,C-6),36.6(t,C-12),36.3(d,C-8),32.7(t,C-23),19.2(q,C-16),18.8(t,C-20),17.1(q,C-27),15.5(q,C-17),9.5(q,C-21),8.8(q,C-18),6.9 (q,C-19)。上述数据与文献谱学数据[15]比对一致,确定化合物1为阿扎霉素(elaiophylin)。该化合物属于大环内酯类抗生素,为具有双重旋转对称结构的不饱和十六元环内酯,其化学结构新颖,体外抗金黄色葡萄球菌活性实验发现,其在浓度为25 μg/mL时抑菌直径为17 mm,同样浓度的阳性对照(硫酸链霉素)抑菌直径为23.1 mm。
3 讨论与结论
当前广泛应用的抗生素约70%由各种放线菌所产生,而昆虫来源的放线菌则在天然抗生素分子发现中未经广泛研究。本研究中,前期对昆虫金龟子幼虫肠道放线菌Streptomyces sp. BCa1的菌体粗提物进行抗金黄色葡萄球菌活性发现,其具有显著的抗金黄色葡萄球菌活性,结果从该粗提物中分离鉴定了其主要活性成分为阿扎霉素B,它是一种具有双重旋转对称结构的不饱和大环内酯类抗生素,均由链霉菌产生[16]。此前对该金龟子幼虫肠道放线菌的发酵液成分分析发现其次生代谢产物与Streptomyces hygroscopicus的相同[13],而且Streptomyces hygroscopicus菌体中也发现有阿扎霉素B[15,17],进一步从化学本质上证实金龟子幼虫肠道放线菌Streptomyces sp. BCa1为Streptomyces hygroscopicus。阿扎霉素B具有独特的化学结构和特有的生物活性,已引起了生物学家和化学家的广泛兴趣。本研究中发现阿扎霉素B对革兰氏阳性菌-金黄色葡萄球菌具有显著的抗菌活性,但对革兰氏阴性的农业病原细菌烟草青枯菌,香蕉枯萎病原真菌尖孢镰刀菌4号生理小种以及人体病原真菌白色念珠菌等无抗菌活性。龚雨梅等[17]也发现阿扎霉素B具有显著的抗金黄色葡萄球菌活性,而且其结构类似物对耐甲氧西林金黄色葡萄球菌、万古霉素抗性肠球菌等革兰氏阳性致病菌具有显著的抑菌活性,但对革兰氏阴性菌和真菌无抑制活性[18]。此外阿扎霉素B还具有细胞毒活性[19]、海虾幼虫致死活性[20]。更令人感兴趣的是它还具有治疗家畜线虫感染的作用[16],但在农业线虫病害上还未见研究。在后续工作中,将对该放线菌及其自然或人工突变菌株的发酵产物进行杀热带作物病原线虫活性研究,希望筛选发现阿扎霉素B及其结构类似物具有杀农业病原线虫活性,进而利用该放线菌或其产物用于线虫病害防治。
参考文献
[1] Ashforth E J, Fu C Z, Liu X Y, et al. Bioprospecting for antituberculosis leads from microbial metabolites[J]. Nat Prod Rep, 2010, 27(11): 1 709-1 719.
[2] Schmidt E W. Trading molecules and tracking targets in symbiotic interactions[J]. Nat Chem Biol, 2008, 4(8): 466-473.
[3] Oh D C, Poulsen M, Currie C R, et al. Dentigerumycin: a bacterial mediator of an ant-fungus symbiosis[J]. Nat Chem Biol, 2009, 5(6): 391-393.
[4] Scott J J, Oh D C, Yuceer M C, et al. Bacterial protection of beetle-fungus mutualism[J]. Science, 2008, 322(5 898): 63.
[5] Oh D C, Scott J J, Currie C R, et al. Mycangimycin, a polyene peroxide from a mutualist Streptomyces sp.[J]. Org Lett, 2009, 11(3): 633-636.
[6] Oh D C, Poulsen M, Currie C R, et al. Sceliphrolactam, a polyene macrocyclic lactam from a wasp-associated Streptomyces sp.[J]. Org Lett, 2011, 13(4): 752-755.
[7] Zhang Y L, Li S, Jiang D H, et al. Antifungal activities of metabolites produced by a termite-associated Streptomyces canus BYB02[J]. J Agric Food Chem, 2013, 61: 1 521-1 524.
[8] Wu Q, Jiang N, Han W B, et al. Antibacterial epipolythiodioxopiperazine and unprecedented sesquiterpene from Pseudallescheria boydii, a beetle(Coleoptera)-associated fungus[J]. Org Biomol Chem, 2014, 12(46): 9 405-9 412.
[9] Guo Z K, Wang T, Guo Y, et al. Cytotoxic angucyclines from Amycolatopsis sp. HCa1, a rare actinobacteria derived from Oxya chinensis[J]. Planta Med, 2011, 77(18): 2 057-2 060.
[10] Guo Z K, Liu S B, Jiao R H, et al. Angucyclines from an insect-derived actinobacterium Amycolatopsis sp. HCa1 and their cytotoxic activity[J]. Bioorg Med Chem Lett, 2012, 22(24): 7 490-7 493.
[11] Guo Z K, Zhang G F, Jiao R H, et al. Actinotetraoses A-H: tetrasaccharide derivatives from a grasshopper-associated Amycolatopsis sp. HCa1[J]. Planta Med, 2012, 78(10): 988-994.
[12] Guo Z K, Jiao R H, Dai H F, et al. Actinotetraoses I-K: tetrasaccharide metabolites produced by an insect-derived actinobacteria, Amycolatopsis sp. HCa1[J]. Chem Biodivers, 2013, 10(2): 296-302.
[13] 郭志凯, 王 蓉, 刘寿柏. 铜绿金龟子肠道链霉菌Streptomyces sp. BCa1的次生代谢产物研究(英文)[J]. 热带作物学报, 2013, 34(8): 1 552-1 556.
[14] Wang R, Liu T M, Shen M H, et al. Spiculisporic acids B-D, three new γ-butenolide derivatives from a sea urchin-derived fungus Aspergillus sp. HDf2[J]. Molecules, 2012, 17: 13 175-13 182.
[15] 严淑玲, 黄为一, 王世梅. 吸水链霉菌NND-52菌株胞内抗生素M1分离、 纯化及结构确定[J]. 中国抗生素杂志, 2001, 26(3): 161-164.
[16] 严淑玲, 黄为一. 阿扎霉素B(Azalomycin B)研究进展[J]. 微生物学通报, 2002, 29(5): 103-107.
[17] 龚雨梅, 陈 军, 杨 涛, 等. 吸水链霉菌抗金黄色葡萄球菌代谢产物(英文)[J]. 应用与环境生物学报, 2010, 16(2): 261-263.
[18] Wu C Y, Tan Y, Gan M L, et al. Identification of elaiophylin derivatives from the marine-derived actinomycete Streptomyces sp. 7-145 using PCR-based screening[J]. J Nat Prod, 2013, 76(11): 2 153-2 157.
[19] Ritzau M, Heinze S, Fleck W F, et al. New macrodiolide antibiotics, 11-O-monomethyl- and 11, 11'-O-dimethylelaiophylins, from Streptomyces sp. HKI-0113 and HKI-0114[J]. J Nat Prod, 1998, 61(11): 1 337-1 339.
[20] 张 云, 周 潇, 宋永相, 等. 南海深海链霉菌Streptomyces albiflaviniger SCSIO ZJ28中elaiophylin的分离鉴定[J]. 天然产物研究与开发, 2013, 25: 185-189.

