不同白掌组合授粉结实和种子特性研究
刘金梅 刘小飞 于波 DENG Zhanao CHEN Jianjun 廖飞雄


摘 要 为了解白掌属植物杂交授粉和结实特性,建立杂交选育群体,对白掌属13个种或品种植物进行了组合授粉杂交试验,实施杂交组合24个,9个杂交组合和 S. floribundum开放自然授粉处理获得了果实和种子,培育了授粉后代群体;不同组合结果率为15.8%~100%,果实成熟需要50~108 d。各杂交组合每果实种子数为1~10.5个,种子具不同的大小、颜色和表面纹饰形态;不同组合的种子萌发率差异很大,从0.63%到84.67%,成苗率为0.63%~72.63%。结果表明,品种间容易杂交,而不同种间杂交结实率和正常发育种子率均较低。在泰勒×大花白掌和亮叶白掌×大花白掌两个组合中出现了黄化苗,比例分别为17.73%和16.1%。
关键词 天南星科;杂交;亲和性;种子
中图分类号 S682 文献标识码 A
Abstract In order to understand the characteristics of cross pollination, seed and seedling of spathiphyllum and to establish the hybrid population, 24 cross combinations among 13 spathiphyllum species or cultivars were tested in the experiment. Normal fruits and seeds were obtained successfully from 9 pollination combinations and of S. floribundum with open pollination. The seedling populations were developed from these seeds. The fruit setting rates of different hybrid combinations were 15.8~100% with 50~108 days from pollination to fruit ripening. The number of seeds in each berry fruit was 1 to 10.5 for successful hybridization combinations. The seeds from different combination showed special size, color and morphology with germination rate from 0.63% to 84.67%, and the normal seedling rate from 0.63% to 72.63%. These results showed that hybrid population could be obtained from the combinations between cultivars but difficult from the combinations between species due to low rate of fruit and normally developed seeds. 17.73% and 16.1% yellowish seedlings were found in the progeny population of two combinations ‘Tyler Green× SPA010 and‘Bright× SPA010.
Key words Araceae;Hybridization;Cross compatibility;Seed
doi 10.3969/j.issn.1000-2561.2015.07.005
白掌属(Spathiphyllum)植物为天南星科(Araceae)多年生草本,分布于热带美洲、西印度群岛和马来群岛,已报道有41个原生种[1]。白掌具有耐荫性强、生产周期短、适应性广和兼具观叶观花的特点,已成为生产和应用上最重要的观叶植物种类之一[2-3]。新品种的培育是推动产业快速发展的重要原因,20世纪70年代以前仅栽培少量品种,但至目前为止,已培育出的栽培品种有100多个,其中申请美国植物专利的白掌品种有60多个,这些品种仍然主要通过杂交、体细胞变异筛选等传统育种手段培育而来[4-5],多倍体诱导也有一些研究[6-8],并培育出了植株大、生长势强的三倍体品种‘Sensation(绿巨人)。培育的目标性状主要集中在观赏性状如株型紧凑、叶色深绿、叶片光泽度、佛焰苞大小、色泽与数量等。由于在生产中白掌根茎腐病(Cylindrocladium spathiphylli)发生严重,并有品种、种的抗性差异,因此筛选和培育抗病性白掌育种的重要方向之一[9-10],而且为引入不同种间抗性种质,探索通过体细胞杂交来解决远缘杂交困难的问题[11-13]。尽管已培育出了一些品种,但对白掌属植物育种相关的生物学的研究报道不多,多数的研究集中组织培养与微繁殖方面,对其生殖生物学特性、杂交特性、遗传背景等知之甚少,其基因组大小、染色体数目、核型等仅有有限的报道[14-17]。在杂交相关研究方面,试验发现不同白掌品种对用赤霉素处理调节花期敏感性有较大差异[18-19]。近年来随着育种研究的增多,开始有一些研究报道,如观察了不同白掌的花序形态变化和开花特性,发现种间有较大的差异,但品种间较相似[20]。花粉活力的测定发现品种间鲜花粉的活力差异较大[21]。在不同的光照和温度条件下,采用不同的介质和播种方式,白掌种子萌发率存在差异[22]。为了掌握白掌属植物种间、种内不同品种间杂交特性、结实情况和种子生活力等,本研究通过种内品种间、不同种间进行组合和正反交,研究了授粉后的发育响应、结实和种子萌发等特点,可供杂交育种的亲本选配、杂交亲和性提高、杂交群体构建提供参考,提高育种效率。
1 材料与方法
1.1 试验材料
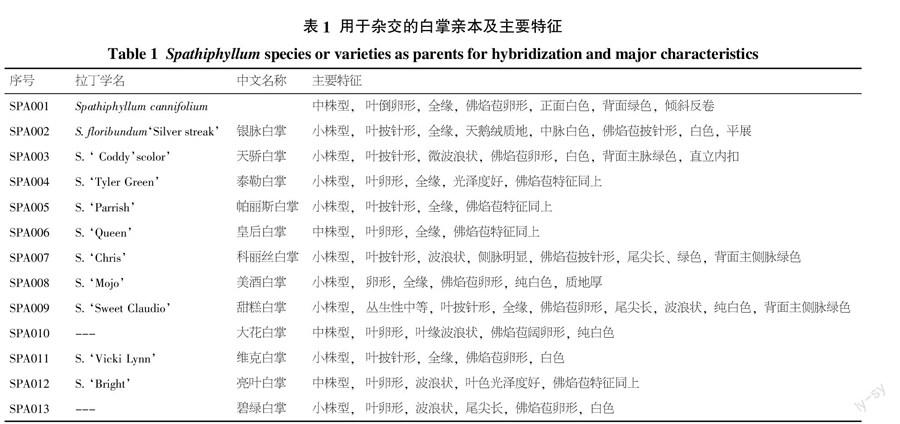
试验材料取自于广东省名优花卉种质资源圃,用于杂交的品种(种)及主要性状见表1。
1.2 试验方法
1.2.1 杂交组合的选配 共13个品种、种作为亲本材料进行杂交,杂交组合情况见表2,组合的选配结合了育种目标的需要。其中选择了4个栽培品种与S. floribundum‘Silver streak、一个栽培品种与S. cannifolium进行了正反交试验,共有10个组合;6个组合是授S. floribundum‘Silver streak的花粉、3个组合是用S. cannifolium作父本,3个组合选用大苞片品种大花白掌作父本,1个组合用S. floribundum‘Silver streak作母本未作正反交,还进行了S. floribundum‘Silver streak开放授粉结实试验。
1.2.2 人工授粉 杂交于4~7月间白掌自然开花盛花期进行。在大棚中选择生长健壮、性状表现正常的盆栽植株作为杂交亲本,用75%酒精处理后的毛笔笔头粘取父本新鲜花粉,涂抹于母本柱头上,由上往下反复几次,授粉后套袋。
1.2.3 授粉响应观察与结果数统计 授粉后,每隔7 d观察花序的形态变化、子房形态变化和果实发生长发育情况等。果序变黄为果实成熟标志,果熟时间为授粉至果序变黄所需的天数;统计果实数和种子数,子房内含有形态正常、饱满的种子为正常结果小花,结果率(%)=结果的小花数(个)/花序小花总数×100;每果种子数=每果序种子总数(个)/结果小花数。
1.2.4 种子萌发和杂交后代群体的形成 从浆果中剥离出来的种子,经过清水清洗,晾干后播种,基质采用泥炭土和珍珠岩3∶1,覆土厚度1 cm左右,播种30 d后,统计萌发率;种子萌发长出1片初生叶为正常萌发的种子,萌发率/%=正常萌发的种子数(粒)/供试种子数(粒)×100;播种100天后统计成苗率,长成4~5片叶片的植株为成苗,成苗率/%=成苗数(株)/供试种子数(粒)×100;整个植株呈黄色的为黄化植株,黄化苗率/%=黄化苗数/总苗数×100,黄化苗成活率/%=成活黄化苗数/黄化苗总数×100。
2 结果与分析
2.1 授粉后的响应与杂交结果
授粉前肉穗花序雌蕊呈淡黄色(图1-A),白掌肉质花序在授粉后,会发生明显的响应,表现在花序和苞片形态上的变化。授粉约1周后,花序上小花闭合,花药脱落。苞片色泽发生变化,由白色逐渐转化绿色,随后,肉质花序也出现色泽的变化,多数由淡黄开始变绿(图1-B)。部分杂交组合授粉后,会产生授粉响应,但后续子房不能正常膨大、座果,持续一段时间后也凋谢。成功授粉并受精的小果10 d左右位于基部的小果开始出现膨大,逐渐向上,直到成熟变黄(图1-C)。未授粉成功的花序,子房不出现膨大,肉穗花序变黄,苞片变黄,后整个花序萎蔫凋谢(图1-D)。银脉白掌有特殊的响应方式,花梗出现离合,花序脱落。
在所做的24个组合的杂交中,有15个产生了授粉响应,其中10个组合获得正常发育成熟的杂交种子,有5个组合有授粉响应但没有获得正常发育的果实,9个组合没有观察到授粉的响应和形态的变化,也没有成功获得杂交种子。自然开放授粉处理的银脉白掌获得了正常发育成熟的种子,但以其为母本的组合均没产生正常的种子,作父本的9个组合中5个获得成功。而S.cannifolium作母本的1个组合获得成功,作父本未能获得正常发育的种子(表2)。
2.2 不同杂交组合的果实形态变化和结果率
不同母本品种的浆果大小、形态有差异。小果聚合或离合,大多供试亲本果实形态特征相似,但母本不同小果大小、形态表现有很大不同(图2-A、B、C、D)。果实基部聚生于肉质果序中,不易分离和脱落。但S.cannifolium成熟果实突起不显著、连合在一起(图2-F),而银脉白掌的果实为白色,成熟的果实容易从果序中脱落(图2-E)。种子发育成熟后,撑破果皮,使果实果皮上部脱落但种子宿存(图1-C)。供试杂交组合的果熟时间为50~108 d,熟期主要由母本所决定,泰勒果熟时间最长,以大花白掌、银脉白掌授粉果期分别达到为108和104 d,而S.cannifolium的果熟时间最短为50 d(表2)。
不同杂交组合的结果情况不同,一些组合授粉花序全部正常结果,结果率达到100%。尽管在开放授粉条件下银脉白掌结果率33%,作父本时,不同组合结果率有较大差异,与亮叶白掌和美酒白掌杂交的结果率均达到了82%以上,但与泰勒、皇后组合时结果率就较低(表2)。
2.3 不同杂交组合种子的形态与萌发
不同杂交组合果实里产生的种子数有较大差异,10个杂交组合中单果种子数为1~11粒,父本对种子的产生影响显著,同一母本,授以不同父本的花粉所产生的种子数差异明显,如泰勒白掌授以大花白掌和银脉白掌的花粉,平均每果种子数分别为8.5和2。而不同母本、相同父本情况下产生的种子数大致相同。
不同亲本白掌种子形态有变化,种子为卵形、肾形或不规则形,呈淡黄色或褐色,萌发孔均在顶端(表3、图3)。
2.4 不同杂交组合种子的萌发和杂交后代群体构建
授粉成功的10个杂交组合,其种子萌发率差异显著,最高达到84.67%,最低为0.63%。母本不同、父本相同,或者母本相同、父本不同时所产生的种子萌发均有不同。不同父本对种子的萌发率也有较明显的影响,如同为泰勒作母本,但授与大花白掌和银脉白掌所产种子萌发率相差甚大。所萌发的种子也不能完全生长成正常的小苗,不同杂交组合成苗率差异显著,最高为帕丽斯×大花组合的72.67%,最低为泰勒×银脉组合的0.63%(表4)。
在泰勒、亮叶两个品种与大花的杂交后代中出现了黄化苗的现象,比例分别为17.73%和16.1%,黄化苗的叶片淡黄色,多为线形,生长势弱,生长缓慢,多数在一段时间后,出现萎蔫枯死;极少部分黄花苗叶片可逐渐转变成绿色,缓慢长成正常植株。
3 讨论与结论
授粉后座果和结实情况直接反映出杂交组合间的亲和性和杂交的难易。在所试验的杂交组合中3个栽培品种间组合杂交座果率和种子萌发率均较高,甚至花序上100%的小花可正常授粉受精,表明具有很好的杂交亲和性,这些栽培品种开花性状特性相近[20],可能具有相同或相近的来源,分子标记分析结果也表明亲缘性较近[23-24]。有文献提及白掌属植物种间杂交较困难,而探索通过体细胞杂交来解决[11],S.cannifolium和银脉白掌在形态、开花特性与现行栽培的品种有较大差异,是同属不同种的植物,杂交试验的结果表明座果率低或不能座果,许多种子不能正常发育和萌发,表明比较难成功进行授粉和受精,但正反交间有差异,银脉在自然授粉情况下可有33.85%的结果率,但用银脉所做的正反交试验中,银脉用作父本时能获得一定的结果和种子,作母本时没有获得到成功杂交,当然这与杂交亲和性有关外,可能与银脉花序易霉烂不能正常发育结果有关,Henny试验显示控制温湿度可提高白掌的结实[5],可以在控制条件下进行试验研究给予证明。而用S.cannifolium除与泰勒组合获得成功外,其它组合未能获得成功的杂交,与其花期和其它供试品种不同可能有较大的关系[20],需要对其花期调控、花粉生活力影响等作进一步的研究。
杂交种子萌发率和成苗率反映所获种子的活力和杂交育性,对于构建杂交后代选择群体有指导意义。从结果看品种间杂交种子萌发率较高,大多能正常生长成苗,而种间杂交的种子萌发率很低,并有相当种子萌发后由于生长势较弱而不能生长成正常的苗,这提示在白掌的种间以上杂交中需要扩大杂交的花序和花朵数,以保证能获得足够的种子和种苗数量以筛选杂合优良后代。
在试验的杂交组合中,有二个组合的后代苗中出现了黄化苗现象,这些苗因较弱不能长大,部分则恢复正常绿色苗而生长,这一现象未见有研究报道,是否具有普遍现象和意义值得在杂交中加以注意。
参考文献
[1] Mayo S J, Bogner J, Boyce P C. The genera of Araceae[M]. Royal Botanic Gardens Kew, UK. 1997: 110.
[2] Chen J J, McConnell D B, Henny R J, et al. The foliage plant industry[J]. Horticultural Reviews, 2005, 31: 45-110.
[3] 廖飞雄, 柯宣东, 于 波, 等. 观叶植物白掌产业化生产现状与发展对策[J]. 广东园艺, 2011, 12(4): 16-18.
[4] Henny R J, Chen J J. Cultivar development of ornamental foliage plants[J]. Plant breeding reviews, 2003, 23: 245-290.
[5] Henny R J, Norman D J, Chen J. Progress in Ornamental Aroid Breeding Research[J]. Missouri Botanical Garden Annual Report, 2004, 91(3): 464-472.
[6] Eeckhaut T G, Werbrouck S P, Leus L W, et al. Chemically induced polyploidization in Spathiphyllum wallisii Regel through somatic embryogenesis[J]. Plant Cell, Tissue and Organ Culture. 2004, 78(3): 241-246.
[7] Ives V, Tom E, Johan V H, et al. Histogenic analysis of chemically induced mixoploids in Spathiphyllum wallisii[J]. Appl Environ Microbiol, 2006, 72(5): 3 343-3 349.
[8] Ogasawara R, Ochiai M, Nishikawa K, et al. Induction of polyploidy by in vitro colchicine treatment of apical meristem of Spathiphyllum wallisii Regel‘New merry[J]. Horticultural Research(Japan), 2014, 13(3): 213-219.
[9] Henny R J, Chase A R. Screening Spathiphyllum species and cultivars for resistance to Cylindrocladium spathiphylli[J].Hortsciences, 1986, 21: 515-516.
[10] Norman D J, Henny R J, Yuen J M F. Resistance in twenty-two cultivars of Spathiphyllum to Cylindrocladium root rot[J]. Hort Technology, 1999, 9(1): 68-69.
[11] Duquenne B, Eeckhaut T, Werbrouck S, et al. Effect of enzyme concentrations on protoplast isolation and protoplast culture of Spathiphyllum and Anthurium[J]. Plant Cell Tissue and Organ Culture, 2007, 91(2): 165-173.
[12] Eeckhaut T, Duquenne B, Laksmanan P, et al. Development of microcolonies in protoplast culture of Spathiphyllum wallisii[J]. Acta Horticulturae, 2009, 829: 51-54.
[13] Liao F X, Chen J J, Henny R J. A High Efficient Regeneration System in vitro Protoplast Isolation and Culture of Spathiphyllum[A]. Program and Abstracts of International Conference on Germplasm Ornamentals, Beijing, 2012: 101.
[14] Bharathan G, Lambert G, Galbraith D. Nuclear DNA content of monocotyledons and related taxa[J]. Am J Bot, 1994, 81: 381-386.
[15] Bogner J. A new dwarf Spathiphyllum species(Araceae)from Ecuador[J]. Willdenowia, 2011, 41: 125-127.
[16] 刘金梅, 刘小飞, 刘晓荣, 等. 白鹤芋属植物的染色体新观察[A]. 中国观赏园艺研究进展[C]. 北京: 中国林业出版社, 2013: 124-128.
[17] Ke ChienYing, Chin ShihWen, Chen FureChyi. Karyotype analysis of Spathiphyllum[J]. Journal of the Chinese Society for Horticultural Science, 2002, 48(4): 347-356.
[18] Henny R J, Mellich T A, Norman D J. Spathiphyllum Cultivars Vary in Flowering Response after Treatment with Gibberellic Acid[J]. Hort Technology, 1999, 9(2): 177-178.
[19] 詹启成, 蒋雄辉, 王 奎, 等. 不同浓度赤霉素对甜芝白掌催花效果的影响[J]. 北方园艺, 2013(08): 83-84.
[20] 戴桦均, 徐维杰, 廖飞雄. 不同白鹤芋种品种开花特性和形态的观察[A]. 中国观赏园艺研究进展[C]. 北京: 中国林业出版社, 2012: 139-144.
[21] 周英彪, 彭卓伦, 蒋雄辉, 等. 白掌花粉活力检测及其超低温保存研究[J]. 中国农学通报, 2013, 29(01): 113-117.
[22] 詹启成, 王 奎, 蒋雄辉, 等. 白鹤芋种子萌芽特性研究[J]. 北方园艺, 2012(01): 106-107.
[23] Ke ChienYing, Yang YauWen, Chen FureChyi. Using RAPD (random amplified polymorphic DNA)markers to evaluate genetic variation of Spathiphyllum cultivars[J]. Journal of the Chinese Society for Horticultural Science, 2003, 49(1):45-53.
[24] Chen J J,Henny R J, Devanand, et al. Genetic relationships of Spathiphyllum cultivars analyzed by AFLP markers[J]. Hortscience, 2006, 4(4): 968.

