低温弱光对西瓜幼苗光合作用和抗氧化酶活性的影响
侯伟 孙爱花 杨福孙 周兆德 陈汇林 吴翠玲


摘 要 以西瓜品种“早佳8424”为试材,研究低温[12 ℃/10 ℃, 300 μmol/(m2·s)],以及低温弱光[12 ℃/10 ℃, 100 μmol/(m2·s)]胁迫对西瓜幼苗叶片光合作用、叶绿素荧光参数及抗氧化酶活性的影响。结果结果表明:低温、低温弱光胁迫均降低了西瓜幼苗叶片净光合速率(Pn)、气孔导度(Gs)和PSⅡ的最大光化学量子产量(Fv/Fm),增加了胞间CO2浓度(Ci)。低温、低温弱光致使超氧化物歧化酶(SOD)和过氧化物酶(POD)活性先增加后降低,过氧化氢酶(CAT)活性则持续下降,丙二醛(MDA)含量持续增加。与低温相比,低温弱光处理下的西瓜幼苗Pn、Gs下降幅度更大,Ci的增幅更明显;与此不同,Fv/Fm和CAT活性在低温弱光处理后下降幅度相对较小,SOD、POD活性和MDA含量也呈现出较小增幅。低温、低温弱光胁迫抑制了西瓜幼苗的光合作用并诱导了抗氧化酶活性增强以清除体内氧自由基。随着胁迫时间的延长,抗氧化酶合成受到抑制,过剩的活性氧自由基造成细胞膜脂过氧化伤害,并最终破坏细胞膜系统。低温下的弱光能减轻幼苗的光抑制作用,同时也能缓解细胞产生的过氧化损伤,对降低细胞膜系统伤害有明显作用。
关键词 低温弱光;光合作用;抗氧化酶;西瓜幼苗
中图分类号 S651 文献标识码 A
Abstract The effects of low temperature[12 ℃/10 ℃, 300 μmol/(m2·s)], low temperature combined with low light [12 ℃/10 ℃, 100 μmol/(m2·s)]on photosynthesis, chlorophyll fluorescence and antioxidant enzymes activities were studied in watermelon(Citrullus lanatus)cultivar‘ZaoJia8424. The results showed that low temperature and low temperature combined with low light significantly decreased the net photosynthesis rate(Pn), stomatal conductance(Gs)and the maximal efficiency of PSⅡphotochemistry(Fv/Fm), but increased intercellular carbon dioxide concentration(Ci). Moreover, the activities of SOD and POD firstly increased and then decreased. CAT activity reduced, whereas, MDA contents increased in the two kinds of stresses. Compared with low temperature stress, Pn and Gs showed a greater decrease but a more pronounced increase happened in Ci under low temperature combined with low light. However, there had a relatively small decline in Fv/Fm and CAT activity, and SOD, POD activities and MDA content showed lesser increase. Low temperature and low light inhibited photosynthesis, and antioxidant enzyme activities was induced to enhance the ability in scavenging oxygen free radicals. And then, antioxidant enzyme synthesis was inhibited, excess oxygen free radical caused lipid peroxidation of cellular membranes, and eventually destroyed the cell membrane system. In addition, low light under low temperature not only reduced photoinhibition and alleviated the oxidative damage, but also had a significant effect on reducing the damage of cell membrane system.
Key words Low temperature and low light; Photosynthesis; Antioxidant enzyme; Watermelon seedlings
doi 10.3969/j.issn.1000-2561.2015.07.008
低温与弱光是越冬作物经常遇到的非生物胁迫,其对作物的生长发育和生产力都有不利影响,同时会促发作物体内一系列形态与生理生化方面的变化[1],包括改变植物生长形态,激发或抑制植物光合作用,升高或降低抗氧化酶活性以及分解细胞膜成分等。起源于热带或亚热带地区作物(如黄瓜、西瓜、芒果等)对低温极其敏感,在冬季生长期容易遭受0~12 ℃的低温冷害影响,较长时间阴雨天气所形成的弱光对栽培作物的光合生理影响更大,造成农作物大幅减产[2]。
光合作用是植物利用光能,将二氧化碳(CO2)转化为碳水化合物进行贮能,并释放出氧气的过程,包括原初反应、电子传递、光合磷酸化及碳同化过程[3]。低温胁迫会直接影响到类囊体电子传递链、碳同化以及气孔导度等光合生理过程,会致使植物的光合机构吸收过多光能,而过剩的光能则会打破光系统Ⅱ(PSⅡ)中固有的光合损伤与光合修复的平衡,进而引发光能转化效率的下降并最终造成光抑制,而这种光抑制作用会在有强光照的条件下得到进一步的加剧[4-5]。相比于较强光照,低温下的弱光在一定程度上减弱了光合作用及相关酶活性的降低,保护了光合系统的稳定,维系了作物的正常光合能力[6],弱光在一定程度上会减轻低温对作物所造成的伤害。
低温胁迫下,植物体内会产生大量高活性和毒性的活性氧(ROS),可直接造成细胞的伤害[7],并能引发植物抗氧化酶系和光合代谢等方面的改变[8]。ROS的积累会在短期内诱发植物抗氧化酶活性的增强,以消除过多有害氧自由基,避免植物受到过氧化伤害,过多的ROS也会抑制抗氧化酶的合成,而不断增多的有害氧自由基会加剧植物细胞膜脂过氧化并最终损害细胞膜系统[9]。植物体内抗氧化酶主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等,当然也存在一些小分子的非酶抗氧化剂(如维生素C、维生素E,谷胱甘肽等)[10]。现有研究结果表明,植物在适应低温弱光过程中会诱发抗坏血酸过氧化物酶(APX),POD,谷胱甘肽还原酶(GR),SOD活性的显著提高[11],这是植物在长期进化过程中对低温弱光胁迫环境耐性增强的结果[12]。
西瓜原产于非洲,是全球重要的经济作物和夏季消暑水果。目前,国内对低温弱光胁迫下作物抗氧化酶、光合生理等方面研究较多,但主要集中在对辣椒、黄瓜、番茄等方面的探讨[13-15],而有关西瓜幼苗在低温弱光胁迫下的报道则集中在对耐寒性指标的筛选方面,且较少有涉及到与抗氧化酶活性和光合作用相关的内容[16-18]。国外学者对作物在低温与光胁迫方面的研究重点是低温结合强光照或低温与长期光照的互作方面,而针对作物低温弱光胁迫下的生理生化变化规律研究则少见。本试验的宗旨是:(1)探讨低温和低温弱光胁迫下西瓜幼苗抗氧化酶活性和光合生理的变化过程;(2)揭示西瓜幼苗在不同低温弱光胁迫下的敏感性及响应机制。为更深入了解西瓜幼苗的相关生理生态特征、指导西瓜在冬季反季节的合理栽培提供理论依据。
1 材料与方法
1.1 试验材料与处理
试验于2014年1-2月在中国热带农业科学院冬季瓜菜示范基地进行,以海南大棚主栽西瓜(Citrullus lanatus)品种“早佳8424”(种子由品种资源研究所提供)为试验材料。取饱满种子用70%的酒精消毒处理5 min,再经温水浸种8 h后放置于培养箱在25 ℃黑暗条件下进行催芽,待胚芽伸长至0.5 cm左右播种于10 cm×10 cm的塑料营养钵中。正常光温管理,平均温度为25 ℃/18 ℃,光照强度为300 μmol/(m2·s),保持相对空气湿度在65%~75%。待幼苗长至3叶1心时挑选生长健壮且长势一致的幼苗转移至人工气候箱中进行低温弱光处理。
试验设置3个处理。处理Ⅰ(对照):温度为25 ℃/18 ℃,光强为300 μmol/(m2·s);处理Ⅱ(低温):温度为12 ℃/10 ℃,光强为300 μmol/(m2·s);处理Ⅲ(低温弱光):温度为12 ℃/10 ℃,光强为100 μmol/(m2·s)。光周期均为10 h,保持相对空气湿度在70%左右,处理组和对照组除开光温条件不同外,其他环境条件均保持一致。分别取处理后0、3、6、9 d的第2、3展开叶测定抗氧化酶活性及丙二醛(MDA)含量,每处理5株,重复3次。另于处理0、3、6、9 d同步测定西瓜幼苗第2片展开叶的净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)和叶绿素荧光参数(Fv/Fm),进行3次重复。
1.2 测定项目与方法
1.2.1 酶液提取 首先配制50 mmol/L的磷酸钾缓冲液(pH7.8)用于提取植物叶片中的酶。取1.0 g除去主脉的叶片冰浴研磨后溶于10 mL缓冲液,并将均浆液于4 ℃,12 000 ×g下离心30 min,上清液用于酶活性测定及丙二醛(MDA)含量的测定。
1.2.2 SOD活性测定 SOD酶活性依据以抑制氮蓝四唑(NBT)的光化学还原作用来测定[19]。配制3 mL的反应液(包含13 mmol/L蛋氨酸,75 μmol/L氮蓝四唑,10 μmol/L EDTA,2 μmol/L核黄素-最后添加)。准备5支试管,2支不加酶液作对照(以缓冲液代替酶液),另3支各加入0.1 mL酶液反应。任选1支对照管置于暗处,其余均放置于4 000 lx的光照下反应15 min。随后将各反应液置于560 nm波长处测定吸光值,以每分钟每克组织抑制的50%氮蓝四唑光化还原力为一个酶单位。
1.2.3 POD活性测定 POD酶活性参考愈创木酚法进行测定[20]。首先配置3 mL的反应混合液(包括25 mmol/L的磷酸缓冲液(pH7.0),1%的愈创木酚,10 mmol/L的H2O2)。然后将混合液充分摇匀并加热使之溶解。准备2支试管,其中一支加入0.3 mL的磷酸二氢钾为空白对照,另一支则加入0.3 mL酶液并于470 nm波长下每分钟测定一个数值。以每分钟每克组织的吸光度值增加数为一个酶单位。
1.2.4 CAT活性测定 CAT酶活性测定是基于CAT对H2O2的消除作用以致在单位时间内在240 nm波长下吸光度的降低值[20]。反应体系由25 mmol/L磷酸缓冲液(pH7.0),0.4% H2O2及0.1 mL酶液组成,在240 nm波长下每半分钟记录1次数据。以每分钟每克组织吸光值的降低数为一个酶单位。
1.2.5 MDA含量测定 MDA含量测定采用硫代巴比妥酸比色法[21]。取上清液2 mL,加入2 mL的0.67%的TBA中。混合液煮沸15 min后冷却,并置于5 000 ×g离心机离心10 min。吸取上清液在450、532 nm和600 nm波长处测定吸光度,单位是每克组织中所含有的MDA含量。
1.2.6 光合生理参数测定 采用Li-6400型便携式光合作用测定仪(美国LI-COR公司),于早上9 : 00~11 : 00期间测定西瓜幼苗第2片完全展开叶的净光合速率(Pn)、胞间CO2浓度(Ci)和气孔导度(Gs),测定时使用开放气路,设定内置光量子通量密度为800 μmol/(m2·s),叶室温度为25 ℃,大气中CO2浓度变化范围为(388±15)μmol/(m2·s)。采用PAM-2500便携式脉冲调制叶绿素荧光仪(德国Walz公司)测定叶绿素荧光诱导动力学参数,包括暗适应30 min后的初始荧光(Fo)、最大荧光(Fm)、PSⅡ的原初光能转化效率(Fv/Fm)等。
1.3 数据处理
采用SAS 9.1软件进行ANOVA方差分析并用Duncan新复极差法对平均数进行多重比较。用Excel 2007进行数据计算和作图。
2 结果与分析
2.1 低温弱光胁迫下幼苗叶片光合作用参数变化
相比于对照,低温、低温弱光均降低了西瓜幼苗叶片的Pn值,且随着逆境胁迫时间的延长,Pn持续降低并有趋于稳定的趋势,低温弱光处理下的Pn相比低温处理下降幅度更大。在处理3、6、9 d时,低温下Pn相对处理前降幅分别为37.8%、55.7%、64.1%;而低温弱光下的Pn降幅为61.0%、75.6%、79.3%(图1)。这表明在有低温胁迫存在条件下,弱光在很大程度上抑制了幼苗的光合作用。正常光温条件下Gs呈现折线变化,且有上升趋势。低温、低温弱光胁迫均导致了Gs的下降,且下降幅度较为一致,在处理9 d后,低温、低温弱光胁迫下Gs相对处理前分别下降了58.3%和67.9%,Gs与Pn有相似的变化趋势。同Pn和Gs变化趋势相反,低温、低温弱光均增加了西瓜幼苗叶片Ci,且随着胁迫时间的延长,Ci 持续升高。低温弱光处理下的Ci 增幅大于单一的低温处理,且在处理后9 d表现出显著差异(p<0.05)。
2.2 低温弱光胁迫下幼苗叶片Fv/Fm的变化
低温、低温弱光胁迫下西瓜幼苗叶片PSⅡ的最大光化学效率(Fv/Fm)均表现出下降,且随着胁迫时间的延长,Fv/Fm呈现持续下降趋势(图2)。Fv/Fm在低温处理3、6、9 d时比处理前分别下降了4.1%、9.2%、11.5%;而低温弱光处理3、6、9 d后降幅为2.6%、6.8%、8.1%。低温处理下Fv/Fm的下降幅度显著大于低温弱光处理,这表明低温弱光下西瓜幼苗叶片相比单一低温胁迫具有较高的PSⅡ光化学效率。
2.3 低温弱光胁迫下幼苗抗氧化酶活性与膜脂过氧化作用的影响
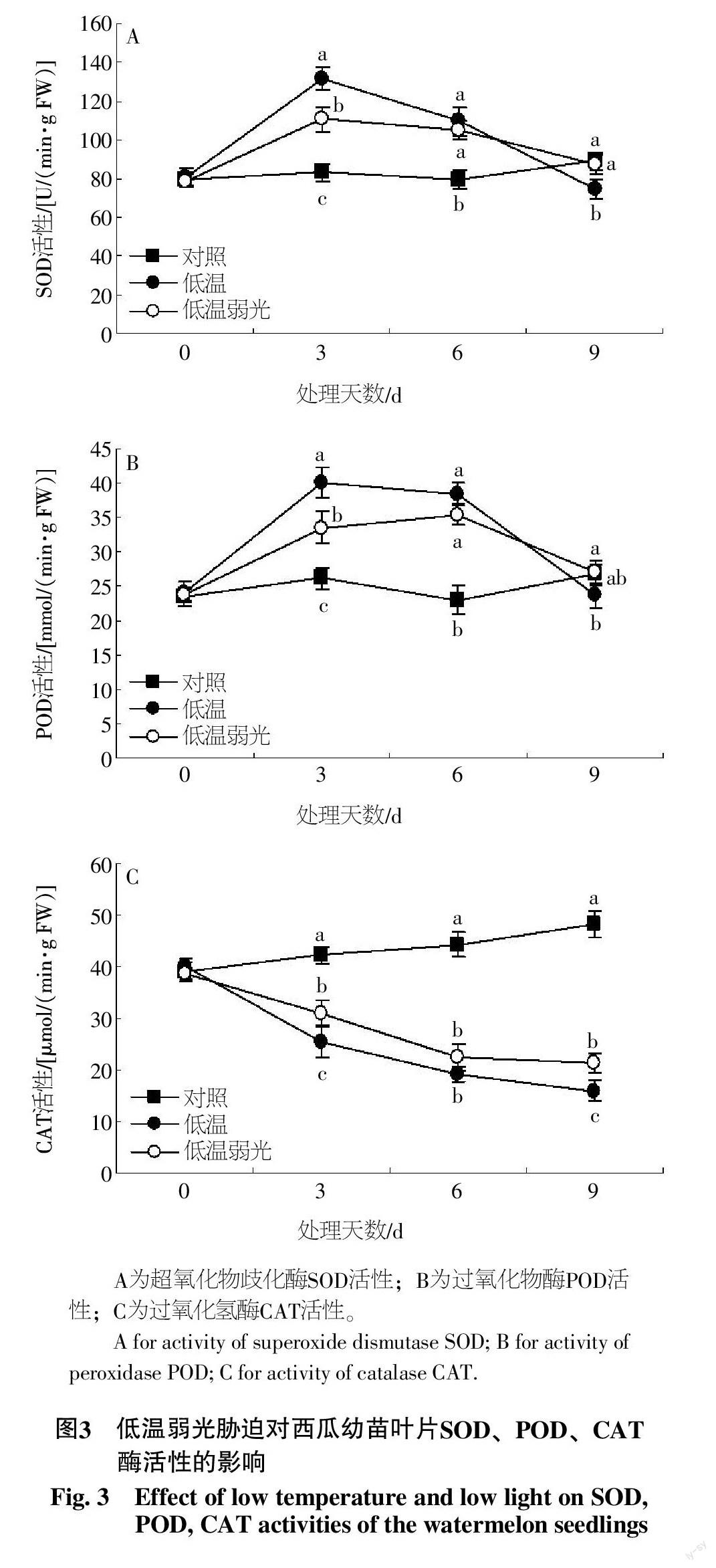
低温、低温弱光胁迫处理前期都导致了幼苗叶片SOD活性的显著增加,但随着胁迫时间的延长,低温处理3 d后SOD活性开始下降,且降幅逐渐增大,而低温弱光胁迫下,叶片SOD活性在处理6 d后才出现明显下降。低温和低温弱光在处理3 d时SOD活性分别相比处理前增加了63.1%和40.3%;在处理9 d时低温弱光下SOD活性降至处理前水平,而低温下的SOD活性则降至比处理前更低的水平,这表明在前期胁迫中,低温处理幼苗的SOD活性增幅比低温弱光处理更为显著,而在随后的胁迫中,低温弱光处理幼苗叶片SOD活性也要显著高于低温处理。POD活性与SOD活性具有相似的变化趋势,低温、低温弱光处理前期均导致了叶片POD活性的增强,在胁迫3 d时相比处理前分别增加了66.9%和41.1%,而在处理9 d后POD活性均回到了处理前水平(图3)。与POD、SOD变化相反,低温和低温弱光直接造成了叶片CAT活性的显著下降,在处理9 d时,低温、低温弱光下CAT活性相比处理前分别下降了60.1%和44.5%,表明CAT对低温和低温弱光胁迫影响具有高度的敏感性。
西瓜幼苗在正常光温条件下生长MDA含量始终保持在稳定水平,而低温、低温弱光胁迫均导致了叶片组织中MDA含量的持续增加,且随着处理时间延长,MDA积累增加。低温处理3、6、9 d时MDA增幅为141.0%、210.7%、245.0%;而低温弱光处理后3、6、9 d的MDA增幅则分别为118.5%、195.3%、213.1%(图4)。低温处理幼苗的MDA含量增加比低温弱光处理显著,表明低温胁迫造成了细胞更大的膜脂过氧化作用。
3 讨论与结论
光合作用是生物的能量来源,提高光合作用是作物增产的一种重要策略[22]。低温弱光胁迫几乎能破坏所有光合作用组分,其对由众多复杂酶促反应构成的碳同化过程及气孔开闭影响更大。本试验研究结果表明,低温、低温弱光均降低了西瓜幼苗叶片的Pn和Gs,而Ci却显示上升,说明Pn的下降不是因为气孔因素造成,而是由叶绿素或光合酶活性的降低等非气孔因素导致,以造成气孔关闭及胞间CO2的积累,这与国内外有关研究结论类似[23-24]。相对于单一低温而言,低温弱光加重抑制了幼苗的光合作用,这与张志刚等[24]对辣椒的低温弱光试验得出复合逆境对光合作用的抑制效果大于单一逆境的结论相似。
光抑制是植物普遍存在的现象,发生光抑制时过剩的光能会对叶片光合机构造成伤害,致使Fv/Fm下降[25]。何勇等[26]研究结果表明,低温弱光下辣椒幼苗光合作用减弱,最大光化学效率下降,且随着胁迫时间的延长,降幅逐渐增大。刘栓桃等[27]研究得出,西葫芦在低温弱光下光合速率和最大光化学效率下降平缓,PSⅡ反应中心受害较轻,反应中心仍能进行较高光合作用。本试验研究结果表明,Fv/Fm在低温、低温弱光下均呈现下降,PSⅡ潜在活性中心受到损害,抑制了光合作用的原初反应。相比于低温处理,低温弱光下Fv/Fm的下降幅度较小,表明在低温逆境中,弱光能减缓植物受到的光抑制损害,并减少由此造成的光合机构损伤。
ROS的累积会对细胞和光合系统构成严重伤害,ROS的产生被认为是细胞应激反应和防御途径的激活[28]。SOD、POD、CAT是植物体内清除ROS的主要酶系[29-30]。植物受到胁迫时,抗氧化酶活性诱导增强以消除过多氧自由基,维持体内活性氧代谢的平衡[31]。目前对低温弱光下植物抗氧化酶活性的研究结论存有差异,这与植物、耐性及处理不同有关。周艳虹等[32]研究结果表明,黄瓜幼苗在低温弱光处理后SOD、POD活性上升,植株在逆境下产生的氧自由基激发了体内的抗氧化酶系统。彭金光等[33]研究认为,低温增加了耐性西瓜品种SOD、POD酶活性,而敏感性品种抗性酶活性呈现先增后减的变化趋势。本试验研究得出,低温、低温弱光下,西瓜幼苗叶片SOD和POD活性先升后降,CAT活性持续下降,这表明西瓜幼苗在低温弱光下抗氧化酶活性升高,自由基清除能力增强,对细胞膜和光合系统在一定程度上起到了保护作用,这是植物对胁迫的适应性反应[34-36]。随着胁迫的持续,过多的氧自由基对SOD和POD的合成会产生抑制作用,致使抗氧化酶活性下降,无法清除的氧自由基会对细胞膜脂和光合系统造成伤害。此外,CAT活性的持续下降证实了CAT具有高度的冷敏感性,这与余纪柱的研究结论一致[37]。相比低温而言,植物在低温弱光下表现出较低且持久的抗氧化酶活性,这可能与其产生的相对少的氧自由基有关。植物体内ROS的产生超过抗氧化酶的清除能力会直接引起细胞膜结构和功能的破坏。MDA是膜脂氧化后的降解产物,是细胞膜伤害的主要原因[38]。本试验研究得出,低温、低温弱光增加了MDA含量,造成细胞膜脂出现不同程度的受害,而低温下的弱光能减缓氧自由基对细胞膜脂造成的影响,从而对细胞膜和光合系统起到保护作用。
综上所述,低温、低温弱光均抑制了西瓜幼苗叶片光合作用,致使Pn、Gs、Fv/Fm降低,而Ci持续升高,抗氧化酶SOD和POD活性先升后降,CAT活性下降,MDA含量增加。与低温比较,低温弱光不仅能适当提高PSⅡ的光化学效率,减轻光抑制作用,而且还能缓解由活性氧自由基对细胞膜和光合系统产生的损伤,从而提高西瓜幼苗的抗寒性。
参考文献
[1] Janmohammadi M. Metabolomic analysis of low temperature responses in plants[J]. Curr Opin Agric, 2012, 1(1): 1-6.
[2] Ruelland E, Zachowski A. How plants sense temperature[J]. Environ. Exp. Bot, 2010, 69(3): 225-232.
[3] 陶宏征, 赵昶灵, 李唯奇. 植物对低温的光合响应[J]. 中国生物化学与分子生物学报, 2012, 28(6): 501-508.
[4] Yan N, Xu X F, Wang Z D, et al. Interactive effects of temperature and light intensity on photosynthesis and antioxidant enzyme activity in Zizania latifolia Turcz. plants[J]. Photosynthetica, 2013, 51(1): 127-138.
[5] Karpinski S, Reynolds H, Karpinska B, et al. Systemic signaling and acclimation in response to excess excitation energy in Arabidopsis[J]. Science, 1999, 284(5 414): 654-657.
[6] 陈青君, 张福墁, 高丽红. 不同类型黄瓜苗期对亚适温弱光生理适应的差异[J]. 中国农学通报, 2003, 19(2): 1-3.
[7] Laloi C, Apel K, Danon A. Reactive oxygen signaling: the latest news[J]. Curr Opin Plant Biol, 2004, 7(3): 323-328,
[8] Dizengremel P, Le Thiec D, Bagard M, et al. Ozone risk assessment for plants: central role of metabolism-dependent changes in reducing power[J]. Environ Pollut, 2008, 156(1): 11-15.
[9] Shen W Y, Nada K, Tachibana S. Effect of cold treatment on Nonenzymic antioxidant activities in leaves of chilling-tolerant and chilling-sensitive cucumber(Cucumis sativus L.)cultivars[J]. J Jap Soc Hort Sci, 1999, 68(5): 967-973.
[10] Woo S Y, Lee D K, Lee Y K. Net photosynthetic rate, ascorbate peroxidase and glutathione reductase activities of Erythrina orientalis in polluted and non-polluted areas[J]. Photosynthetica, 2007, 45(2): 293-295.
[11] Turan O, Ekmekci Y. Activities of photosystem II and antioxidant enzymes in chickpea(Cicer arietinum L.)cultivars exposed to chilling temperatures[J]. Acta Physiol Plant, 2011, 33(1): 67-68.
[12] Almeselmani M, Deshmukh P S, Chinnusamy V. Effects of prolonged high temperature stress on respiration, photosynthesis and gene expression in wheat(Triticum aestivum L.)varieties differing in their thermotolerance[J]. Plant stress, 2012, 6(1): 25-32.
[13] 颉建明, 郁继华, 黄高宝, 等. 低温弱光下辣椒叶片PSII光能吸收和转换变化及与品种耐性的关系[J]. 中国农业科学, 2011, 44(9): 1 855-1 862.
[14] 刘 伟, 艾希珍, 梁文娟, 等. 低温弱光下水杨酸对黄瓜幼苗光合作用及抗氧化酶活性的影响[J]. 应用生态学报, 2009, 20(2): 441-445.
[15] 胡文海, 闫小红, 袁丽芳, 等. 光强在低温弱光胁迫后番茄叶片光合作用恢复中的作用[J]. 植物研究, 2011, 31(2): 164-168.
[16] 李爱民, 张永泰, 熊 飞, 等. 低温弱光对西瓜幼苗生理特性的影响[J]. 扬州大学学报: 农业与生命科学版, 2012, 33(2): 78-82.
[17] 杨万邦, 刘东顺, 赵晓琴, 等. 不同西瓜品种苗期耐低温弱光性综合评价[J]. 北方园艺, 2008 (4): 10-13.
[18] 邢 燕, 徐志红, 徐永阳, 等. 西瓜苗期耐低温弱光性鉴定指标初探[J]. 中国瓜菜, 2012, 25(6): 31-33.
[19] Rao K V M, Sresty T V S. Antioxidant parameters in the seedlings of pigeon pea[Cajanus cajan(L.)Millspaugh]in response to Zn and Ni stresses[J]. Plant Science, 2000, 157(1): 113-128.
[20] Cakmak I, Marschner H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase ascorbate peroxidase, and glutathione reductase in bean leaves[J]. Plant Physiol, 1992, 98(4): 1 222-1 227.
[21] 李合生. 植物生理学实验技术指导[M]. 北京: 高等教育出版社, 2001: 260-261.
[22] Takai T, Adachi S, Taguchi-Shiobara F, et al. Anatural variant of NAL1, selected in high-yield rice breeding programs, pleiotropically increases photosynthesis rate[J]. Scientific reports, 2013, 3: 2 149. doi: 10.1038/srep02149.
[23] Ploschuk E L, Badoa L A, Salinasa M, et al. Mphotosynthesis and fluorescence responses of Jatropha curcas to chilling and freezing stress during early vegetative stages[J]. Environ Exp Bot, 2014, 102, 18-26.
[24] 张志刚, 尚庆茂. 低 温、 弱光及盐胁迫下辣椒叶片的光合特性[J]. 中国农业科学, 2010, 43(1): 123-131.
[25] Demmig-Adams B, Adams W W. Photoprotection and other responses of plants to high light stress[J]. Annu. Rev. Plant. Physiol. Plant. Mol Biol, 1992, 43(1): 599-626.
[26] 何 勇, 符庆功, 朱祝军. 低温弱光对辣椒叶片光合作用, 叶绿素荧光猝灭及光能分配的影响[J]. 核农学报, 2013, 27(4): 479-486.
[27] 刘栓桃, 董艳敏, 卢亚楠, 等. 低温弱光对两个西葫芦品种幼苗光合速率及叶绿素荧光参数的影响[J]. 华北农学报, 2009, 24(2): 139-143.
[28] Desikin R, Mackerness S, Hancock J, et al. Regulation of the Arabidopsis transcriptosome by oxidative stress[J]. Plant Physiol, 2001, 127(1): 159-172.
[29] Bowler C, Montagu M, Inze D. Superoxide dismutases and stress tolerance[J]. Annu Rev Plant Physiol Plant Mol Biol, 1992, 43(1): 83-116.
[30] Polle A. Dissecting the superoxide dismutase-ascorbate peroxidase-glutathione pathway in chloroplasts by metabolic modeling. Computer simulations as a step towards flux analysis[J]. Plant Physiol, 2001, 126(1): 445-462.
[31] Markhart A H O. Chilling injury: A review of possible causes[J]. HortScience, 1986, 21(6): 1 329-1 333.
[32] 周艳虹, 喻景权, 钱琼秋, 等. 低温弱光对黄瓜幼苗生长及抗氧化酶活性的影响[J]. 应用生态学报, 2003, 14(6): 921-924.
[33] 彭金光,孙玉宏,师瑞红,等. 10 ℃低温对西瓜幼苗耐性生理指标的影响[J]. 安徽农学通报,2006,12(10): 42-45.
[34] 郁继华, 张国斌, 冯 致, 等. 低温弱光对辣椒幼苗抗氧化酶活性与质膜透性的影响[J]. 西北植物学报, 2006, 25(12): 2 478-2 483.
[35] Gechev T, Willekens H, Van Montagu M, et al. Different responses of tobacco antioxidant enzymes to light and chilling stress[J]. J Plant Physiol, 2003, 160(5): 509-515.
[36] 徐田军, 董志强, 兰宏亮, 等. 低温胁迫下聚糠萘合剂对玉米幼苗光合作用和抗氧化酶活性的影响[J]. 作物学报, 2012, 38(2): 352-359.
[37] 余纪柱, 李建吾, 王美平, 等. 低温弱光对不同生态型黄瓜苗期若干测定指标及光合特性的影响[J]. 上海农业学报, 2003, 19(4): 46-50.
[38] 孙 胜, 田永生, 冷丹丹, 等. 不同砧木对西瓜嫁接苗耐寒性的影响[J]. 生态学杂志, 2009, (8): 1 561-1 566.

