姜黄素对大鼠子宫内膜异位症雌激素生成的影响
张沁舒 方 毅 陈 蓉 王 力 姜 蓉
(重庆医科大学中医药学院,重庆 400016)
子宫内膜异位症(EMS)是一种由内分泌、免疫、基因异常等因素共同引起的雌激素依赖性与自身免疫性炎症疾病。环氧化酶(COX)-2前列腺素E2(PGE2)-芳香化酶(P450)-雌二醇(E2)通过正反馈形式相互促进雌激素生成〔1〕,相关炎症因子白介素-1β(IL-1β)可促进COX-2合成并维持易于异位内膜生长的局部内环境〔2〕。中药单体姜黄素已被证实可抑制异位子宫内膜血管生成〔3〕和体外异位内膜细胞分泌 E2〔4〕,并可诱导异位细胞凋亡〔5〕。但其对EMS雌激素正反馈生成代谢酶的研究国内外还未见报道,故本实验观察姜黄素对雌激素生成代谢酶及IL-1β的影响。
1 材料与方法
1.1 实验动物 SPF级雌性SD大鼠65只,体重180~220 g,性成熟未交配,由重庆医科大学实验动物中心提供,合格证号:SCXK(渝)2007-0001。
1.2 实验药物 姜黄素(化学式C21H20O6,分子量368.38,纯度大于 95%,批号:201011)与羧甲基纤维素钠(编号:S14L27-250g)购自生工生物(上海)有限公司,苯甲酸雌二醇注射液购自杭州动物药品厂(批号:100716),孕三烯酮胶囊购自北京紫竹药业有限公司(批号:53100201)。
1.3 实验试剂 E2发光免疫分析(ECLIA)试剂盒购自Roche公司(批号:110318),PGE2 ELISA试剂盒购自 R&D公司(批号:E10089)。IL-1βELISA试剂盒(批号:101213)、浓缩型DAB显色试剂盒(编号:ZLI-9018)购于北京中杉金桥公司。免疫组化染色试剂盒(编号:SP-0022)、兔抗大鼠P450arom(编号:bs-0732R)和COX-2多克隆抗体(编号:bs-0114R)均购于北京博奥森生物技术有限公司。
1.4 方法
1.4.1 动物建模 随机选取55只处于动情期的大鼠,用自体子宫内膜移植手术法建立EMS动物模型〔6〕:以10%水合氯醛(200 mg/kg)腹腔麻醉,开腹剪下大鼠左侧约8 mm的子宫段,剪成4 mm×4 mm的组织2块,缝于右侧腹壁和子宫壁。对剩余10只行假手术,把剪下的子宫段丢弃。术后连续3 d肌注庆大霉素,4 d肌注苯甲酸雌二醇。常规饲养3 w后开腹,发现移植物体积增大,表面有囊状小泡聚集,病理检验提示成模。
1.4.2 分组给药 55只造模大鼠,术后死亡3只,造模失败7只,造模成功45只。将造模成功的大鼠随机分组:姜黄素高剂量组(n=9),姜黄素中剂量组(n=8),姜黄素低剂量组(n=9),孕三烯酮组(n=9),模型组(n=10)。剩下非造模大鼠为假手术组(n=10)。根据等效剂量的直接折算法〔7〕,姜黄素组的剂量分别选用2倍大鼠等效剂量(100 mg/kg)、1倍(50 mg/kg)与0.5倍(25 mg/kg)作为其高、中、低剂量,孕三烯酮组给予孕三烯酮(0.5 mg/kg),上述四组都用生理盐水与0.5%的羟甲基纤维素钠配成4 ml混悬液,模型组与假手术组则给予4 ml生理盐水。连续3 w对大鼠每天一次灌胃给药后,麻醉开腹取腹主动脉血液,3 ml生理盐水冲洗腹腔后吸取腹腔液,均离心取上清;剪下异位移植物(假手术组取正常子宫内膜组织),测量体积后,一部分用10%甲醛溶液固定,另一部分匀浆取上清待测保存。
1.4.3 观测指标 ①用两脚规测量各组异位内膜移植物体积V(长×宽×高)mm3。②将取下的异位及正常子宫内膜组织在24 h内行脱水、透明、浸蜡、包埋及5μm厚度连续切片,之后HE染色。③用ECLIA检测子宫内膜组织E2,ELISA检测组织PGE2、血清和腹腔液 IL-1β。④用SP法测量各组子宫内膜P450arom、COX-2蛋白,在高倍镜(400×)下,每张切片随机选取5个不重复视野,阳性标准为棕黄色区域,用Image-Pro Plus6.0软件进行分析,计算每个视野平均光密度,取其5个视野的平均值以表示该切片P450和COX-2的表达量。
1.5 统计学方法 用SPSS18.0统计软件进行单因素方差分析、LSD检验、Games-Howell检验及配对T检验。
2 结果
2.1 异位子宫内膜体积测量 治疗后模型组移植物体积与治疗前各组相比无明显差异(P>0.05)。与治疗前各组及模型组比较:姜黄素高、中、低剂量组及孕三烯酮组治疗后异位组织体积明显缩小(P<0.05),见图1。治疗后,与孕三烯酮组比较,姜黄素高、中剂量组体积无明显差异(P>0.05),低剂量组体积偏大(P<0.05),见表1。假手术组大鼠异位子宫内膜组织体积为0。
2.2 子宫内膜组织HE染色 假手术组的正常子宫内膜上皮细胞多为柱状,胞核排列整齐,清晰可见,间质细胞分布均匀,腺腔完整;而模型组异位子宫内膜上皮细胞多见空泡,胞核排列散乱,间质疏松,可见血管增生,见图2。
2.3 ECLIA和ELISA法检测组织E2、PEG2、血清与腹腔液IL-1β 与模型组比较,姜黄素高、中、低剂量组及孕三烯酮组大鼠E2、PGE2、血清与腹腔液IL-1β均下降(P<0.05)。与孕三烯酮组比较,姜黄素高剂量组E2无明显差异(P>0.05),中、低剂量组含量偏高(P<0.05);高、中剂量组PEG2无明显差异(P>0.05),低剂量组含量偏高(P<0.05),见表2。
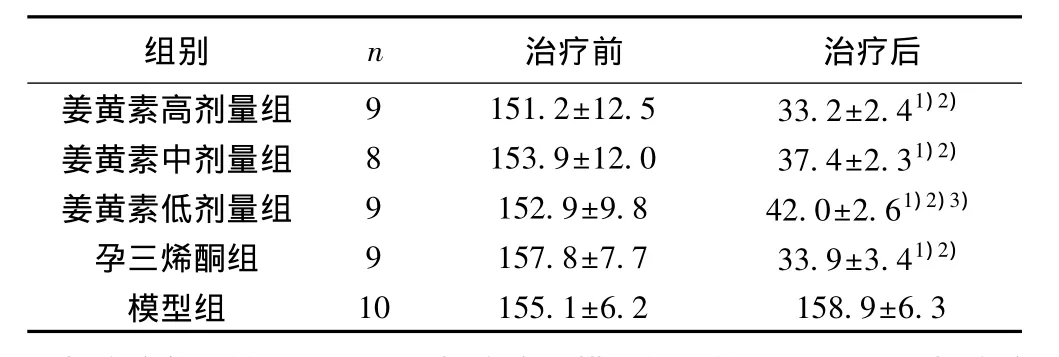
表1 大鼠异位子宫内膜组织体积(x±s,mm3)

图1 模型组与治疗组大鼠异位子宫内膜组织
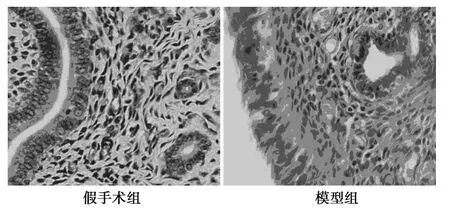
图2 假手术组与模型组大鼠子宫内膜(HE,×400)

表2 各组大鼠E2、PGE2与IL-1β的含量及大鼠子宫内膜P450arom、COX-2蛋白表达的比较(x±s)
2.4 SP法检测P450arom、COX-2蛋白 非假手术组异位子宫内膜腺上皮细胞质中P450arom与COX-2呈不同程度的棕黄色表达,假手术组几乎无P450arom与COX-2表达。与模型组比较,姜黄素高、中、低剂量组与孕三烯酮组P450arom与COX-2表达均显著降低(P<0.05)。与孕三烯酮组比较,姜黄素中剂量组P450arom无明显变化(P>0.05),高剂量组含量偏低(P<0.05),低剂量组含量偏高(P<0.05);而姜黄素高、中、低剂量组COX-2表达量均偏高(P<0.05),见图3、图4和表2。
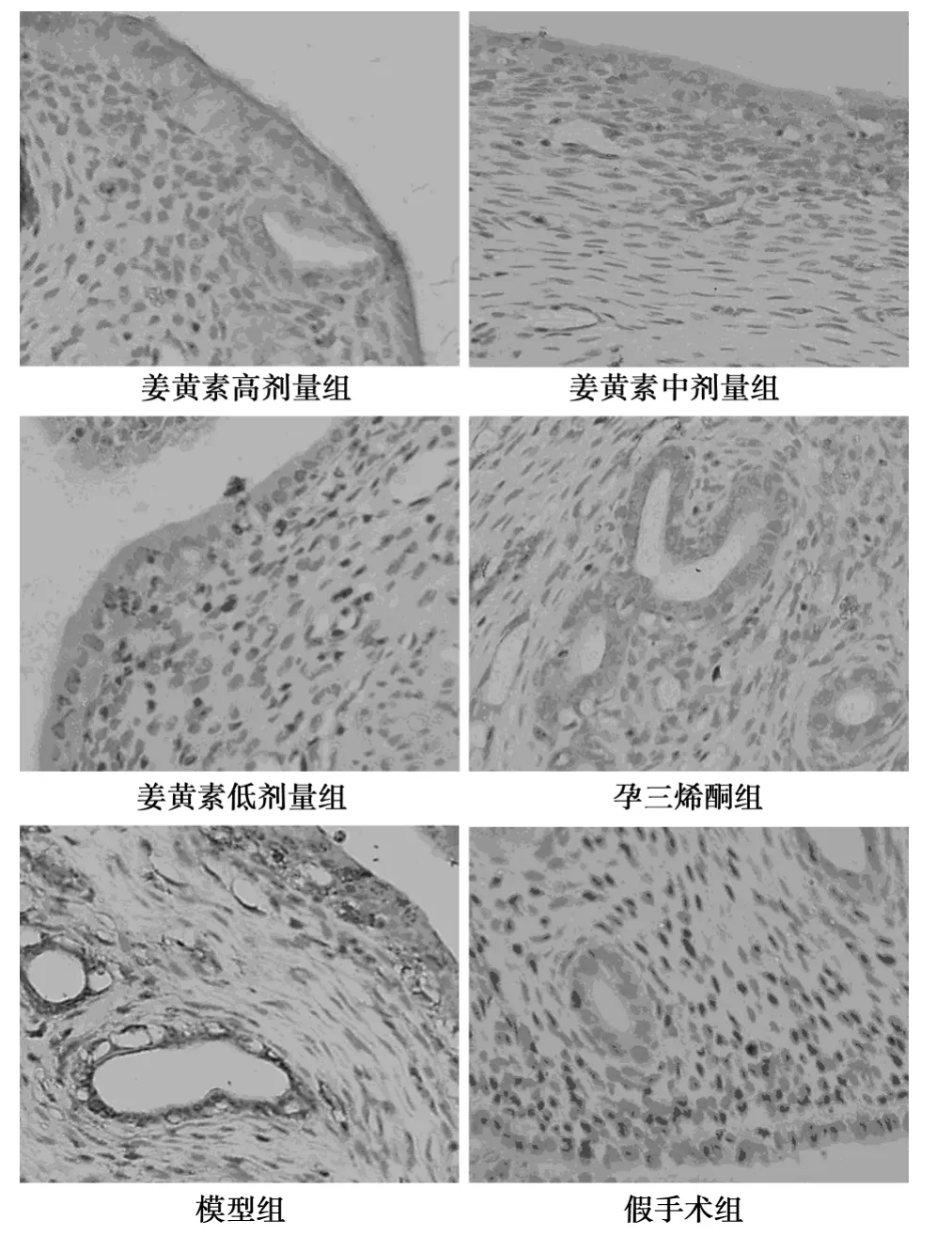
图3 P450arom在大鼠子宫内膜的表达(SP,×400)
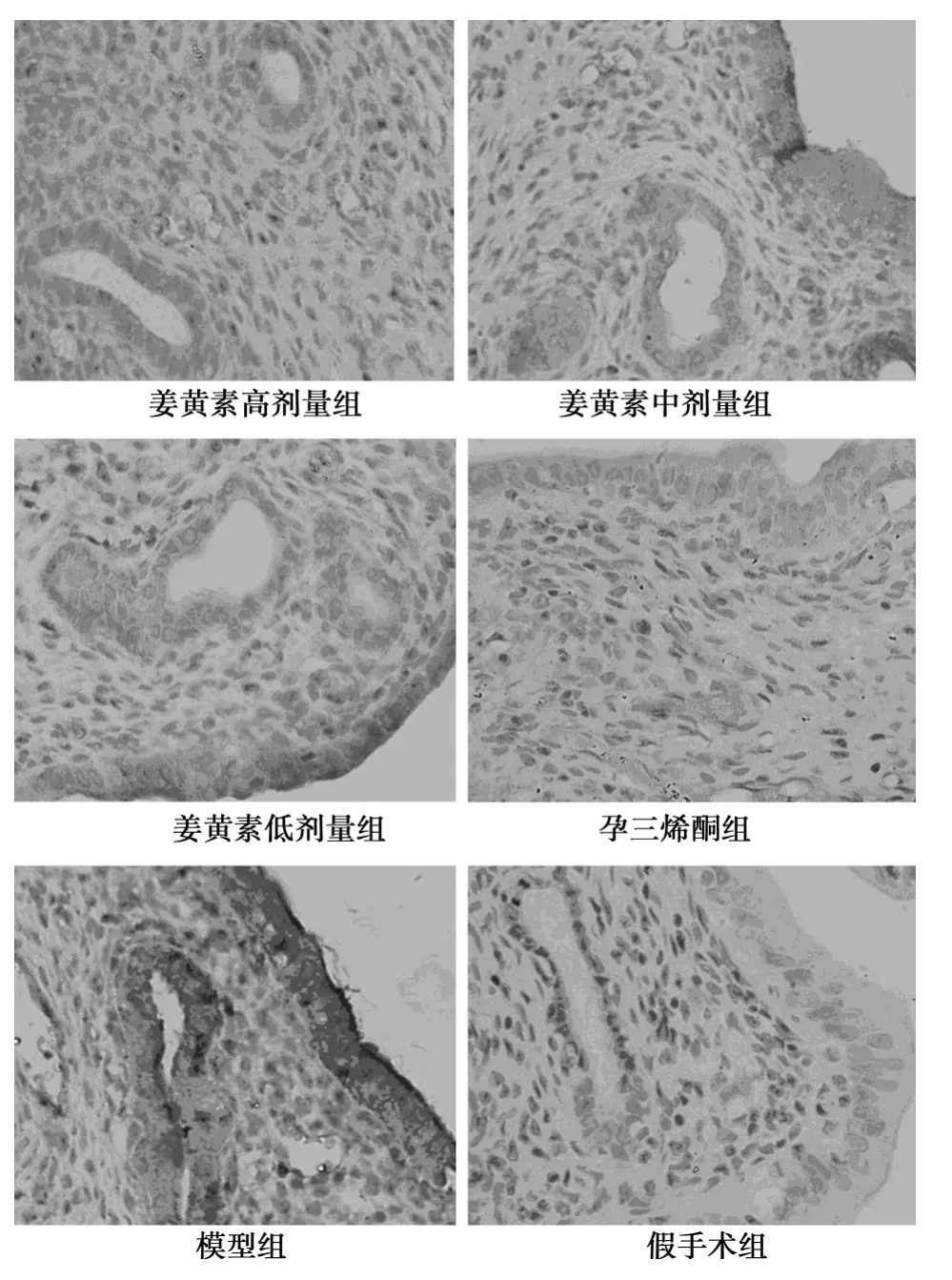
图4 COX-2在大鼠子宫内膜的表达(SP,×400)
3 讨论
COX-2、PGE2、P450是局部雌激素生成代谢的重要酶及因子:COX-2可促进PGE2合成,PGE2可促进P450arom合成,而P450arom则可促进雌激素的合成,并在17β-羟类固醇脱氢酶Ⅰ的协助下使之转变为高生物学活性的雌二醇,雌二醇又可增强COX-2的活性,如此反复,形成正反馈环〔1,2〕,使体内雌激素水平及活性增高。而IL-1β则可刺激COX-2的表达,在雌激素生成过程中起到“煽风点火”的作用。除了直接影响雌激素生成代谢,雌激素正反馈环的酶及相关炎症因子IL-1β还可通过多环节、多渠道交叉促进EMS的发生和发展:COX-2可抑制机体免疫清除;上调金属素蛋白酶(MMPs)表达,增强异位内膜细胞黏附、迁移及侵袭的能力〔8〕;还可促进异位内膜细胞增殖与血管生成〔9〕。PGE2通过上调类固醇合成急性调节蛋白(StAR)的活性,也可增加雌激素合成;还能上调成纤维细胞生长因子-9(FGF-9)含量,促进异位细胞增殖,抑制凋亡与免疫清除〔10〕;并能促进血管内皮生长因子(VEGF)释放及白细胞聚集,引起异位内膜血管增生和局部病灶免疫炎症反应〔11〕。IL-1β为一种前炎性介质,是把雌激素合成与免疫-炎症反应两种病理过程联系在一起的中间环节,不仅能通过COX-2间接刺激雌激素合成,还能诱导 IL-6、IL-8、肿瘤坏死因子-α(TNF-α)、正常 T 细胞表达和分泌的调节活化蛋白(RANTES)等细胞因子,引起免疫-炎症反应,使异位内膜细胞更易黏附、侵袭,并刺激血管生成,为异位内膜的生长提供一个良好的腹腔内环境〔12〕。
本研究提示与雌激素正反馈环相关的酶和因子含量的改变,可促进局部异位内膜细胞及外周组织原位合成雌激素,增加腹腔炎症因子释放,改变机体免疫功能,维持机体高雌激素水平和腹腔炎症内环境。经姜黄素治疗过后,上述酶和因子较模型组明显降低,异位组织体积缩小。高剂量姜黄素除了降低COX-2效果稍不如孕三烯酮,其他效同,且副作用小,证明姜黄素能通过抑制PGE2、P450arom、COX-2与IL-1β的表达,阻断雌激素生成正反馈环,使具有高生物学活性的E2生成减少,并可能通过各因子的一系列交叉作用机制抑制异位子宫内膜生长。
姜黄素具有抗炎、抗肿瘤的作用,可抑制人软骨细胞和结肠癌COX-2的表达,使PGE2减少,还可抑制肺泡细胞IL-1β产生〔13〕,但姜黄素对上述因子在 EMS中的影响还尚未报道。EMS是雌激素依赖炎性疾病,本研究证明其不仅有抗感染效应,还有抗雌激素作用。而长期应用孕三烯酮会出现阴道不规则出血、闭经、座疮等副作用,但应用姜黄素出现副作用还未见报道。故较之孕三烯酮,姜黄素有望成为长期治疗内异症的潜在中药成分,为以后EMS的临床新药开发提供理论依据。
1 Rizner TL.Estrogen metabolism and action in endometriosis〔J〕.Mol Cell Endocrinol,2009;307(1-2):8-18.
2 Kao AP,Wang KH,Long CY,et al.Interleukin-1beta induces cyclooxygenase-2 expression and promotes the invasive ability of human mesenchymal stem cells derived from ovarian endometrioma〔J〕.Fertil Steril,2011;96(3):678-84.
3 张 颖,曹 洪,张昌军.姜黄素抑制子宫内膜异位症微血管密度的实验研究〔J〕.时珍国医国药,2008;19(8):1979-81.
4 余 峥,王文娟,张昌军,等.姜黄素抑制子宫内膜异位症雌激素生成的实验研究〔J〕.时珍国医国药,2010;21(6):1447-9.
5 王澍弘,徐鸿毅,董毅飞,等.姜黄素对体外培养异位内膜细胞生长及凋亡的影响〔J〕.中国中医急诊,2009;18(5):784-6.
6 杨 萍,纳冬荃,熊亚龙,等.大鼠子宫内膜异位模型的建立与组织学观察〔J〕.中国实验动物学报,2006;14(2):139-41.
7 徐叔云,卞如濂,陈 修.药理实验方法学〔M〕.第2版.北京:人民卫生出版社,2002:203.
8 Banu SK,Lee J,Speights VO Jr,et al.Cyclooxygenase-2 regulates survival,migration,and invasion of human endometriotic cells through multiple mechanisms〔J〕.Endocrinology,2008;149(3):1180-9.
9 Horn LC,Hentschel B,Meinel A,et al.Cyclooxygenase-2 expression,Ki-67 labelingindex,and perifocal neovascularization in endometriotic lesions〔J〕.Ann Diagn Pathol,2009;12(6):373-7.
10 王 婧,赵志明,黄向华,等.PGE2信号通路对子宫内膜异位症发病机制的影响〔J〕.生殖与避孕,2011;31(8):544-8.
11 Sacco K,Portelli M,Pollacco J,et al.The role of prostaglandin E2 in endometriosis〔M〕.England:Informa Healthcare,2012:134-8.
12 毛 洁,凡利俊.白细胞介素-1β在子宫内膜异位症患者血清及腹腔液中的变化〔J〕.中国妇幼保健,2008;23(10):1409-10.
13 郑玉强,邓立普.姜黄素理作用研究进展〔J〕.辽宁中医药大学学报,2011;13(2):212-4.

