不同破损程度下军用车辆镀锌钢板腐蚀行为研究
徐安桃,孙波,杨纯艳,罗兵,张帆
(1.军事交通学院,天津 300161;2.中国人民解放军 94277部队,济南 250023;3.92403部队,福州 350000)
军用车辆在服役过程中,车身钢板、紧固件等零部件表面的镀锌层和涂装漆膜能为钢板提供很好的保护。在运行或装配过程中,当因划伤、碰撞和擦伤等机械作用使车身局部表面漆膜破损,甚至镀锌层破坏时,镀锌层和钢板基体就会暴露在自然环境中,在外界腐蚀介质作用下,镀锌层和钢板基体构成双向耦合腐蚀电极系统,发生电化学腐蚀[1]。
文中通过模拟某种军用车辆在实际服役过程中镀锌层产生的不同破损程度,用3.5%(质量分数)NaCl溶液浸泡,进行开路电位、电化学阻抗谱及极化曲线测试,探讨不同破损率下军用车辆镀锌层的腐蚀规律,为现场测试提供一定的依据。
1 实验
定义镀层的破损率K:

式中:Sp为镀层试样的破损面积;S为镀层试样的工作面积。
实验试样取自军用车辆生产厂家,如图1所示。镀锌基板是Q235钢板,厚度为3 mm,采用防护性电镀涂装方式。在试样工作面上设计不同的破损直径,破损直径为0,5,10,20,25,30,35,40,45,50 mm所对应的破损率K分别为0,1%,4%,16%,25%,36%,49%,100%。

图1 镀锌板试样Fig.1 The sample of zinc-galvanized plate
实验介质为3.5%NaCl溶液,实验温度为(23±2)℃。根据实验需要,设计了如图2所示腐蚀电解池,试样工作面积为19.64 cm2。待开路电位稳定后,对各试样进行电化学阻抗谱及动电位极化曲线测试。使用PARSTAT电化学测试系统,测试频率范围为100 kHz~100 mHz,对数扫频,每倍频程8步,施加的正弦波激励的幅值为10 mV,极化范围为-0.25~1.2 V,扫描速度为0.1660 mV/s。采用辅助电极为铂电极,参比电极为饱和甘汞电极(SCE),工作电极为镀锌层试样的三电极系统[2]。

图2 腐蚀电解池Fig.2 Corrosion electrolytic cell
2 实验结果与讨论
2.1 开路电位的变化
金属在液态介质中的腐蚀电位是研究金属在液态介质中腐蚀与防护的基本参数之一[3]。完好镀层的开路电位最低,为-1.08 V左右。随着镀层破损率的增大,开路电位呈正移趋势,但变化幅度很小,而基板的开路电位最高,约-0.71 V,如图3所示。
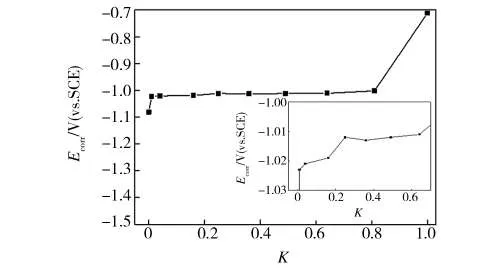
图3 镀层自腐蚀电位随破损率K的变化Fig.3 The change of self-corrosion potential of the coated plate along with the damage rate K
由于镀锌层与碳钢基板存在明显的自腐蚀电位差,两者在腐蚀介质中接触会产生电偶效应,形成电偶腐蚀[4]。此时,两种金属的自腐蚀电位差越大,其电位低的金属作为阳极越容易腐蚀,而电位高的金属作为阴极越容易受到保护[5—7]。随着破损出现,镀锌层与基板的混合开路电位呈现逐渐上升的趋势,但变化幅度不大,均比基板的开路电位低约0.3 V。这表明在腐蚀过程中锌层将始终作为阳极性涂层对钢板基体起保护作用,说明当镀锌板出现因腐蚀或机械损伤暴露出基体时,基体与镀锌层将会构成腐蚀微电池,锌层作为腐蚀电池的阳极发生快速腐蚀,相反,碳钢基体则作为腐蚀电池的阴极而受到保护。
2.2 阻抗谱分析
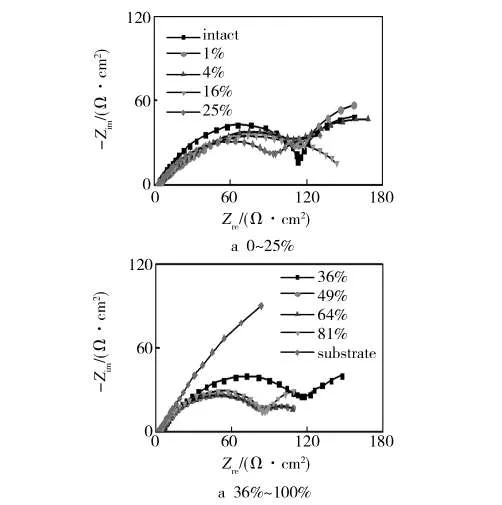
图4 不同破损程度镀锌层的Nyquist图Fig.4 The Nyquist figure of zinc-galvanized plate with different damage degrees
由图4可知,除了基板和破损率为16%的镀锌层,其他破损镀锌层在Nyquist图上呈扁平状双容抗弧(各弥散指数均大于0.6)。说明镀锌层电极表面粗糙或电流分布不均产生了弥散效应,高频端容抗弧对应于锌层/溶液界面,主要反映锌层表面原有或生成的氧化膜或腐蚀产物与溶液界面的信息。低频端容抗弧对应于镀锌层破损区域基体金属/溶液腐蚀界面信息,主要反映基体金属的腐蚀阻力。由于高频及低频区的容抗弧半径总体上呈减小趋势,说明随着破损率的增大,锌层表面的氧化物在逐渐减薄,或者其生成速度小于溶解速度,锌层阻抗在减小,并且基体金属的腐蚀阻力在逐渐减小,破损区域基体金属腐蚀越来越严重,镀层的防护作用逐渐减弱。
从Nyquist图中还可以看出,当K小于16%时,镀锌板的整体容抗弧随K的增加呈增大趋势,低频阻抗变化也存在同样变化趋势;当K大于16%时,随着K增加,整体容抗弧则呈逐渐减小趋势,对应的低频阻抗变化趋势基本相同,如图5所示。其原因主要是,破损镀锌板在腐蚀过程中,受到与K值成正比的腐蚀阻力的钝化作用以及与K值成正比的电偶效应这两种相互竞争因素的影响[8]。当K小于16%时,前一种因素将起主导作用,使体系总体腐蚀阻力增加;当K大于16%时,后一种因素将起主导作用,使体系电偶电流增加,表现为腐蚀阻力的减小。电偶电流的增加反映了锌层为其破损区域基体金属提供牺牲阳极的阴极保护作用。

图5 镀锌板低频阻抗模值|Z|0.1 Hz与破损率K的关系Fig.5 The relation figure between the impedance modulus at 0.1 Hz(|Z|0.1 Hz)of zinc-galvanized plate and the damage rate K
不同破损程度的镀锌层试样拟合电路如图6所示。基板和K为16%的试样的电化学等效电路都可用Rs(CdlRct)O描述,如图6a所示。这说明基板发生了均匀腐蚀,其中Rs为溶液电阻,Cdl为基板和镀锌板表面与溶液的界面电容,Rct为腐蚀界面的电荷转移电阻,O为平面电极有限层扩散阻抗。这里主要是因为在试样表面产生了一些非致密性保护膜而引起的。

图6 不同破损程度的镀层试样拟合电路Fig.6 Equivalent electric circuits of coated plates with different damage degrees
K为0%,1%,4%,25%,36%,49%,64%,81%的试样在腐蚀初期,锌层表面可能不均匀或者有分布不均匀的氧化膜生成,从而引起了弥散效应。其等效电路可用Rs(Qb(Rb(QdlRct)))表示,其中Qb为氧化膜或腐蚀产物与溶液界面的电容,Rb为氧化膜的电阻,Qdl为基板和镀锌板表面与溶液的界面电容,Rct为腐蚀界面的电荷转移电阻,等效电路如图6b所示。
镀锌板电荷转移电阻Rct随破损率K变化如图7所示。一般地,Rct可以表征金属的腐蚀速率,特别是在局部腐蚀的情况下,因此是金属耐蚀性能的主要参数之一。
由图7可以看出,基板Rct值最大,是次最高值(K为16%的镀锌板)的3倍左右,其他镀锌板的电荷转移电阻Rct值总体上随K值的增加而降低。说明单一的基板腐蚀速度最小,K为16%的镀锌板较大,其他破损镀层的腐蚀速度基本随着K值的增大而增加,这同阻抗分析结果相同。基板与各镀锌板Rct值相差较大则说明了金属基体与其表面涂装的锌层在腐蚀体系中产生了较强电偶效应,其结果是锌层腐蚀加速,而金属基体得到了较好的阴极保护。

图7 镀锌板Rct随破损率K变化Fig.7 The change of Rctof zinc-galvanized plate along with the damage rate K
2.3 极化曲线分析
镀锌板在3.5%的NaCl溶液中的动电位极化曲线如图8所示。可以看出,基板的极化行为明显不同于镀锌试样,没有发生钝化,各镀锌板试样的阳极极化行为比较类似,说明在电极反应初期,各镀锌板试样的腐蚀机理相同,主要体现为活性溶解过程,属于活化控制。在-0.6~-0.2 V区域,阳极均出现了钝化特征,阳极溶解电流迅速下降并逐渐稳定,锌层表面有白色絮状产物生成,这会导致锌层腐蚀速度的降低。尽管钝化作用会增大镀层阻抗,降低其腐蚀速度,增强其耐蚀性能,但由于可能会引起锌层电位的正移,从而削弱了电偶效应,可能会在一定程度上减弱锌层对基体金属的阴极保护效果。

图8 镀锌板的动电位极化曲线Fig.8 Potential dynamic polarization curve of zinc-galvanized plate
由于阳极的电流密度与腐蚀速度是相当的,因此可以通过测试镀锌板的阳极电流密度大小来判断其腐蚀速度。不同破损程度的镀锌板在3.5%的NaCl溶液中的腐蚀电流密度如图9所示。
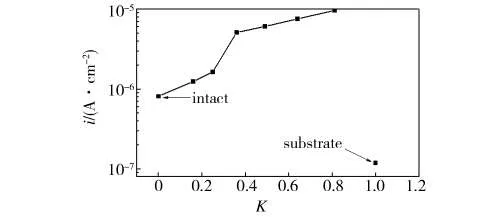
图9 不同破损程度下的镀锌板的腐蚀电流密度Fig.9 The corrosion current density of zinc-galvanized plate with different damage degrees
从图9可以看出,基板及完好镀锌板的腐蚀电流密度最小,两者腐蚀电流密度均为10-7A/cm数量级,其他各镀锌板腐蚀电流密度均为10-6A/cm数量级。表明在相同腐蚀环境中,基板的腐蚀速度最慢,各镀锌层的腐蚀速度明显较基板快。这主要是锌层与金属基体之间形成了电偶效应所致,是电偶保护效应使锌层极化以致加速腐蚀这一内在本质的外在反映。因此,对于锌层破损的试样,镀层的腐蚀将对试样整体腐蚀起主要贡献,其结果是试样破损区域基体金属得到了较好的阴极保护。
各镀锌板随着破损率的增大,腐蚀电流密度逐渐增加,其原因主要是腐蚀过程中阳极电流与阴极电流总是相等的,当阳极面积逐渐减小而阴极面积不变时,阳极上的电流密度将逐渐增大。张艳成等[9]在研究3.5%NaCl溶液中带锈铸铁和304不锈钢之间的腐蚀效应时,也得到类似的结论。因此,随着破损率的增加,镀锌板的腐蚀将会加剧,其结果是,一方面,镀锌层因腐蚀电流密度增加,其耐蚀性减弱;另一方面,在电偶效应作用下,金属基体将受到锌层牺牲阳极的阴极保护。
3 结论
1)完好军用车辆镀锌钢板自腐蚀电位低于基体金属约0.3 V,且腐蚀电流密度均明显高于基板,镀锌层的腐蚀过程对基体金属的保护起重要作用。
2)基板的腐蚀速度最低,各镀锌钢板腐蚀速度随着破损率的增加逐渐增大。
3)基板的极化行为不同于镀锌试样,未出现明显的钝化现象。各镀锌钢板试样阳极极化曲线相似,说明在电极反应初期,镀锌钢板腐蚀机理相同,均为活性溶解过程,属于活化控制。
[1] 魏宝明.金属腐蚀理论及应用[M].北京:化学工业出版社,2002.WEI Bao-ming.Theory and Application of Metal Corrosion[M].Beijing:Chemical Industry Press,2002.
[2] 宋诗哲.腐蚀电化学研究方法[M].北京:化学工业出版社,1988.SONG Shi-zhe.Corrosion Electrochemical Methods[M].Beijing:Chemical Industry Press,1988.
[3] ZHU X R,HUANG G Q.Research of Contact Corrosion of Metallic Materials in Seawater[J].Mar Sci,1994(6):55—59.
[4]YADAV A P,NISHIKATA A,TSURU T.Degradation Mechanism of Galvanized Steel in Wet-Dry Cyclic Environment Containing Chloride Ions[J].Corros Sci,2004(46):361—376.[5]BARNARD N C,BROWN S G R.Modelling the Relationship between Microstructure of Galfan-type Coated Steel and Cut-edge Corrosion Resistance Incorporating Diffusion of Multiple Species[J].Corros Sci,2008(50):2546—2858.
[6] 曹楚南.腐蚀电化学原理[M].北京:化学工业出版社,2004.CAO Chu-nan.Principle of Corrosion Electrochemical[M].Beijing:Chemical Industry Press,2004.
[7] SZIR Ki L,SZOCS E,PILB H Z,et al.Study of the Initial Stage of White Rust Formation on Zinc Single Crystal by EIS,STM/AFM and SEM/EDS Techniques[J].Electrochim Acta,2001(46):3743—3754.
[8]CHENG Y L,ZHANG Z,CAO F H,et al.A Study of the Corrosion of Aluminum Alloy 2024-T3 under Thin Electrolyte Layers[J].Corros Sci,2004(46):1649—1667.
[9] ZHANG Y C,WU Y S,ZHANG J.Galvanic Corrosion of Rusty Cast Iron and 304 Stainless Steel[J].Corro Sci Protechnol,2001,13(2):66—70.

