貂源伪狂犬病病毒的分离鉴定及gE基因分子特征
芮 萍,刘曜综,马增军,王秋悦,杨彩然,刘谢荣
(河北科技师范学院 河北省预防兽医学重点实验室,秦皇岛066004)
伪狂犬病病毒(pseudorabies virus,PRV),又称猪疱疹病毒Ⅰ型,属疱疹病毒科α疱疹病毒亚科。PRV具有广泛的宿主谱,猪是主要贮存宿主和传染源。PRV主要引起家畜和多种野生动物出现以发热、奇痒、呼吸和神经系统疾病为特征的急性传染病[1-3]。自2011 年以来,在四川、黑龙江、吉林、江苏等地许多使用基因缺失活疫苗免疫的规模化猪场出现了PR流行,同时在不同地区分离出了PRV变异株[4-8]。与此同时,PRV不仅在本地区猪群中蔓延,在家养毛皮动物中普遍发生疑似伪狂犬病,呈现地区性暴发趋势,造成了巨大的经济损失。病毒感染狐、貂、貉表现持续搔痒、自咬、兴奋不安、神经麻痹、消瘦、腹泻、失明或呼吸困难等症状。甚至有些狐、貂并无明显临床症状,突然死亡。
为了证实流行疫病为伪狂犬病毒感染所致,本试验通过对疑似伪狂犬病病料处理、病毒分离鉴定、PRVgE基因扩增与序列分析,为认识貂源流行病毒分子特征、疫情的防控以及疫苗研究提供参考和依据。
1 材料与方法
1.1 病料、细胞及实验动物
脑组织病料来源于河北省昌黎县某水貂饲养场,表现为兴奋不安、尖叫、腹泻等疑似伪狂犬症状的病死成年水貂。MDCK细胞由河北省预防兽医学重点实验室保存;家兔由河北科技师范学院实验动物中心提供。
1.2 主要试剂
DNA提取试剂盒购自北京全式金生物技术有限公司,DMEM培养基为GIBCO产品,胎牛血清为WISENT产品,LaTaqDNA 聚合酶、dNTP Mixture、2×GC BufferⅡ购自TaKaRa生物科技(大连)有限公司。
1.3 病毒基因组的提取及PCR扩增
以组织/细胞基因组DNA提取试剂盒提取核酸。参照文献方法合成引物,PCR扩增[9]。
1.4 病毒分离与纯化
将PCR鉴定为阳性的脑组织匀浆液,采用0.22 μm滤器过滤除菌后接种MDCK单层细胞进行培养,并观察细胞病变(CPE)。待CPE达80%左右时收毒,冻融后取上清。将收获的病毒液经过3轮空斑纯化后接种MDCK细胞,收获病毒液冻存于-70℃。
1.5 病毒粒子的电镜观察
取MDCK细胞中培养的第3代病毒液用2%磷钨酸负染,在电镜下观察病毒粒子形态。
1.6 免疫荧光鉴定(IFA)
将分离病毒接种6孔板中的MDCK细胞,24h后弃培养液,以预冷的丙酮固定30min,分别加1∶200稀释的一抗500μL,37℃孵育1h,用GFP标记兔抗猪二抗37℃孵育1h,置荧光倒置显微镜下观察。
1.7 动物接种试验
将经纯化后的病毒液按1∶100稀释后接种2只家兔,每只皮下注射1mL,另2只对照家兔分别注射1mL DMEM维持液。
1.8 gE基因序列分析
以提取的病毒分离株细胞培养物的DNA为模板,对gE基因进行PCR扩增,并将扩增产物克隆至pGM-T载体中进行序列测定。利用DNAS-tar7.1生物学分析软件进行分析。
2 结 果
2.1 病料样品检测
将疑似伪狂犬病貂的脑组织匀浆后提取DNA,用gE特异性引物进行PCR检测。结果扩增出约1 700bp的DNA片段(图1),表明送检样品为PRV阳性。
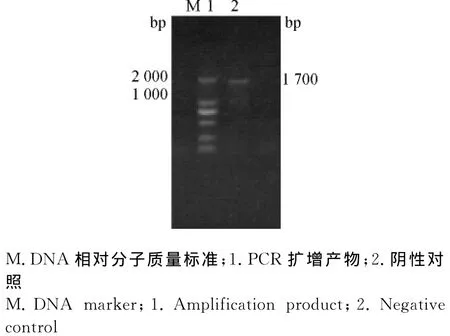
图1 貂脑组织样品gE基因PCR鉴定Fig.1 PCR amplification of PRV gEfragments from mink brain sample
2.2 病毒的分离及鉴定
将阳性脑组织匀浆液过滤除菌后接种MDCK单层细胞,盲传至第2代时,在接毒后20h产生明显CPE(图2),可见细胞膨大变圆,失去光泽,形成合胞体,部分细胞开始出现折光性增强,48h后90%细胞脱落。利用gE特异性引物对培养物进行PCR鉴定,能够扩增到预期片段。将F3代培养物负染后进行电镜检测,可以观察到病毒粒子近似球形,直径150~180nm,有囊膜,且囊膜上有凸起(图3)。将分离毒株命名为Mink 1。
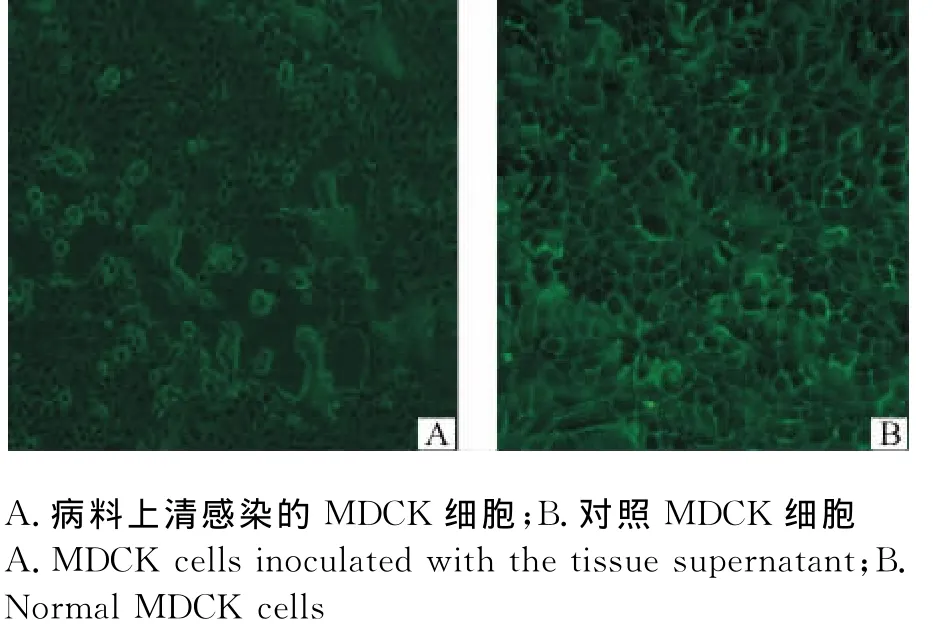
图2 病料脑组织匀浆上清液感染MDCK细胞引起的细胞病变Fig.2 Cytopathogenic effects of MDCK cells inoculated with homogenated brain tissue supernatant

图3 病毒粒子的电镜观察 (Bar=100nm)Fig.3 The morphology of virus particles under electron microscope(Bar=100nm)
2.3 IFA鉴定
分离病毒感染MDCK细胞后,用PRV阳性血清做IFA检测。如图4所示,病毒感染能产生典型合胞体病变,合胞体能与PRV阳性血清作用,显示强烈荧光,这证实分离病毒确为PRV。
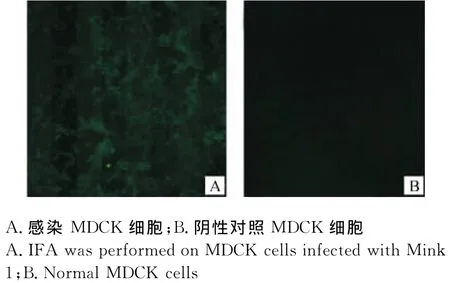
图4 病毒的间接免疫荧光检测结果Fig.4 IFA identification of the isolated virus
2.4 动物接种试验
家兔接种病毒后于58h出现兴奋不安、阵发性抽搐,撕咬接种部位,继而出现前肢麻痹,在接种后60h角弓反张死亡。注射DMEM培养液的对照家兔无任何临床症状。
2.5 病毒核酸gE全基因扩增及系统发育分析
采用PCR扩增完整的gE基因编码区,克隆于pGM-T中进行测序,获得1 757bp基因片段。对gE核苷酸序列与其他毒株序列进行比对,结果发现,Mink 1基因序列与国内外其他对应序列相比有5个独特的核苷酸突变,第96位(G→T)、136位(T→C)、317位(T→C)、943位(G→C)、1 052位(G→A),另外,还有6处突变与2012年之后国内分离株普遍存在的突变位点相同,分别是142-144位GAC插入,161位G→A,228位C→A,1 343位G→A,1 487-1 490位ACG插入,1 535位G→A。核苷酸序列相似性分析结果表明Mink 1株与其他毒株gE基因相似性为97.1%~99.4%,与XiangA株和ZM株相似性最高,为99.4%。Mink 1株和部分2012年新分离的毒株位于一个相对独立的分支中,而与以前分离的毒株亲缘关系相对较远,系统进化树见图5。
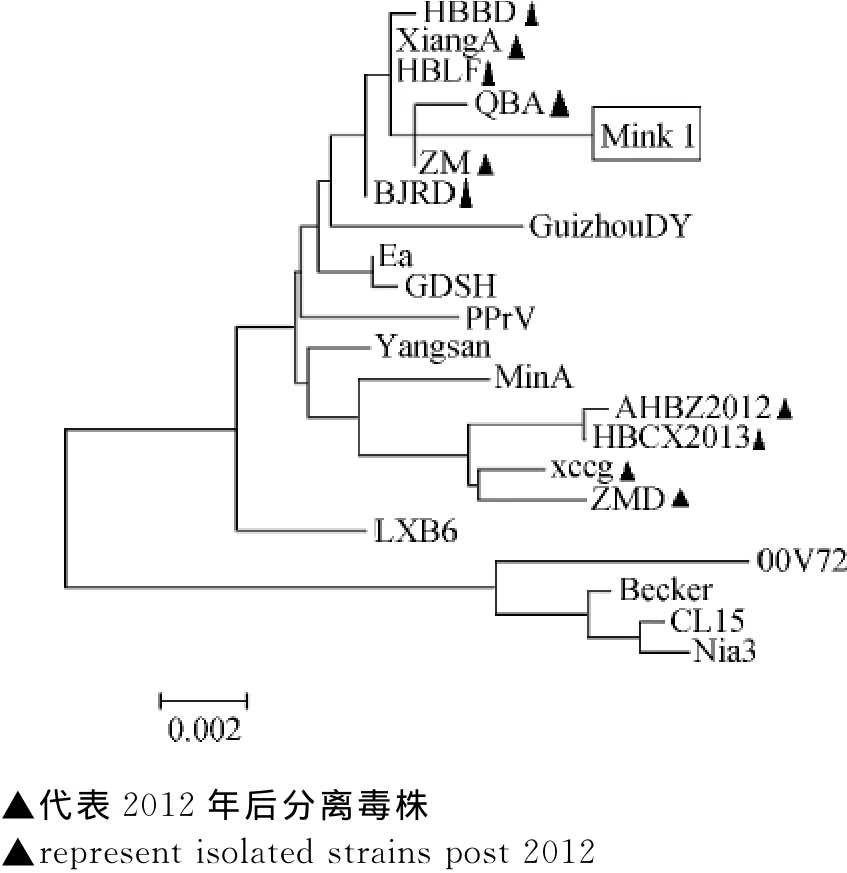
图5 系统进化分析Fig.5 Phylogenetic analysis
3 讨 论
本研究通过采集疑似伪狂犬病水貂病料,将PCR检测阳性病料接种MDCK细胞,并通过电镜形态和免疫荧光观察,初步证实从发病水貂脑组织中分离出1株PRV野毒株。将经蚀斑纯化后的病毒液接种家兔,试验组家兔在接种病毒后出现明显的伪狂犬症状,皮肤瘙痒,用嘴啃咬注射部位,兴奋不安,继而出现四肢麻痹,最终角弓反张死亡。
由于目前缺乏对貂伪狂犬病的详细描述资料,该病常被误诊为链球菌性脑炎、犬瘟热和细小病毒性肠炎。PRV基因组GC含量高达70%,设计检测病毒的PCR引物难度较大,有时造成检测样品不够敏感,确诊该病最有力的证据仍是分离获得病毒。在病料的检测过程中,发现脑组织的病毒含量高,应尽量以发病貂的脑组织作为检测材料。
对gE基因的进化分析发现,Mink 1分离毒株gE基因与国内外其他猪源参考毒株gE基因相似性在97%以上,与2012年新近分离的猪源伪狂犬病毒株遗传关系近,位于一个相对独立的分支中,与以前分离的毒株遗传关系较远。尽管这些病毒株能否形成一个新的流行毒株群还有待更多的分子流行病学数据来验证。但可以推断,当前本地区流行的貂源PRV可能由猪源PRV变异毒株而来,这与对犬的相关报道相似[10]。序列突变分析显示,Mink 1同时存在142—144位GAC和1 487—1 490位ACG两处特征性插入,并在1 535位、161位、228位等11处发生点突变。这些插入或点突变是否与病毒毒力增强有关,其功能有待进一步研究。此外,除gE基因外的其他PRV基因是否发生了更多突变,从而使其得以在不同宿主间传播也需要更进一步的研究探索。
近年来,伪狂犬病病毒呈现变异速度加快、毒力增强、跨种感染增多的趋势。在狐、貉、貂等毛皮动物饲养较密集的区域,大量出现伪狂犬病临床症状为主要表现的病症,且呈暴发流行趋势。据病史调查,病兽既有生食猪、牛、羊等动物产品的病史,也有无生食动物产品病史;有的毛皮动物养殖场毗邻猪场,有的距离养猪场较远,因此,感染途径除了经消化道感染以外,不排除通过空气传播猪源PRV的可能性。因此,毛皮动物养殖场应距离猪场较远些,平时要做好隔离消毒措施。同时要加强猪伪狂犬病的防疫,是有效防控毛皮动物伪狂犬病的重要措施。
4 结 论
首次报道从发病水貂中分离鉴定PRV,并对其gE基因序列进行测定,经电镜形态、免疫荧光观察,以及PCR检测证实分离到病毒,命名为 Mink 1。gE基因进化分析表明,该毒株与2012年以来猪伪狂犬变异株的相似性高达99.4%,位于一个相对独立的分支。
(
):
[1]SHAHAN M S,KNUDSON R L.Aujeszky’s disease(pseudorabies)a review,with notes on two strains of the virus[J].NorthAmVet,1947,28(8):511-521.
[2]KLUPP B G,LOMNICZI B,VISSER N,et al.Mutations affecting the UL21gene contribute to avirulence of pseudorabies virus vaccine strain Bartha[J].Virology,1995,212(2):466-473.
[3]METTENLEITER T C.Aujeszky’s disease(pseudorabies)virus:the virus and molecular pathogenesisstate of the art,June 1999[J].VetRes,2000,31(1):99-115.
[4]童 武,张青占,郑 浩,等.免疫后发病仔猪中伪狂犬病毒的分离和鉴定[J].中国动物传染病学报,2013,21(3):1-7.
TONG W,ZHANG Q Z,ZHENG H,et al.Identification and characterization of a pseudorabies virus isolated from a dead piglet born to vaccinated sow[J].ChineseJournalofAnimalInfectiousDiseases,2013,21(3):1-7.(in Chinese)
[5]吴云飞,朱 玲,徐志文,等.伪狂犬病病毒四川株的分离鉴定及增殖特性[J].中国兽医科学,2013,43(6):557-564.
WU Y F,ZHU L,XU Z W,et al.Identification of pseudorabies virus from pigs in Sichuan Province and its proliferation characterization[J].ChineseVeterinaryScience,2013,43(6):557-564.(in Chinese)
[6]AN T Q,PENG J M,TIAN Z J,et al.Pseudorabies virus variant in Bartha-K61-vaccinated pigs,China,2012[J].EmergInfectDis,2013,19(11):1749-1755.
[7]郝 飞,汤德元,李春燕,等.伪狂犬病病毒Guizhou-DY株的分离鉴定及致病性研究[J].畜牧兽医学报,2013,44(11):1851-1856.
HAO F,TANG D Y,LI C Y,et al.Identification and pathogenicity study of pseudorabies virus Guizhou-DY strain[J].ActaVeterinariaetZootechnicaSinica,2013,44(11):1851-1856.(in Chinese)
[8]赵鸿远,彭金美,安同庆,等.猪伪狂犬病病毒变异株的分离鉴定及其gE基因的分子特征[J].中国预防兽医学报,2014,36(7):506-509.
ZHAO H Y,PENG J M,AN T Q,et al.Identification of glycoprotein E characteristic in pseudorabies virus variants from swine[J].ChineseJournalofPreventiveVeterinaryMedicine,2014,36(7):506-509.(in Chinese)
[9]彭金美,王 瑜,田志军,等.带BAC质粒的重组伪狂犬病毒的构建及其体外生长特性研究[J].中国预防兽医学报,2009,31(1):10-15.
PENG J M,WANG Y,TIAN Z J,et al.Construction of a recombinant pseudorabies virus with BAC plasmid insertion in the Tkgene[J].ChineseJournalof PreventiveVeterinaryMedicine,2009,31(1):10-15.(in Chinese)
[10]钟 承,张乐天,王巨实,等.犬源伪狂犬病毒BJ/RD株的分离鉴定及gE基因分析[J].中国动物传染病学报,2013,21(5):1-6.
ZHONG C,ZHANG L T,WANG J S,et al.Isolation and Identification of canine pseudorabies virus BJ/RD strain and sequence analysis of itsgEgene[J].ChineseJournalofAnimalInfectiousDiseases,2013,21(5):1-6.(in Chinese)

