榅桲叶多糖含量测定和纯化工艺研究
美合日阿依·伊萨克,艾尼瓦尔·吾买尔(新疆医科大学基础医学院,乌鲁木齐830011)
榅桲叶多糖含量测定和纯化工艺研究
美合日阿依·伊萨克,艾尼瓦尔·吾买尔
(新疆医科大学基础医学院,乌鲁木齐830011)
目的测定榅桲叶中多糖的含量及其精制工艺研究。方法采用蒽酮-硫酸法测定榅桲叶中多糖的含量,比较6种大孔吸附树脂对榅桲叶多糖的吸附率、解吸率和脱色率的影响,从中筛选出适合榅桲叶多糖分离纯化的树脂。结果经静态吸附和解吸实验,初步确定HPD-100型大孔吸附树脂为纯化榅桲叶中多糖的适宜树脂,其吸附、解吸和脱色效果最好,结果分别为56.2%、76.6%、63.0%,纯化后榅桲叶中多糖含量为63.0%。结论优选的纯化工艺简单可行、稳定。
榅桲叶;多糖;含量测定;纯化
榅桲英文名quince,拉丁文名:Cydonia oblonga Mill(COM),异名:C.vulgaris Pers。科属:蔷薇科榅桲属,别名:木梨,新疆维吾尔族人称榅桲为“比也”,当地汉族人称此为木瓜。榅桲属仅榅桲一种,是古老珍奇稀少的果树之一[1]。榅桲自古以来,不仅是新疆人民喜欢的水果,也是维吾尔医药常用的疗效很好的一种药物,其除了具有降血压、降血脂等作用外,还有补血、补脑、补肾、止咳、止泻、利尿、开胃、月经不调、心脏病等功效,特别是止咳、止泻、调月经作用甚佳[2-4]。
目前,有关榅桲叶中多糖的含量测定和纯化工艺的研究尚未见报道,造成了资源的极大浪费。本研究通过蒽酮-硫酸法测定关榅桲叶中多糖的含量,采用大孔树脂纯化,为榅桲叶资源的合理开发利用提供实验依据。
1 仪器和材料
岛津UV-2550紫外分光光度计(日本岛津公司),DK-S24型电热恒温水浴锅(上海精宏试验设备有限公司),赛多利斯BS型电子天平(德国Sartorius公司),TDL-5A型离心机(上海非恰尔分析仪器有限公司),SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司),DHG-9075A型电热鼓风干燥箱(上海一恒科学仪器有限公司)。
葡萄糖(天津市天新精细化工开发中心),蒽酮(国药集团化学试剂有限公司),浓硫酸(天津市风船化学试剂科技有限公司,20121218),试剂均为分析纯,大孔树脂AB-8(天津市光复精细化工研究所,20130311),S-8(天津市光复精细化工研究所),HPD-100(沧州宝恩吸附材料科技有限公司),HPD-400(沧州宝恩吸附材料科技有限公司);聚酰胺14-30(浙江省台州市路桥四甲生化塑料厂,20091017),聚酰胺30-60(浙江省台州市路桥四甲生化塑料厂,20120312)。
2 方法与结果
2.1 榅桲叶中多糖的提取分离称取榅桲叶,加一定量的95%乙醇超声提取,抽虑,挥干至无醇味。加20倍的蒸馏水在80℃下、超声提取60 min,提取2次,合并提取液浓缩,离心后用sevag法脱蛋白,加入95%乙醇使含醇量达80%醇沉,静置过夜,沉淀用丙酮和乙醚依次洗涤,干燥即得榅桲叶粗多糖[5]。
2.2 榅桲叶中多糖的含量测定
2.2.1 对照品溶液的配制精密称取105℃干燥至恒重的葡萄糖对照品10 mg,置100 mL容量瓶中,加蒸馏水溶解稀释至刻度,摇匀,即得0.1 mg/mL葡萄糖对照品溶液。
2.2.2 供试品溶液的配制精密称取提取的粗多糖10 mg,置25 mL量瓶中,加蒸馏水溶解并稀释至刻度。
2.2.3 蒽酮-硫酸试剂的配制精密称取蒽酮50mg,置50 mL棕色容量瓶中,用95%~98%浓硫酸溶解并定容至刻度,摇匀,即得。临用现配。
2.2.4 标准曲线的绘制[6-9]分别精密吸取对照品溶液0.2、0.4、0.6、0.8、1.0、1.2 mL于试管中加蒸馏水至2.0 mL,精密加入蒽酮-硫酸试剂6 mL,置沸水浴中保温15min,取出。立即放入冰水浴中冷却15 min,取出。以相应试剂为空白,在625 nm波长处测定吸光度。以吸光度为纵坐标,葡萄糖浓度为横坐标,绘制标准曲线。得到的标准曲线方程为:Y= 50.069 0X-0.016 3,r=0.999 1;线性范围:0.002 5~0.150 0 mg/mL。
2.2.5 样品含量测定精密量取0.2 mL供试品溶液,加入具塞试管中,置冰水浴中,再精密加入蒽酮-硫酸试剂6mL,然后在沸水浴中保温15 min,取出,立即放入冰水浴中冷却15 min,取出,在625 nm波长处测定吸光度,再算含量结果,叶粗多糖含量为39.6%。
2.2.6 精密度考察精密吸取供试品溶液0.2 mL于5个10 mL容量瓶中,余下操作按“2.2.4”项下方法进行,计算RSD结果,RSD=1.2%,说明仪器精密度良好。
2.2.7 重复性考察精密称取5份同一批粗多糖10mg置25 mL容量瓶中,加蒸馏水溶解并稀释至刻度。分别精密吸取供试品溶液0.2 mL于10 m L容量瓶中,余下操作按“2.2.4”项下方法进行,计算RSD,结果RSD=1.5%,表明该方法重复性良好。
2.2.8 稳定性考察精密吸取供试品溶液0.2 mL于10 mL容量瓶中,余下操作按绘制标准曲线项下方法进行测定,分别于0、10、20、30、60、90 min测定光度,计算RSD,结果RSD=1.9%,表明供试品溶液显色后90min内稳定。
2.2.9 加样回收率试验精密吸取供试品溶液0.2 mL共6份,各精密加入0.1 mg/m L对照品溶液0.2 mL,余下操作按“2.2.4”项下方法进行,测定光度,计算加样回收率为100.5%。
2.3 榅桲叶中多糖的纯化
2.3.1 大孔吸附树脂预处理精密称取6种[酰胺(14-30)、聚酰胺(30-60)、AB-8、S-8、HPD-100、HPD-400]孔树脂各5 g,用95%乙醇溶液侵泡24 h,滤出树脂,用去离子水洗净至无醇味,然后分别用4% HCI溶液浸泡4 h,蒸馏水洗至中性,用4%NaOH溶液浸泡4 h,最后用去离子水洗至中性待用[10]。
2.3.2 静态吸附和解吸实验[11-12]根据榅桲叶中多糖的吸附率、解吸率和脱色率来选择合适的树脂纯化多糖。分别称取经预处理的6种干大孔吸附树脂各1 g置100mL锥形瓶中,加50mL 1.0mg/mL榅桲叶子粗多糖溶液,每隔10 min振摇1次,连续5次后静置24 h。滤出树脂,从滤液中精密吸取0.2 mL于试管中,加蒸馏水至2.0 mL,密加入蒽酮-硫酸试剂6mL,置沸水浴中保温15 min,取出,立即放入冰水浴中冷却15 min,取出,以相应试剂为空白,在625 nm波长处测定吸光度。测定上清液剩余多糖浓度及色素含量。根据公式计算树脂的吸附率:吸附率(%)=(C0-Ce)/C0×100%[公式中:C0为吸附前溶液浓度(mg/mL);Ce为吸附平衡后溶液浓度(mg/mL)]。
将吸附多糖后的树脂进行解吸,用滤纸吸干吸附后的树脂表面残留溶液后,装入干燥的锥形瓶中,加蒸馏水,每隔10 min振摇1次,连续5次后静置24 h解吸,滤出树脂,测定滤液中多糖含量。按下公式计算解吸率:解吸率=C1/(C0-Ce)×100%[C1为解吸液浓度(mg/mL)];根据吸附前后测定吸光度,按下公式计算脱色率:脱色率=A1-A2/A1× 100%[式中:A1为脱色前吸光度;A2为脱色后吸光度]。
通过以上结果筛选出符合试验条件的树脂类型用于后续试验,HPD-100非极性树脂对多糖吸附和解吸能力较强,对色素吸附能力较强,结果分别为: 56.2%、76.6%和63.0%。因此,综合考虑吸附率、解吸率及脱色率,初步筛选出HPD-100进行下一步试验。纯化后榅桲叶中多糖含量为63%,结果见表1。
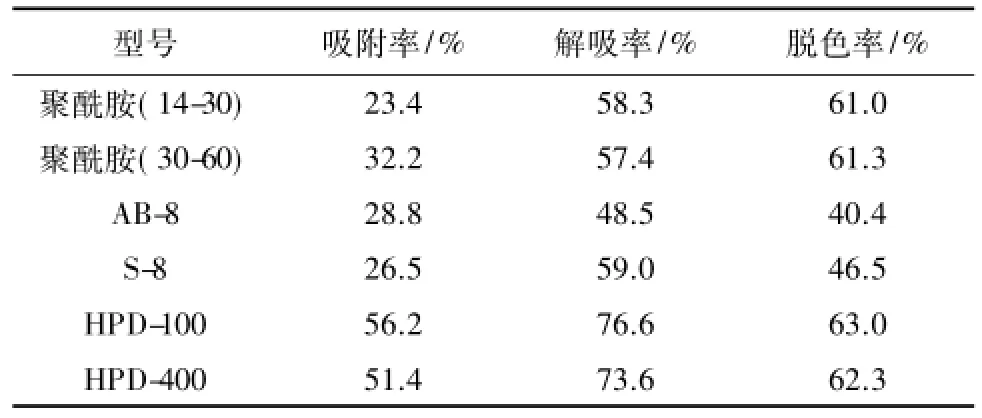
表1 各种树脂吸附率、解吸率和脱色率结果
3 结论
蒽酮-硫酸法是测定多糖含量较为经典有效的方法之一,但影响该法显色的因素较多。为了减少试验过程中的误差,蒽酮-硫酸试剂必须现配现用。大孔径树脂色谱是吸附原理和分子筛原理相结合的新的色谱方法,有利于有效成分高度富集、杂质少、缩小剂量。通过本实验,最终选择了HPD-100为榅桲叶多糖分离纯化的最佳吸附树脂。HPD-100型大孔吸附树脂可以使榅桲叶多糖含量达到63%。
[1]陆承志.果树品种-榅桲[J].新疆农垦科技,2005,35(5):40-42.
[2]马木提·库尔班.新疆榲桲中总生物碱的测定[J].食品科学,2005,26(2):186-189.
[3]古丽娜尔.榲桲黄色素的提取及性质研究[J].新疆师范大学学报:自然科学版,2005,24(2):59-63.
[4]新疆维吾尔自治区卫生厅.维吾尔药材标准(上册)[M].乌鲁木齐:新疆科技卫生出版社,1991:183.
[5]张国强.杨正平.百合多糖提取及成分分析[J].湖北农业科学,2012,51(15):3298-3299.
[6]Yi JP,Bi YJ,Song XR,et al.Investigation on anthrone-H2S04 methodology of determination of polysaccharides in lycium barbarum[J].Journal of Peking University,2005,31:641-646.
[7]吴亚军,朱颖,夏少秋,等.蒽酮-硫酸法测定六味地黄生物制剂中多糖含量的研究[J].时珍国医国药,2011,22(1):39-41.
[8]惠秋沙.枸杞补肾粥方中多糖的含量测定[J].医学信息,2011,24(8):5320.
[9]吴梅,谭睿.黄芪多糖研究进展[J].川北医学院学报,2013,28 (1):17-22.
[10]朱建飞,陈玉玲,唐春红.大孔吸附树脂纯化紫苏粕多糖水提液的研究[J].中国油脂,2012,37(6):63-66.
[11]Zhao J,Guan B,Zou WM,etal.Purification of total polysaccharide from traditional Chinese medicine mulberry leaves[J].J Chin Med Mater,2007,30(11):47-49.
[12]钟运翠,杨宏志,阎福林,等.大孔树脂纯化沙棘果渣多糖的研究[J].食品工业科技,2009,10(30):230-236.
Content determ ination and purification of polysaccharide in leaves of Cydonia oblonga Mill
Isak Mihray,Umar Anwar
(College of Basic Medical,Xinjiang Medical University,Urumqi830011,China)
Objective Determination of the contentof polysaccharide in Cydonia oblonga Mill leaves and its refining process.Methods By anthrone sulfuric acid method was used to determine the content of polysaccharide in leaves of Cydonia oblonga Mill,comparing the six kinds ofmacroporous adsorption resin of quince leaf polysaccharide adsorption rate,desorption rate and decolorization rate influence,from screened for quince leaf polysaccharide,isolation and purification of resin.Results By static adsorption and desorption experiments,initially identified HPD-100macroporous adsorption resin for the purification of quince leaf polysaccharide is suitable for resin,the adsorption,desorption and decolorization effectbest.The results were 56.2%,76.6%,63.0%,purified in leaves of Cydonia oblonga Mill polysaccharide contentwas 63.0%.Conclusion The optimized purification process is simple and feasible and stable.
Cydonia oblonga Mill,s leaf;polysaccharides;content determination;purification
R917
A
1009-5551(2015)06-0715-03
10.3969/j.issn.1009-5551.2015.06.013
2014-06-20]
(本文编辑施洋)
国家自然科学基金(81260490)
美合日阿依·伊萨克(1988-),女(维吾尔族),在读硕士,研究方向:心血管药理学研究。
艾尼瓦尔·吾买尔(1962-),男(维吾尔族),教授,博士生导师,研究方向:心血管药理学研究,E-mail:anwar.umar@126.com。

