HPV-16 E6、E7基因慢病毒真核表达载体的构建及鉴定
方芳,胡尔西旦·尼牙孜,武贵臻,阿布力孜·阿布杜拉,盛磊(新疆医科大学第一附属医院妇科,第一附属医院肿瘤中心,乌鲁木齐80054;新疆地方病分子生物学重点实验室,乌鲁木齐800)
HPV-16 E6、E7基因慢病毒真核表达载体的构建及鉴定
方芳1,胡尔西旦·尼牙孜2,武贵臻3,阿布力孜·阿布杜拉3,盛磊3
(新疆医科大学1第一附属医院妇科,2第一附属医院肿瘤中心,乌鲁木齐830054;3新疆地方病分子生物学重点实验室,乌鲁木齐830011)
目的构建人乳头瘤病毒(HPV)E6、E7基因慢病毒真核表达载体。方法以SiHa宫颈癌细胞总RNA为模板,利用RT-PCR技术扩增出E6、E7目的片段;选用病毒载体pLenti6/V5 Directional TOPO Cloning Kit系统构建E6、E7基因慢病毒真核表达载体;分别使用构建好的E6、E7载体转染病毒包装细胞,获得含病毒的上清液,并测定上清液中慢病毒的滴度。结果质粒测序所得序列与人乳头瘤病毒E6、E7基因序列完全吻合,载体构建成功;慢病毒滴度测定结果显示E6样品的慢病毒滴度为1.5×108TU/mL,E7样品的慢病毒滴度为2×108TU/mL,该滴度能够满足后续研究所需。结论HPV-16 E6、E7基因慢病毒真核表达载体构建成功,可以为进一步研究人乳头瘤病毒E6、E7基因致病机理奠定物质基础。
宫颈癌;HPV16;E6、E7基因;慢病毒载体
人乳头瘤病毒(Human Papillomavirus HPV)是一种环状双链DNA病毒,长约8 kb,由72个病毒壳粒包被,稳定性好,广泛分布于自然界中。该病毒具有嗜上皮性,通过微创口侵入皮肤黏膜表层,进而感染基底层细胞。病毒的增殖依赖于上皮细胞的分化,并在鳞状上皮细胞中被复制、转录和翻译。HPV病毒种类达100多种,根据其致病程度与癌症转化能力分为高危型、中危型和低危型等3种类型。HPV-16、HPV-18、HPV-45和HPV-56等属于高危型,在宫颈癌标本中的检出率达80%[1-4]。研究发现高危型HPV编码的E6或E7蛋白可以影响宿主细胞DNA损伤修复、细胞凋亡和细胞周期控制机制,促进细胞增长与繁殖[5-7];单纯E6、E7基因的表达,对肿瘤细胞生长与繁殖的影响不同[8]。因此,本研究通过应用分子克隆技术构建HPV-16 E6、E7基因的慢病毒真核表达载体,为进一步研究HPV-16 E6、E7基因致癌机理奠定基础。
1 材料与方法
1.1 主要试剂pLenti6/V5 Directional TOPO Cloning Kit(Invitrogen),QuickTiterTMLentivirus Titer Kit(Cell BioLabs),青霉素/链霉素(Sigma),Geneticin(Sigma),DMEM培养基(Gibico),FBS (Gibico),反转录试剂盒及Pfu酶PCR试剂盒(Fermentas),高效制备感受态细胞试剂盒(生工生物工程公司),琼脂糖凝胶DNA回收试剂盒及高纯度质粒提取试剂盒(天根生化公司)。实验中使用的SiHa细胞株来自于中国科学院上海生物化学研究所细胞库。
1.2 方法
1.2.1 目的基因的获得使用TRIzol法提取HPV-16阳性SiHa宫颈癌细胞株的总RNA,以其为模板反转录合成cDNA。根据pLenti6/V5 Directional TOPO Cloning Kit试剂盒引物设计要求设计并合成引物(引物序列见表1),以cDNA为模板,使用Pfu酶PCR试剂盒合成目的基因E6、E7片段,并用1%琼脂糖凝胶电泳鉴定。
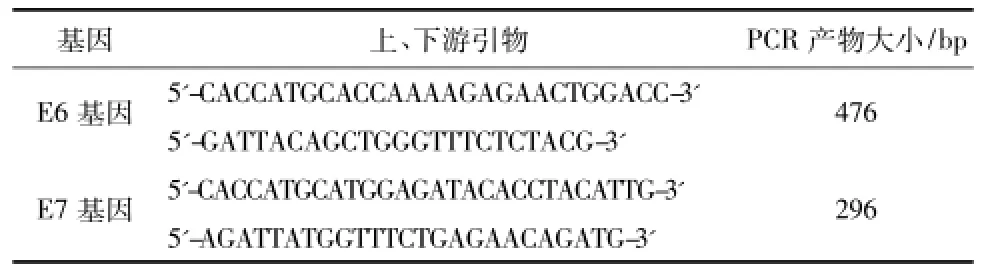
表1 目的基因的引物序列
1.2.2 目的基因的纯化使用琼脂糖凝胶回收纯化法对目的DNA进行纯化(具体操作参照大量琼脂糖凝胶DNA回收试剂盒使用说明书),并利用快速核酸/蛋白分析仪对回收所得DNA浓度进行测定。
1.2.3 感受态大肠杆菌制备使用CaCl2法制备感受态细胞(具体操作参照高效制备感受态细胞试剂盒使用说明书),分装投入液氮速冻后,-70℃保存。
1.2.4 重组DNA的导入将纯化后的PCR产物4μL、Salt Solution 1μL、TOPO vector(蓝色示正常) 1μL混合为TOPO Mix,22℃孵育30 min。将重组质粒导入Stbl3感受态细胞,并使用ampicillin进行抗生素筛选(100μg/mL),从而获得阳性克隆。
1.2.5 E6、E7基因慢病毒载体的获取及鉴定挑取阳性克隆进行扩增,使用高纯度质粒提取试剂盒提取重组质粒,利用快速核酸/蛋白分析仪测量所提取质粒DNA的浓度及纯度。以质粒DNA为模板,PCR扩增E6、E7基因。最后送测序进行鉴定。
1.2.6 慢病毒的包装和获取使用含10%FBS、1%青霉素/链霉素和500μg/mL Geneticin的DMEM(高糖)完全培养基常规培养293FT细胞。分别使用构建好的pLenti6/V5-E6和pLenti6/V5-E7联合病毒包装质粒共同转染293FT细胞。转染48 h后收集含病毒的上清液,4℃、3 000 r/min离心15 min,并使用0.22μm滤膜进行滤过除菌,最终将无菌的含病毒上清-80℃冻存。
1.2.7 慢病毒滴度测定使用QuickTiterTMLentivirus Titer Kit试剂盒,利用ELISA原理检测慢病毒p24核心蛋白(具体操作步骤参照试剂盒说明书)。根据倍比稀释p24蛋白标准品的浓度及其在450 nm处的OD值绘制标准曲线,分别计算出待测样品E6及E7中p24蛋白浓度,由于每个慢病毒颗粒(Lentiviral particle,LP)约含2 000分子p24蛋白,1ng p24蛋白相当于1.25×107LPs,1 TU LP约为1 000个LPs,因此80 ng/m L p24蛋白相当于106TU/ mL慢病毒。具体计算公式:病毒滴度=p24蛋白浓度÷80 ng/mL×106TU/m L×稀释倍数。
2 结果
2.1 目的基因的获得及纯化用特异性引物对E6、E7基因进行PCR扩增,将PCR产物用1%琼脂糖凝胶电泳鉴定,在476 bp处和296 bp处分别可见2条明亮的条带,即通过PCR已获得了目的基因(图1)。将E6、E7基因PCR产物经过琼脂糖凝胶纯化回收后,使用快速核酸/蛋白分析仪测量的结果分别为:E6基因0.023μg/μL,260/280为1.798;E7基因0.023μg/μL,260/280为1.801。

图1 E6、E7基因PCR产物
2.3 目的基因的连接及重组DNA的导入将含有重组DNA的大肠杆菌接种在固体培养基上过夜培养后,可见数目不等的白色菌落,选取菌落密度合适的培养平板挑取单克隆进行扩增。
2.4 pLenti6/V5-E6载体的鉴定使用快速核酸/蛋白分析仪测得的pLenti6/V5-E6质粒DNA浓度为0.746μg/μL,260/280 1.802。以质粒DNA为模板PCR扩增E6基因,将PCR产物进行琼脂糖凝胶电泳鉴定,目的条带较清晰。对质粒DNA进行测序发现所连接的片段序列分别与E6基因序列完全一致(图2)。
2.5 pLenti6/V5-E7载体的鉴定使用快速核酸/蛋白分析仪测得的pLenti6/V5-E7质粒DNA浓度为0.757μL,260/280 1.778。以质粒DNA为模板PCR扩增E7基因,将PCR产物进行琼脂糖凝胶电泳鉴定,目的条带较清晰。对质粒DNA进行测序发现所连接的片段序列分别与E7基因序列完全一致(图3)。
2.6 慢病毒滴度测定测得样品E6中p24蛋白浓度为61 ng/ml,E7中p24蛋白浓度为83 ng/mL。根据公式计算,E6样品的慢病毒滴度为1.5×108TU/ mL;E7样品的慢病毒滴度为2×108TU/m L,该滴度能够满足后续研究所需。
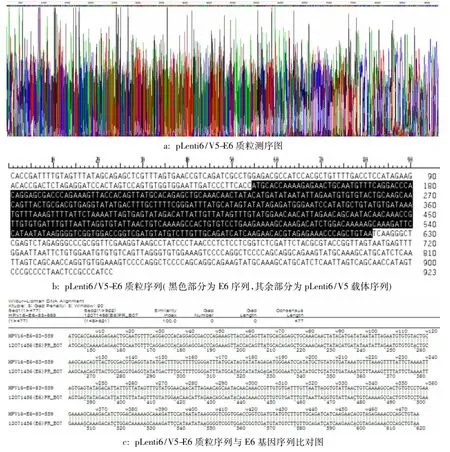
图2 pLenti6/V5-E6质粒的鉴定
3 讨论
宫颈癌是女性最常见的生殖系统恶性肿瘤,严重威胁着妇女的健康,其发病率仅次于乳腺癌[9],在全球女性恶性肿瘤中位居第2位。我国宫颈癌发病率高,每年有近15万新发病例[10]。新疆维吾尔族妇女宫颈癌属新疆特高发肿瘤,其发病率及死亡率均居全国第1位[11]。人乳头瘤病毒(HPV)被公认为宫颈癌发生的首要因素,其中又以高危型HPV-16感染与宫颈鳞癌关系最为密切。以往的研究显示,HPV与TK1、SPP1、HLA-I、Smad4、Runx3、CALCA等宫颈癌相关的生物标记物的表达变化有着密切的关系[12-16]。随着近些年来人们对HPV不断地研究,已初步揭示了HPV致癌的分子机制,其中E6、E7蛋白被认为是HPV致癌的关键分子[18]。HPV基整合入宿主细胞基因组后,病毒E6、E7基因与细胞基因之间的复杂联系有待于进一步的研究。因此,成功构建HPV-16 E6、E7基因的真核表达载体,使之成为细胞水平研究HPV-16 E6、E7基因致癌机制的工具,对全面而深入地揭示HPV-16 E6、E7基因在宫颈癌发生、发展中的作用具有极其重要意义。
慢病毒载体是指以人类免疫缺陷病毒-1(HIV-1)为来源的一种病毒载体,它包含了包装、转染、稳定整合所需要的遗传信息,可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞。对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因的转导效率,且目的基因整合到宿主细胞基因组的概率大大增加,能够比较方便快捷地实现目的基因的长期、稳定表达。
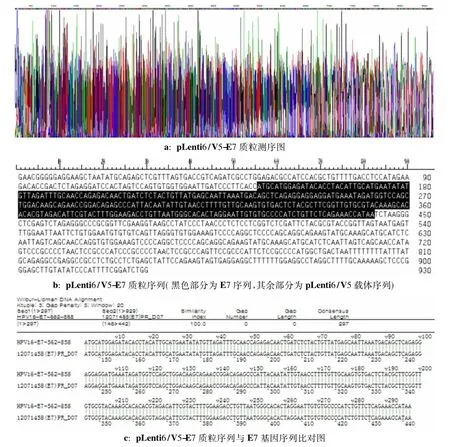
图3 pLenti6/V5-E7质粒的鉴定
在载体构建过程当中,目的基因与质粒载体的连接是一个非常关键的步骤,其直接影响着载体的转化效率。本实验采用特殊的聚合酶链反应特异引物连接法,而不使用酶切,设计引物时在上游引物的5’末端添加序列CACC,这4个碱基可与克隆载体的突出末端GTGG配对结合(对立的末端不匹配),从而使得由PCR获得的目的基因片段可被定向地连接到该载体上,连接率可达到90%以上。
本研究针对HPV-16 E6、E7致癌基因,以HPV-16阳性SiHa宫颈癌细胞株总RNA为模板,利用RT-PCR技术扩增出E6、E7目的基因,选择pLenti6/V5慢病毒载体并利用定向TOPO克隆技术将目的基因正确地连接在该载体上,然后将重组DNA导入感受态细胞293FT,通过抗生素筛选出阳性克隆,继续培养,从而获得大量阳性克隆。最终通过测序的方法对所构建的HPV-16 E6、E7基因表达载体进行鉴定。测序结果显示,与Genebank中HPV-16 E6、E7基因原序列相比,载体中的插入序列与之完全相同,说明载体构建成功。使用慢病毒p24核心蛋测定法测定慢病毒滴度,结果显示E6、E7病毒上清液中慢病毒的滴度均能满足后续研究所需。
综上所述,以HPV-16 E6、E7基因为对象,利用分子克隆技术成功构建了HPV-16 E6、E7基因的慢病毒真核表达载体,转染病毒包装细胞后获取含病毒的上清,为进一步研究HPV-16 E6、E7蛋白作用及致癌机制奠定物质基础,对促进新疆维吾尔族妇女宫颈癌疾病的研究有着积极的作用。
[1]Monsonego J.HPV infections and cervical cancer prevention.Priorities and new directions[J].Gynecol Oncol,2005,96(3): 830-839.
[2]Wiley D,Masongsong E.Human papillomavirus:the burden of infection[J].Obstet Gynecol Surv,2006,61(6 Suppl 1):S3-14.
[3]Munoz N,Bosch FX,de SanjoséS,et al.Epidemiologic classification of human papillomavirus types associated with cervical cancer[J].N Engl JMed,2003,348(6):518-527.
[4]拉莱·苏祖克,彭玉华,周康,等.新疆不同民族宫颈癌发病趋势分析[J].新疆医科大学学报,2006,29(7):569-571.
[5]Jones EE,Wells SI.Cervical cancer and human papillomaviruses: inactivation of retinoblastoma and other tumor suppressor pathways[J].Curr Mol Med,2006,6(7):795-808.
[6]Ferenczy A,Franco E.Persistent human papillomavirus infection and cervical neoplasia[J].Lancet Oncol,2002,3(1):11-16.
[7]Yamato K,Fen J,KobuchiH,etal.Induction of cell death in human papillomavirus 18-positive cervical cancer cells by E6 siRNA[J].Cancer Gene Ther,2006,13(3):234-41.
[8]DeFilippis RA,Goodwin EC,Wu L,et al.Endogenous human papillomavirus E6 and E7 proteins differentially regulate proliferation,senescence,and apoptosis in HeLa cervical carcinoma cells[J].JVirol.2003,77(2):1551-1563.
[9]Thierry F,Benotmane MA,Demeret C,et al.A genomic approach reveals a novel mitotic pathway in pap illomavirus carcinogenesis[J].Cancer Res,2004,64(3):895-903.
[10]孙宝胜,左雅芳,田琦,等.宫颈癌腔内治疗下评估靶区和危及器官的剂量与体积[J].中华放射医学与防护杂志,2013,33 (1):66-67.
[11]尹燕娜,艾星子·艾里,丁岩.新疆维吾尔族宫颈癌发病特征及进展[J].现代妇产科进展,2012,21(5):404-405.
[12]阿娜古丽·阿巴白克力,哈尼克孜·吐尔逊,阿布力孜·阿布杜拉,等.维吾尔族妇女宫颈癌及HPV感染与多种基因表达上调的关系[J].科技导报,2012,30(19):50-54.
[13]阿仙姑·哈斯木,李巧稚,马俊旗,等.维吾尔族患者宫颈病变中内质网分子伴侣和HLA-Ⅰ类分子表达与HPV16感染的关系研究[J].实用妇产科杂志,2011,27(2):102-105.
[14]李巧稚,阿提开姆·阿布都克热木,王燕,等.子宫颈癌中Smad4和Runx3表达与HPV16感染的关系[J].临床与实验病理学杂志,2012,28(10):1112-1115.
[15]盛磊,阿仙姑·哈斯木,刘开江,等.维吾尔族妇女宫颈病变病理进程与降钙素相关肽α表达的关系[J].癌变.畸变.突变,2011,23(4):287-290.
[16]盛磊,马丽,希尔扎提江·苏来曼,等.宫颈癌中CALCA基因甲基化与HPV16-E7致癌蛋白表达的依存关系[J].科技导报,2014,32(10):63-67.
[17]卞继峰,孔北华.人乳头瘤病毒感染的致癌机制[J].实用妇产科杂志,2004,20(2):66-67.
Construction and identification of eukaryotic vector of HPV-16 E6,E7 genes
FANG Fang1,Huerxidan Niyazi2,WU Guizhen3,Abulizi Abudula3,SHENG Lei3
(1Department of Gynaecology,The First Afiliated Hospital,2Department of Tumor Center,The First Afiliated Hospital,Urumqi830054,China;3Xinjiang Key Laboratory of Molecular Biology and Endemic Diseases,Xinjiang Medical University,Urumqi830011,China)
Objective To construct the eukaryotic expression vector for human papillomavirus(HPV)E6 and E7 genes.Methods We amplified the full-length HPV-16 E6 and E7 genes from the total RNA of the SiHa cell line by RT-PCR technique and sub-cloned the gene into pLenti6/V5 vector,which was identified and confirmed by DNA sequencing.The construction of E6 and E7 transfected viruses was used to package cells.Then we harvested viral supematantand determined the titer.Resu lts The plasmid sequencingwas completely consistentwith E6,E7 gene sequence,which showed that the vector was successfully constructed.The titer of E6 was 1.5×108TU/m L,and 2×108TU/m L of E7,satisfying the requirements of the subsequent researches.Conclusion The successful construction of HPV-16 E6 and E7 gene eukaryotic expression vector could lay thematerial foundation for furthering study of the pathogenesis of HPV E6 and E7 genes.
ervical cancer;HPV-16;E6,E7 genes;Lentivirus vector
R737.33
A
1009-5551(2015)06-0734-05
10.3969/j.issn.1009-5551.2015.06.018
2014-11-03]
(本文编辑杨晨晨)
新疆维吾尔自治区重点实验室开放课题基金(XJDX0208-2012-03);新疆医科大学科研创新基金(XJC201310)
方芳(1982-),女,在读硕士,研究方向:妇科肿瘤。
盛磊,女,实验师,研究方向:宫颈癌的发病机制与早期预警,E-mail:shenglei950505@163.com。

