溶血致新生大鼠高胆红素血症动物模型的建立及评价
杨李,王宝田,田克印,吴德,唐久来
(安徽医科大学第一附属医院儿科,合肥 230022)
新生儿高胆红素血症是新生儿时期最为常见的疾病,胆红素具有神经毒性,轻度升高,即可导致患儿神经系统损伤,达到一定浓度时,可发生核黄疸,导致听觉障碍、脑性瘫痪,智力低下等严重后遗症[1]。目前高胆红素动物模型常见的有静脉注射胆红素溶液、或利用基因缺陷动物模型Gunn鼠建立高胆红素血症模型,或利用磺胺类药物促使脑组织胆红素浓度升高[2-3];然而,上述模型并非溶血导致黄疸,结合新生儿高胆红素血症发病机制,并没有良好的模拟作用,本研究通过腹腔梯度注射盐酸苯肼,建立溶血致高胆红素血症模型,并测定血、脑组织胆红素、NSE等水平,对模型进行评价。
1 材料和方法
1.1 实验动物
选择7日龄清洁级SD大鼠60只,体重19~22 g,其中雄性28只,雌性32只,由安徽省实验动物中心【SCXK(皖)2011-002】提供。
1.2 材料
盐酸苯肼 (phenylhydrazine hydrochloride)(阿拉丁公司,中国)。盐酸苯肼溶液配制[4]:避光称取盐酸苯肼0.5 g,溶于50 mL灭菌注射用生理盐水中,配制成1%的盐酸苯肼溶液;盐酸苯肼0.75 g,溶于50 mL灭菌注射用生理盐水中,配制成1.5%的盐酸苯肼溶液;盐酸苯肼0.25 g,溶于50 mL灭菌注射用生理盐水中,配制成0.5%的盐酸苯肼溶液。为保证在不同注射剂量下,注射总液体量相同,以上试剂均用0.22 μm过滤头过滤除菌。
1.3 动物模型的分组及建立
随机分为4组,每组15只,分别以25、50、75 mg/kg三种浓度腹腔注射盐酸苯肼,作为实验1、2、3组;对照组按体重注射等量灭菌注射生理盐水,均连续两天同一时间进行注射。按实验动物使用的3R原则给予人道关怀。
1.3 实验方法及评价
建模48 h后实验组和对照组动物均安乐死,取颈内静脉和颈总动脉约0.5~0.75 mL血;Roche COBAS INTEGRA 800全自动生化分析仪测定血清总胆红素和NSE水平,Abbott Cell-Dyn 3200血细胞分析测定全血血红蛋白水平;同时机械剥离实验动物脑组织,称重后10倍体积冰醋酸制成均浆等体积,丙酮抽提,同样采用生化仪测定脑组织胆红素浓度。
1.4 统计学处理方法
2 结果
2.1 动物模型一般情况观察
实验组2和实验组3,在建立模型后陆续出现皮肤灰暗、呼吸急促、活动减少、摄食次数减少和尿色变深的情况,其中实验组2中的1只动物、实验组3中的2只动物在实验过程中死亡,但至取材尚未出现自发性出血现象;实验1组出现活动、摄食减少,尿色轻度变深,皮肤灰暗现象较实验2、3组轻。腹腔注射生理盐水对照组尚未出现上述情况,且无死亡情况发生。
2.2 血和脑组织胆红素及血红蛋白水平测定
与空白对照组相比,腹腔注射盐酸苯肼的3个不同剂量的实验组血清总胆红素、脑组织的胆红素水平显著升高(P<0.05),实验组2和实验组3的胆红素水平均大于实验组1(P<0.05),而实验组2和实验组3之间差异无显著性(P>0.05);3个实验组的血红蛋白水平均低于对照组(P<0.05);实验组2和实验组3血红蛋白水平均小于实验组1(P<0.05),实验组2和实验组3相比差异无显著性(P>0.05)。见表1。
2.3 血清神经特异性烯醇化酶
与空白对照组相比,腹腔注射盐酸苯肼的3个不同剂量的实验组血清神经特异性烯醇化酶(NSE)显著升高(P<0.05),实验组2和实验组3的NSE水平均大于实验组1(P<0.05),而实验组2和实验组3之间差异无显著性(P>0.05)。见表2。
表1 血和脑组织胆红素水平和血红蛋白测定()Tab.1 Measurement of brain tissue and blood bilirubin,and hemoglobin concentrations
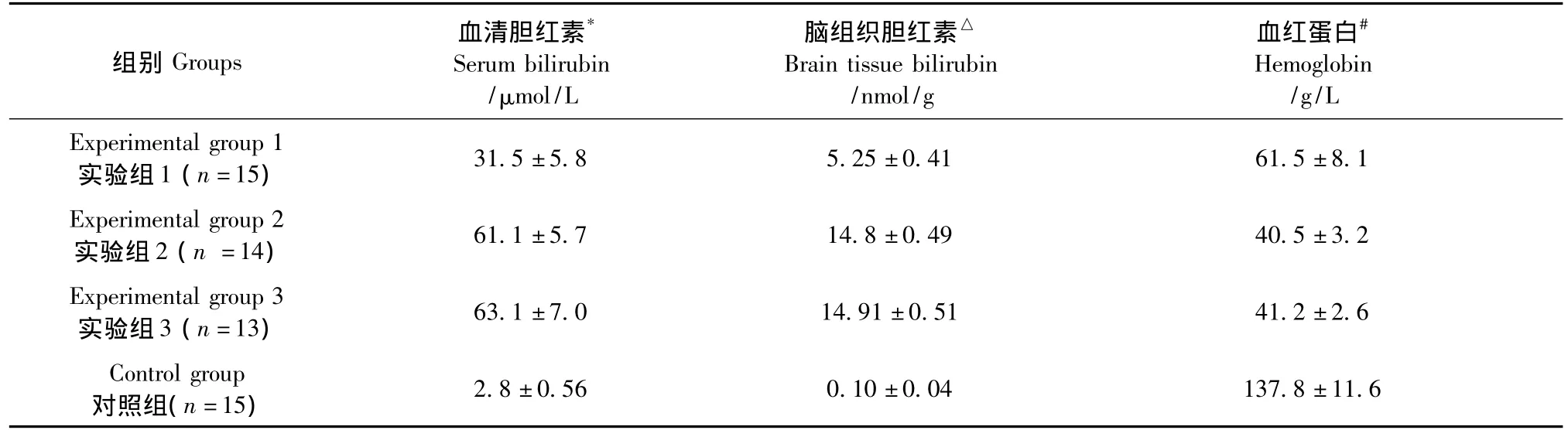
表1 血和脑组织胆红素水平和血红蛋白测定()Tab.1 Measurement of brain tissue and blood bilirubin,and hemoglobin concentrations
注:*△#:三组实验组和对照组相比差异具有显著性(P<0.05),实验1组和实验2、3组相比差异具有显著性(P<0.05),实验2、3组间差异无显著性(P>0.05)。Note.*△#:There was a significant difference between the three experimental groups and the control group(P <0.05).There was a significant difference between experimental group 1 and experimental groups 2 and 3(P<0.05).There was no significant difference between experimental groups 1and 2(P>0.05).
脑组织胆红素△Brain tissue bilirubin/nmol/g组别Groups血清胆红素*Serum bilirubin/μmol/L 2.8±0.56 0.10±0.04 137.8±11.6血红蛋白#Hemoglobin/g/L Experimental group 1实验组1(n=15) 31.5±5.8 5.25±0.41 61.5±8.1 Experimental group 2实验组2(n=14) 61.1±5.7 14.8±0.49 40.5±3.2 Experimental group 3实验组3(n=13) 63.1±7.0 14.91±0.51 41.2±2.6 Control group对照组(n=15)
表2 血清神经特异性烯醇化酶测定()Tab.2 Measurement of serum NSE
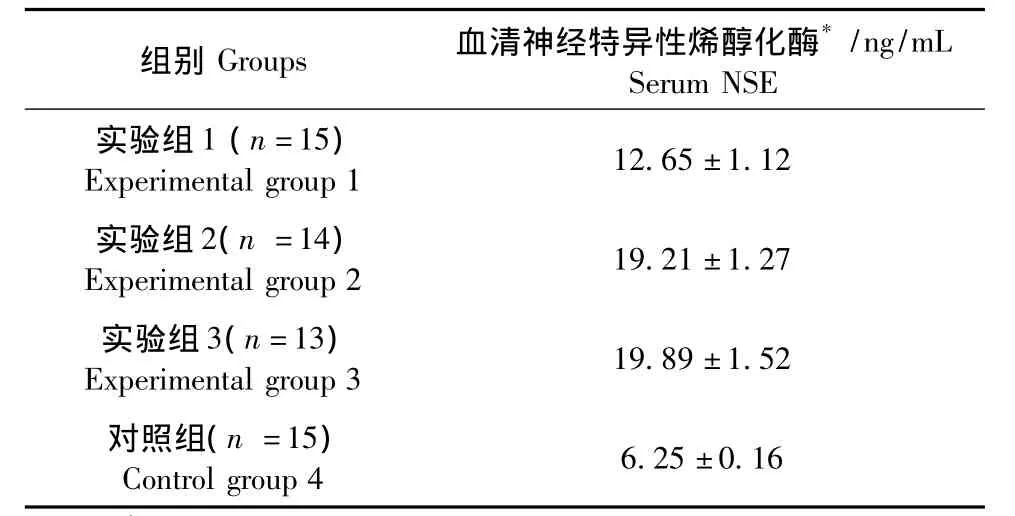
表2 血清神经特异性烯醇化酶测定()Tab.2 Measurement of serum NSE
注*:三组实验组和对照组相比差异具有显著性(P<0.05),实验1组和实验2、3组相比差异具有显著性(P<0.05),实验2、3组相比差异无显著性(P>0.05)。Note. *△#:There was a significant difference between the three experimental groups and control group(P<0.05).There was a significant difference between experimental group 1 and experimental groups 2 and 3(P<0.05).There was no significant difference between experimental groups 1 and 2(P>0.05).
组别Groups 血清神经特异性烯醇化酶*/ng/mL Serum NSE
3 讨论
动物模型应尽可能模拟出疾病的特点及病理生理机制。国内学者采用不同剂量胆红素联合脂多糖颈静脉注7日SD龄大鼠方式建立动物模型,结果显示模型出现不同程度的皮肤黄染,1 h后皮肤黄染均出现减退,提示胆红素在体内存留时间过短,不能模拟高胆红素持续损害的过程[5]。王晓丽等[6]以3日龄 SD新生大鼠为对象,进行连续6次胆红素注射,从而建立相对稳定的高胆红素血症模型,但是静脉置管方法对新生鼠操作难度相对较大。现较多采用的是腹腔注射胆红素建模方法[7],具有操作简便,建模成功率高特点,但存在胆红素腹腔吸收入血浓度不稳定,血清胆红素浓度偏低问题,同静脉注射方法存在共同的缺点是均不能良好的模拟新生儿高胆红素血症是红细胞破坏增加的致病原因。Gunn大鼠多被用于开展对遗传性葡萄糖醛酸转移酶缺陷的模型研究,其血液中胆红素的浓度达不到核黄疸的程度,因此,有研究应用磺胺类药物通过置换结合胆红素方法,加强了胆红素对脑的损害作用[8],或采用腹腔注射盐酸苯肼的方法,诱发溶血来增加胆红素水平浓度[9],但是此类研究动物模型成本较高,且基因缺陷是否造成免疫系统缺陷尚不明确。有报道采用新生大鼠小脑延髓池注射胆红素溶液的方法制作胆红素脑病的动物模型,该方法虽受血脑屏障功能状态的影响较小,可更直接地研究胆红素的神经毒性。但是对新生大鼠小脑延髓池注射本身即对中枢神经系统是一种外伤性损害,操作难度较大,易诱发出血损伤,动物建模成功率较低[10]。
目前采用盐酸苯肼或乙酰苯肼建立的溶血动物模型多是采用成年大鼠或其他成年动物,腹腔注射浓度报道也多不一致,从40 mg/kg到75 mg/kg均有报道[3,11],对7日龄溶血致高胆红素血症的研究国内外较少。本研究采用25、50、75 mg/kg三种梯度的盐酸苯肼腹腔注射7日龄大鼠,结果发现:三实验组均出现溶血,与对照组相比较血、脑组织胆红素水平和NSE均大于对照组,差异具有显著性(P<0.05),而血红蛋白含量均小于对照组,差异具有显著性(P<0.05);其中,50 mg和75 mg剂量组的脑、血胆红素水平均大于25 mg剂量组(P<0.05),50 mg/kg和75 mg/kg剂量腹腔注射组相比各项指标差异无显著性(P>0.05),提示50 mg/kg浓度已达溶血高峰,随着盐酸苯肼的浓度增高并未出现溶血增加;腹腔注射盐酸苯肼诱发溶血,其机制是进入腹腔后吸收入血,能迅速与Hb形成MHb并生成海因兹(Heinz)小体,海因兹小体沉积在细胞膜上,使其流动性下降,渗透性增加,其并可裂解部分细胞膜功能,导致溶血发生,而盐酸苯肼本身并无明显神经毒性,故能较好的模拟新生儿溶血致高胆红素血症病理生理过程,尤其研究对中枢神经系统的损伤研究[12]。
模型鉴定中检测的血清标志物神经特异性烯醇化酶(NSE)和神经细胞的分化和成熟有关,其特异性地存在于神经元和神经内分泌细胞中,脑组织缺氧缺血时神经元细胞可发生变性坏死,同时其血脑屏障通透性增加,NSE可释放到血和脑脊液中,因此NSE可判断神经元损伤的程度和对预后的估计,且具有较高的特异性,可作为模型鉴定的指标之一[13]。本研究中50 mg/kg和75 mg/kg剂量组的脑组织NSE水平均大于对照组及25mg剂量组(P<0.05),50mg和75mg剂量腹腔注射组相比NSE指标差异无显著性(P>0.05),随着盐酸苯肼的浓度增高并未出现脑组织NSE增加,提示NSE与溶血性黄疸致神经系统损伤程度呈正相关,与盐酸苯肼水平无明显相关性。
综上所述,本实验选取7日龄大鼠腹腔内注射盐酸苯肼的方法能够制作出模拟临床病理生理过程的高胆红素血症动物模型,其中50 mg/kg盐酸苯肼是较为合适的建模浓度,从而建立理想的高胆红素动物模型,为开展高胆红素血症致核黄疸及相关神经损伤机制研究提供实验平台。
[1]吴青林.新生儿高胆红素血症神经毒性作用的监测[J].中国医药导报,2012,9(15):56-58.
[2]Thyagarajan B,Deshpande SS.Cotrimoxazole and neonatal kernicterus:a review[J].Drug Chem Toxicol.2014,37(2):121-129.
[3]Wennberg RP.Animal models of bilirubin encephalopathy[J].Adv Vet Sci Comp Med.1993,37:87-111.
[4]Salama A.Drug-induced immune hemolytic anemia[J].Expert Opin Drug Saf.2009,8(1):73-79.
[5]邵天伟.静脉注入胆红素对新生大鼠脾磷酸化TAK1和磷酸化IKK蛋白表达的影响[D].泸州医学院,2012.
[6]王晓丽,郭明星,梁俊晖,等.新生大鼠高胆红素血症及脑病模型的建立与评价[J].中国病理生理杂志[J].2014,30(8):1523-1531.
[7]陈舜年,贲晓明,夏振伟.胆红素脑病动物模型制作与鉴定[J].新生儿科杂志,1997,12:166-169.
[8]Daood MJ,McDonagh AF,Watchko JF.Calculated free bilirubin levels and neurotoxicity[J].J Perinatol,2009,29(Suppl 1):S14-S19.
[9]Rice AC,Shapiro SM.A new animal model of hemolytic hyperbilirubinemia-induced bilirubin encephalopathy(kernicterus)[J].Pediatr Res.2008,64(3):265-269.
[10]Song S,Hu Y,Gu X,et al.A novel newborn rat kernicterus model created by injecting a bilirubin solution into the cisterna magna[J].PLoS ONE.2014,9(5):e96171.
[11]Geiger AS,Rice AC,Shapiro SM.Minocycline blocks acute bilirubin-induced neurological dysfunction in jaundiced Gunn rats[J].Neonatology.2007,92(4):219-226.
[12]Jollow DJ,McMillan DC.Oxidative stress,glucose-6-phosphate dehydrogenase and the red cell[J].Adv Exp Med Biol,2001,500:595-605.
[13]Papa L,Ramia MM,Kelly JM,et al.Systematic review of clinical research on biomarkers for pediatric traumatic brain injury[J].J Neurotrauma,2013,30(5):324 -338.

