α-硫辛酸联合甲钴胺治疗糖尿病周围神经病变疗效观察
高亚萍
α-硫辛酸联合甲钴胺治疗糖尿病周围神经病变疗效观察
高亚萍
糖尿病;周围神经病变;α-硫辛酸
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病常见并发症之一,病变可累及全身神经系统,患病率10%~96%不等[1]。在美国,病程15~20年的糖尿病患者有周围神经病变患病率约30%~50%[1]。研究[2]表明,氧化应激损伤是糖尿病慢性并发症的重要发病原因,α-硫辛酸可抑制氧化应激造成的损伤,是治疗DPN的有效药物。笔者观察α-硫辛酸联合甲钴胺治疗DPN疗效,报道如下。
1 临床资料
选取2010年1月—2013年12月本院内分泌科住院DPN患者60例,均符合中国2型糖尿病防治指南(2010版)的DPN诊断标准[3],其中治疗组30例,男18例,女12例,平均年龄57.2岁,糖尿病平均病程7.8年;对照组30例,男17例,女13例,平均年龄57.1岁,糖尿病平均病程7.6年。两组年龄、性别、病情、病程差异无统计学意义(P>0.05),具有可比性。
2 治疗方法
两组患者均给予糖尿病健康教育、饮食控制、适量运动、口服降糖药物或胰岛素皮下注射控制血糖。对照组予甲钴胺片治疗,每次0.5g,1天3次;治疗组在此基础上给予α-硫辛酸针剂0.6g加入生理盐水250mL,静脉滴注,1天1次。两组疗程均为4周。
观察指标:观察治疗前后密歇根糖尿病神经病变评分(MNDS)[4],肌电图检测正中神经、腓总神经运动神经传导速度(MCV)及感觉神经传导速度(SCV)。
统计学方法:应用SPSS17.0软件进行统计处理,计量资料以均数±标准差(±s) 表示,采用t检验,P<0.05表示差异有统计学意义。
3 结果
3.1 两组MDNS评分比较 与治疗前比较,两组MDNS评分均下降,差异有统计学意义(P<0.05);与对照组比较,治疗后治疗组MDNS评分下降明显,差异有统计学意义(P<0.05),见表1。
表1 两组MDNS评分比较(分,±s)

表1 两组MDNS评分比较(分,±s)
注:与治疗前比较,*P<0.05;与对照组比较,△P<0.05;MNDS:密歇根糖尿病神经病变评分
组别治疗组对照组例数30 30治疗前21.58±4.39 20.71±4.61治疗后11.71±4.40*△16.73±5.18*
3.2 两组神经传导速度比较 两组治疗前神经传导速度比较,差异均无统计学意义(P>0.05);与治疗前比较,治疗组神经传导速度改善明显,优于对照组(P<0.05),见表2。
3.3 不良反应 两组治疗过程中均未出现不良反应。
4 讨论
DPN早期表现为感觉障碍,出现肢体麻木及针刺痛、灼痛、钻凿痛等痛觉过敏症状,晚期可累及运动神经,导致肌张力减低,出现肢体软弱无力、行走困难等[1]。研究[5-6]认为,氧化应激在DPN发生发展中起到非常重要的作用,由于长期高血糖状态导致氧化应激水平升高,通过线粒体氧化磷酸化途径、糖的自身氧化、NADPH氧化酶、脂质过氧化物酶和一氧化氮合酶(NOS)等多种途径,产生过量的活性氧簇(ROS),同时糖尿病患者体内抗氧化系统能力减弱,进而促使糖尿病周围神经病变的发生,该学说的提出为DPN防治和研究提供新的思路。
表2 两组神经传导速度比较(m/s,±s)
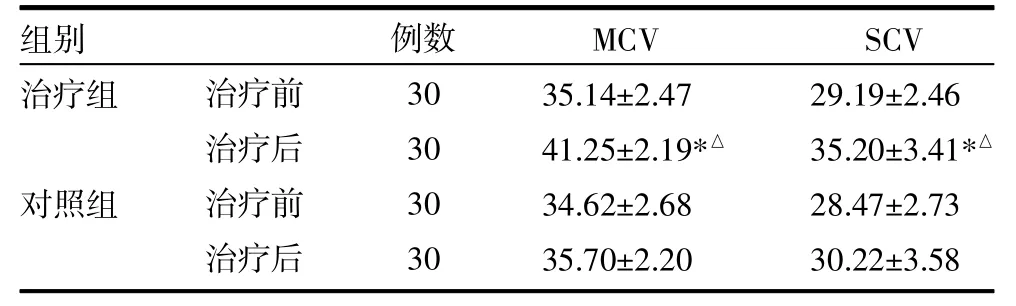
表2 两组神经传导速度比较(m/s,±s)
注:与治疗前比较,*P<0.05;与对照组比较,△P<0.05;MCV:运动神经传导速度;SCV:感觉神经传导速度
治疗组对照组治疗前治疗后治疗前治疗后30 30 30 30 35.14±2.47 41.25±2.19*△34.62±2.68 35.70±2.20 29.19±2.46 35.20±3.41*△28.47±2.73 30.22±3.58
目前治疗DPN的方法较多,主要通过改善代谢异常、抑制醛糖还原酶活性和抗氧化、改善非酶促糖基化、扩张血管、营养神经、补充神经细胞因子及抗炎等治疗[7]。α-硫辛酸属于维生素B类化合物,含氧酸脱氢酶复合物,是一种强抗氧化剂,可抑制氧化应激造成的损伤,具有在细胞内转化为可发挥作用的形式,膜相、水相均具备多种抗氧化作用,且有毒性低及从氧化应激源头抑制的特点。α-硫辛酸能够增加周围神经的血流速度,改善周围神经的营养状态和传导速度等[8],最终起到保护糖尿病患者神经组织的作用。国外研究表明[9-10],α-硫辛酸可以显著改善胰岛素敏感性、脂质代谢及感觉异常、疼痛等症状,有效预防和治疗糖尿病相关并发症的发生和发展。动物实验[11]亦证实,α-硫辛酸可通过调节大鼠胰腺组织的氧化应激状态,改变凋亡相关蛋白的表达水平,显著降低2型糖尿病模型大鼠胰岛细胞的凋亡率,增加机体胰岛素的分泌水平。甲钴胺为辅酶型维生素B12制剂,是治疗DPN的基本药物,对神经组织具有良好的传递性,在促进细胞核酸、蛋白和脂质形成,修复受损神经,加快神经传导速度等方面具有广泛作用[12]。
本临床观察表明,经α-硫辛酸治疗后,DPN患者密歇根糖尿病神经病变评分明显提高(P<0.05),神经传导速度明显改善(P<0.05),优于单药甲钴胺治疗,且未出现明显不良反应。
[1]廖二元.内分泌代谢病学[M].第3版.北京:人民卫生出版社,2012:1375.
[2]Ziegler D,Nowak H,Kempler P,et al.Treatment of symptomatic diabetic neuopathy with antioxidant apha-lipoic acid:a meta-analysis[J].Diabe Med,2004,21(2):114-121.
[3]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2010年版)[J].中华糖尿病杂志,2012,20(1):S1-S37.
[4] Pop-Busui R,Evans GW,Gerstein HC,et al.Effects of cardiac autonomic dysfunction on mortality risk in the action to control cardiovascular risk in diabetes(accord)tria[J].Diabetes Care,2010,33(7):1578-1584.
[5] Brownlee M.Biochemistry and molecular cell biology of diabetic complications[J].Nature,2001,414(6865):813-820.
[6]Du X,Matsumura T,Edelstein D,et al.Inhibition of GAPDH activity by poly(ADP-ribose)polymerase activates three major pathways of hyperglycemic damage in endothelial cells[J].JClin Invest,2003,112(7):1049-1057.
[7]率红莉,汪津洋.糖尿病周围神经病变治疗药物研究进展[J].中国药房,2014,25(4):377-383.
[8]丁莉,陈日秋,陈江.前列地尔联合硫辛酸治疗糖尿病周围神经病变50例[J].医药导报,2012,31(2):162-163.
[9]Udupa A,Nahar P,Shah S et al.A comparative study of effects of omega-3 Fatty acids,alpha lipoic Acid and vitamin e in type 2 diabetesmellitus[J].Ann Med Health Sci Res,2013,3(3):442-446.
[10]Ametov AS,Barinov A,Dyck PJetal.The sensory symptoms of diabetic polyneuropathy are improved with alpha-lipoic acid:the SYDNEY trial[J].Diabetes Care,2003,26(3):770-776.
[11]陶功华,王莉萍,俞筱琦,等.α-硫辛酸对2型糖尿病大鼠氧化应激致胰岛细胞凋亡的影响[J].环境与职业医学,2014,31(4):247-251.
[12]王科文,张亚萍,赵明利.α-硫辛酸联合丹参川芎嗪及甲钴胺治疗糖尿病周围神经病变近期疗效分析[J].山西医科大学学报,2014,45(5):373-376.
(收稿:2014-12-01 修回:2015-01-05)
杭州市余杭区第五人民医院内分泌科(杭州 311100)

