miR-29b的作用靶点及其对Huh7细胞增殖及凋亡的干预作用
徐海和
miR-29b的作用靶点及其对Huh7细胞增殖及凋亡的干预作用
徐海和
目的 探讨miR-29b(microRNA-29b)的作用靶点及其对肝肿瘤细胞系Huh7细胞增殖及凋亡的干预作用。方法 荧光定量PCR检测正常肝细胞系LO2及肝癌细胞系Huh7的miR-29b和Mcl-1表达水平。通过生物信息学分析预测Mcl-1基因是否受microRNA调控。将miR-29b模拟物通过Lipofectamine 2000顺时转染Huh7细胞,检测miR-29b对Mcl-1表达水平的影响。MTT法检测miR-29b模拟物转染对Huh7细胞增殖的影响。Annexin V/PI染色法检测miR-29b对Huh7细胞凋亡的影响。结果 肝肿瘤细胞相比于正常肝细胞高表达Mcl-1(3.42±0.15比1.00±0.04,P<0.05)低表达miR-29b(0.43±0.04比1.00±0.06,P<0.05),在肝癌细胞中转染miR-29b可使Mcl-1的表达水平下降(0.37±0.03比1.03±0.07,P<0.05),转染miR-29b可抑制Huh7细胞的增殖(0.85±0.11比1.68±0.17,P<0.05)并诱导其发生凋亡[(28.4±2.10)%比(3.6±0.06)%,P<0.05]。结论 MiR-29b下调Huh7细胞Mcl-1蛋白的表达并诱导其发生凋亡。
肝肿瘤;Huh7;Mcl-1;细胞增殖;细胞凋亡;miR-29b
MicroRNA(miRNA)是一类高度保守的小RNA,通过与其靶mRNA分子的3'端非编码区(3'-UTR)不完全互补结合,抑制靶基因的蛋白表达[1-2]。miRNA被证实在细胞的各种生理活动中都发挥重要的作用,miRNA表达的失调是细胞癌变的重要特征[3-4]。肝癌是世界上发病率最高的恶性肿瘤之一,预后差,在全球死于癌症及其并发症的统计中,肝癌死亡率居所有恶性肿瘤的第3位[5]。然而,肝癌的发病机制至今仍不十分清楚,一些细胞保护性蛋白的高度表达可能是癌变细胞抵抗程序性死亡并发展为肿瘤细
胞的重要原因[6]。Mcl-1是Bcl-2蛋白家族中的抗凋亡蛋白成员,文献[7-8]报道,Mcl-1高度表达是肿瘤细胞逃避程序性死亡的重要机制,并且也是肿瘤细胞对一些化疗药物耐药的重要机制。文献[9-10]报道,miR-29在多种肿瘤细胞中表达失调,miR-29具有良好的抑制肿瘤生长和转移的生物效应。本研究发现miR-29b靶向于Mcl-1 mRNA的3'-UTR区,转染miR-29b模拟物能抑制肝癌细胞的生长并促进其凋亡。
1 实验材料
1.1 材 料 人肝癌细胞株Huh7和人正常肝细胞系LO2为本院临床检验实验室常规保存,细胞培养在RPIM-1640培养基中,含10%胎牛血清,培养条件为37℃恒温培养并通入5%CO2。
1.2 试 剂 RPIM-1640培养基购自于美国Gibco公司(产品号:11875-093)。miR-29b模拟物及对照RNA购自广州锐博生物有限公司,序列如下:miR-29b模拟物:5′-UAGCACCAUUUGAAAUCAGUGUU-3′;对照RNA:5′-UUCUCCGAACGUGUCACGU-3′。噻唑蓝(MTT,产品号:M2128)、Annexin V-FITC凋亡检测试剂盒(产品号:APOAF)购于美国Sigma-Aldrich。Lipofectamine2000(产品号:11668030)、Trizol(产品号:15596-018)购于美国Invitrogen公司。逆转录试剂盒(产品号:2641A)、SYBR Green(产品号:RR086A)购于日本TaKaRa。逆转录及定量PCR所需引物由上海生工有限公司合成。
2 实验方法
2.1 荧光实时定量PCR检测Huh7细胞及LO2细胞miR-29b和Mcl-1表达水平 总RNA用TRIzol试剂提取,miR-29b采用特异性茎环引物法[11]进行miR-29b的逆转录,miR-29b逆转录引物序列为:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGA GAACACTGA-3′。Mcl-1直接用逆转录试剂盒将总RNA逆转成cDNA,操作步骤照试剂盒说明书进行。逆转录产物用SYBR Green试剂按照说明书进行处理并在 Applied Biosystems 7500 Real Time PCR System上进行 PCR扩增,Mcl-1基因以GAPDH mRNA作为内参,miR-29b以U6 small nuclear RNA(snRNA U6)作为内参,用2-ΔΔCt法分析Mcl-1和miR-29b的相对表达[12]。定量PCR引物序列见表1。
2.2 MTT法检测细胞增殖 将Huh7细胞按5000个数目接种于96孔板中培养12h,按操作说明书将miR-29b(5pmol/孔)或对照RNA(5pmol/孔)用Lipofectamine 2000转入Huh7细胞,培养24h,对照组不做任何处理培养24h,之后加5mg/mLMTT 20μL,继续培养4h。弃上清,往孔中加150μL DMSO,震荡使紫色絮状物完全溶解,570nm波长下用酶标仪检测OD值,细胞的增殖情况以OD570表示,OD570越高说明细胞增殖情况越良好。
2.3 细胞凋亡检测 将Huh7细胞接种于6孔板中培养至细胞铺满板面70%左右面积,按操作说明书将miR-29b(100pmol/孔)或对照RNA(100pmol/孔)用Lipofectamine 2000转入Huh7细胞,培养24h,对照组不做任何处理培养24h,收集细胞,按照试剂说明书将PI和Annexin-V加入细胞中孵育20min,采用流式细胞术检测肿瘤细胞的凋亡,Annexin-V阳性细胞越多,说明细胞凋亡程度越大。
2.4 统计学方法 应用SPSS12.0软件进行统计分析,采用t检验,实验数据用(±s) 表示,所有实验重复3次,P<0.05认为差异有统计学意义。
3 实验结果
3.1 肝癌细胞和正常肝细胞Mcl-1和miR-29b表达情况 荧光定量PCR检测结果显示,肝肿瘤细胞相比于正常肝细胞高表达Mcl-1,低表达miR-29b,两者存在反比关系。见表2。
表2 肝癌细胞和正常肝细胞Mcl-1和miR-29b表达水平比较(±s)

表2 肝癌细胞和正常肝细胞Mcl-1和miR-29b表达水平比较(±s)
注:与LO2细胞比较,*P<0.05
LO2细胞Huh7细胞33 1.00±0.04 3.42±0.15* 1.00±0.06 0.43±0.04*
3.2 miR-29b对Huh7细胞Mcl-1表达水平的影响
使用TargetScan工具(http://www.targetscan.org)预测Mcl-1调控microRNA,结果发现Mcl-1 mRNA 3'-UTR存在miR-29b作用靶点(AUGGUGCUA,Mcl-1 3'-UTR的第1328到1336个碱基)。为了明确验证miR-29b调控Mcl-1的表达水平,将miR-29b模拟物转染Huh7细胞后检测Mcl-1表达,结果发现转染miR-29b模拟物相比于转染对照RNA可显著降低Mcl-1mRNA表达水平(P<0.05),表明miR-29b确实能下调Mcl-1水平。见图1、表3。
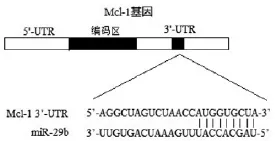
图1 Mcl-1 3'-UTR存在miR-29b的结合位点
表3 miR-29b对Huh7细胞Mcl-1表达水平的影响(±s)

表3 miR-29b对Huh7细胞Mcl-1表达水平的影响(±s)
注:与对照RNA组比较,*P<0.05
孔数miR-29b(pmol/孔)组别对照组对照RNA组miR-29b组333 00 100对照RNA(pmol/孔)0 100 0 Mcl-1 1.00±0.05 1.03±0.07 0.37±0.03*
3.3 MiR-29b对Huh7细胞增殖及细胞凋亡的影响
采用MTT法检测Huh7细胞在miR-29b治疗下的增殖情况,结果发现miR-29b组相比于对照RNA组,细胞增殖显著降低(P<0.05)。流式细胞术检测结果发现,与对照RNA组比较,miR-29b组细胞凋亡水平明显提高(P<0.05)。结果提示miR-29b可能通过下调Mcl-1表达抑制肝癌细胞生长并诱导其发生凋亡。见表4。
表4 miR-29b对Huh7细胞增殖及细胞凋亡的影响(±s)

表4 miR-29b对Huh7细胞增殖及细胞凋亡的影响(±s)
注:与对照RNA组比较,*P<0.05
对照组对照RNA组miR-29b组333 00 100 0 100 0 1.85±0.15 1.68±0.17 0.85±0.11* 2.6±0.04 3.6±0.06 28.4±2.10*
4 讨论
Mcl-1是Bcl-2蛋白家族中关键的抗凋亡蛋白,Mcl-1在人类各种肿瘤细胞系中均高度表达,有文献表明,在肝细胞中Mcl-1的过表达是一个肿瘤特异性改变。将肿瘤细胞的Mcl-1基因沉默后会引起肿瘤细胞自发性凋亡,但不影响正常肝细胞[13-14]。Mcl-1对其他类型的肿瘤也起着十分重要的作用,通过下调细胞Mcl-1的水平可以有效抑制肿瘤细胞的生长增殖并降低肿瘤细胞对化疗药物的耐药性[15]。这些研究都提示,Mcl-1可以作为肿瘤治疗的一个重要靶点。
MicroRNAs是一种生物效应很强的小分子核酸,在细胞中通过调节对应基因的表达参与细胞各项生理活动。研究表明microRNAs表达的改变往往会导致肿瘤的发生,一些特定的microRNAs还被用作肿瘤诊断及预后的评价指标[16]。本研究结果表明miR-29b的表达在Huh7细胞中相比于正常肝细胞系显著下降,而Mcl-1基因在Huh7细胞中相比于正常肝细胞系表达显著升高(P<0.05),两者存在反比关系。进一步的研究发现miR-29b通过与Mcl-1 mRNA 3'-UTR的结合,下调Huh7细胞中Mcl-1的表达(P<0.05)。此外,在Huh7细胞中转染miR-29b可抑制Huh7(P<0.05)细胞的生长,并且诱导其凋亡(P<0.05)。本研究结果提示,miR-29b具有抗肝肿瘤的作用,miR-29b-Mcl-1途径可能成为一个新的治疗肝细胞肝癌的重要靶点。
[1]Phuah NH,Nagoor NH.Regulation of MicroRNAs by Natural Agents:New Strategies in Cancer Therapies[J].Biomed Res Int,2014,2014:804510.
[2]Winter J,Jung S,Diederichs S,et al.Many roads tomaturity:microRNA biogenesis pathways and their regulation[J].Nat Cell Biol,2009,11(3):228-234.
[3]Saumet A,Mathelier A,Lecellier CH.The Potentialof Micro-RNAs in Personalized Medicine against Cancers[J].Biomed Res Int,2014,2014:642916.
[4]Jeong HC.Clinical Aspect of MicroRNA in Lung Cancer[J]. Tuberc Respir Dis(Seoul),2014,77(2):60-64.
[5]Siegel R,Naishadham D,Jemal A,et al.Cancer statistics 2012[J].CA Cancer JClin,2012,62(1):10-29.
[6]Seow TK,Liang RC,Chung MC,et al.Hepatocellular carcinoma:from bedside to proteomics[J].Proteomics,2001,1(10):1249-1263.
[7]Li X,Zeng X,Liu F.Imperatorin induces Mcl-1 degradation to cooperatively trigger Bax translocation and Bak activation to suppress drug-resistanthuman hepatoma[J].Cancer Lett,2014,348(1-2):146-155.
[8]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[9]Gong J,Li J,Yu J,et al.Characterization of microRNA-29 family expression and investigation of their mechanistic roles in gastric cancer[J].Carcinogenesis,2014,35(2):497-506.
[10]Rostas JW,Pruitt HC,Samant RS.microRNA-29 negatively regulates EMT regulator N-myc interactor in breast cancer[J].Mol Cancer,2014,13:200.
[11]Chen C,Ridzon DA,Lee DH,et al.Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nucleic Acids Res,2005,33(20):e179.
[12]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[13]Thallinger C,Wolschek MF,Monia BP,et al.Mcl-1 is a novel therapeutic target for human sarcoma:synergistic inhibition of human sarcoma xenotransplants by a combination ofmcl-1 antisense oligonucleotideswith low-dose cyclophosphamide[J].Clin Cancer Res,2004,10(12 pt1):4185-4191.
[14]Opferman JT,Iwasaki H,Akashi K,et al.Obligate role of anti-apoptotic MCL-1 in the survival of hematopoietic stem cells[J].Science,2005,307(5712):1101-1104.
[15]Mattoo AR,Zhang J,Jessup JM,et al.Inhibition of NANOG /NANOGP8 down regulates MCL-1 in colorectal cancer cells and enhance the therapeutic efficacy of BH3 mimetics[J].Clin Cancer Res,2014,20(21):5446-5455.
[16]Shin VY,Chu KM.MiRNA aspotentialbiomarkersand therapeutic targets for gastric cancer[J].World JGastroenterol,2014,20(30):10432-10439.
(收稿:2014-10-01 修回:2014-11-04)
Targets of m iR-29b and Its Effect on Proliferation and Apoptosis of Huh7 Cells
XU Haihe.Clinical Labo- ratory,Jiangshan People's Hosital,Jiangshan(324100),China
Objective To investigate the therapeutic targets of miR-29b and its effect on proliferation and apoptosis of hepatocarcinoma cell line Huh7.M ethods The expression of Mcl-1 and miR-29b in normal liver cell line LO2 and hepatocellular carcinoma cell line Huh7 was detected by qPCR.The putative binding sites of Mcl-1 gene was analyzed by using bioinformatic method.MiR-29b was transfected into Huh7 cells by Lipofectamine 2000, then the expression of Mcl-1 was detected.The cell growth was assessed by MTT after Huh7 cells transfected with miR-29b mimics.The apoptosis of cells was measured by Annexin V/PI staining.Results Compared with normal liver cells,Huh7 cells had higher expression of Mcl-1(3.42±0.15 vs 1.00±0.04,P<0.05)and lower expression of miR-29b(0.43±0.04 vs 1.00±0.06,P<0.05).Transfection of miR-29b mimics suppressed Mcl-1 expression in Huh7 cells(0.37±0.03 vs 1.03±0.07,P<0.05)and inhibited the proliferation of Huh7 cells(0.85±0.11 vs 1.68±0.17,P<0.05)while inducing apoptosis in Huh7 cells[(28.4±2.1)%vs(3.6±0.06)%,P<0.05].Conclusion MiR-29b downregulates the expression of Mcl-1 protein inducing apoaptosis in Huh7 cells.
Hepatocellular carcinoma;Huh7;Mcl-1;Cell proliferation;Apoptosis;miR-29b
浙江省江山市人民医院检验科(江山 324100)

