川崎病合并肺炎支原体感染急性期免疫学分析及临床意义
沈方方 滕懿群 朱 雯
川崎病合并肺炎支原体感染急性期免疫学分析及临床意义
沈方方 滕懿群 朱 雯
川崎病;肺炎支原体感染;炎症水平;淋巴细胞亚群川崎病(kawasaki disease,KD)又称皮肤黏膜淋巴结综合征(mucocutaneous lymph node syndrome,
MCLS),是一种好发于5岁以下儿童的血管炎综合征,冠状动脉病变是其最严重的并发症。临床及流行病学资料提示,KD可能是感染引起的急性自身免疫性血管炎综合征。肺炎支原体(mycoplasma,MP)是儿童呼吸道感染的常见原因,多项研究证实支原体肺炎患儿存在多种免疫功能紊乱。本文分析急性期川崎病合并肺炎支原体感染患儿免疫学指标,探讨肺炎支原体和川崎病的关系。
1 资料与方法
1.1 一般资料 选取2010年1月—2013年12月本院儿科住院治疗并最终确诊川崎病患儿86例。男
52例,女34例,年龄6个月~13岁,平均(4.2±1.6)岁。86例中合并肺炎支原体感染急性期10例,男6例,女4例,年龄15个月~10岁,平均(9.2±2.3)岁。KD诊断参照《诸福棠实用儿科学》[1]。同期健康体检儿童70名为对照组,男42名,女28名,年龄8个月~10岁,平均(5.3±2.8)岁。
1.2 观察指标 入院次日(所有患者均未开始使用丙种球蛋白及阿司匹林治疗)静脉血测定白细胞计数(WBC)、超敏C-反应蛋白(CRP)、中性粒细胞百分比(N%)、血小板计数(PLT)、红细胞沉降率(ESR)、降钙素原(PCT)。外周血测定免疫球蛋白。
淋巴细胞亚群测定:流式细胞仪为BD(becton and dickinson company)的FACS CantoII,检测方法采用四色荧光标记技术,新鲜全血50μL与试剂混匀后,4℃避光孵育20min,加入溶血素2mL,室温避光10min,溶解红细胞后加缓冲剂1mL,200×g离心5min洗涤2次,弃上清,上机流式检测,用Diva软件分析。
1.3 统计学方法 应用SPSS13.0软件包,检测结果以(±s)表示,经方差齐性F检验后,采用独立样本t检验比较两组间差异,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床表现 KD与KD合并MP患儿临床表现,见表1。
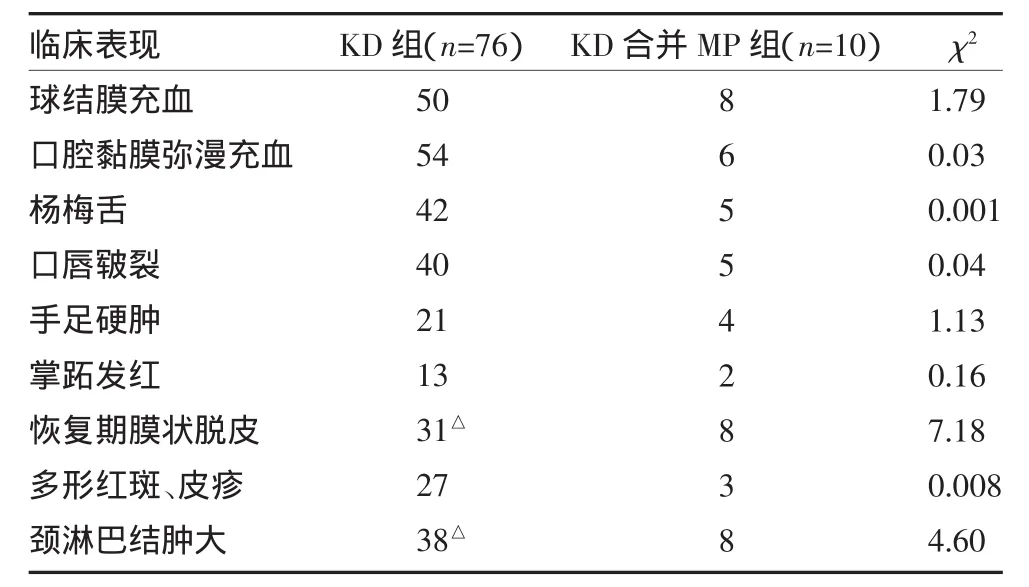
表1 KD与KD合并MP患儿临床表现(例)
KD合并MP 10例中,无明显呼吸道症状3例,仅表现为轻微咳嗽5例,有典型支原体肺炎症状2例;影像学检查,表现为支气管肺炎7例,单侧大叶性肺炎2例,纹理增粗1例,未出现胸腔积液等严重支原体感染并发症。7例MP抗体≥1:80,其中2例为1:640,1例为1:1280;3例咽拭子PCR MP-DNA阳性。
2.2 炎症指标分析 KD患儿与KD合并MP感染患儿血炎症指标比较,仅ESR差异有统计学意义(P<0.05),其他指标差异无统计学意义(P>0.05)。见表2。
2.3 体液免疫指标分析 与健康对照组比较,无MP合并感染KD组中IgA降低、IgM升高,差异有统计学意义(P<0.05);两组IgG、C3、C4比较差异均无统计学意义(P>0.05)。KD合并MP感染组IgG升高、IgA降低、C3升高,差异有统计学意义(P<0.05),IgM、C4差异无统计学意义(P>0.05)。与KD组比较KD合并MP感染组IgG、C3升高,差异有统计学意义(P<0.05),其余指标无统计学差异,见表3。
2.4 细胞免疫指标分析 与健康对照组比较,无MP合并感染KD组CD19+、CD4+/CD8+升高,差异有统计学意义(P<0.05)。KD合并MP感染组CD8+降低,CD19+升高、CD4+/CD8+升高,差异有统计学意义(P<0.05)。与KD组比较,KD合并MP感染组中CD19+、CD4+/CD8+升高,差异有统计学意义(P<0.05),余均无统计学意义。见表4。
3 讨论
川崎病是在一定的遗传易感性基础上,由一种或多种广泛存在的感染因子引起的自身免疫系统异常激活导致的临床综合征[2]。研究显示,体液免疫及细胞免疫在KD的发病中至关重要[3-4]。T细胞异常活化是KD患儿免疫系统激活的始动环节和关键步骤。在KD急性期和亚急性期,外周血CD3+、CD4+T淋巴细胞比例明显升高,外周血淋巴细胞凋亡明显降低;异常活化的淋巴细胞和单核细胞释放大量细胞因子、炎性递质如CRP、ESR等。CRP是组织损伤时一种反应变化最显著的特异性急性时相蛋白,由肝脏合成。KD患儿急性期CRP水平明显升高,美国心脏学会也将CRP、ESR纳入不完全KD的诊断标准。CD4+与CD8+T细胞的平衡在抑制肿瘤、抗感染和自身免疫病中起着重要作用[5]。正常情况下,CD4+/CD8+比值维持动态平衡,保持机体免疫功能稳定,如果其比值发生改变,引起细胞免疫功能失调,T细胞不能有效地辅助/抑制免疫效应细胞,同时T细胞对B细胞发育和免疫球蛋白合成的调节功能也将受影响,就可能导致机体免疫紊乱,并发生一系列的病理变化。在KD中超抗原通过与T淋巴细胞结合,激活B淋巴细胞,参与KD患儿血管损伤。本组KD患儿炎症指标明显升高,与既往多项研究一致。CRP、ESR在KD的鉴别诊断尤其是不典型KD的诊断中有重要价值。本组KD患儿存在免疫功能的紊乱,表现为IgM、IgA升高,CD19+升高、CD4+/CD8+升高,提示KD患儿体液免疫增强,细胞免疫紊乱,与研究结果一致[6-7]。
表2 三组WBC、N%、PLT、CRP、ESR、PCT比较(±s)

表2 三组WBC、N%、PLT、CRP、ESR、PCT比较(±s)
注:与健康对照组比较,*P<0.05;与KP合并MP组比较,△P<0.05
组别KD组KD合并MP组健康对照组例数76 10 70 WBC(×109/L)18.27±4.12* 17.62±2.87* 6.43±0.86 N(%)79.50±9.47* 72.75±12.95* 49.25±3.40 PLT(×109/L)317.25±60.81* 318.50±53.32* 152.25±27.38 CRP(mg/L)63.75±17.42* 65.25±23.44* 5.00±1.83 ESR(mm/h)31.50±7.93*△64.50±21.31* 6.25±2.63 PCT(μg/L)0.31±0.20 0.35±0.16 0.11±0.02
表3 三组IgG、IgA、IgM、C3、C4比较(g/L,±s)

表3 三组IgG、IgA、IgM、C3、C4比较(g/L,±s)
注:与KP合并MP组比较,△P<0.05;与健康对照组比较,*P<0.05
组别KD组KD合并MP组健康对照组例数46 10 52 IgG 6.46±1.12△10.01±2.71* 6.80±1.11 IgA 0.62±0.33* 0.70±0.28* 2.00±0.38 IgM 1.33±0.13* 1.24±0.53* 0.90±0.22 C3 1.14±0.13△1.50±0.11* 1.18±0.20 C4 0.29±0.03 0.24±0.05 0.26±0.06
表4 三组淋巴细胞亚群比较(%,±s)

表4 三组淋巴细胞亚群比较(%,±s)
注:与KP合并MP组比较,△P<0.05;与健康对照组比较,*P<0.05;与KD组比较,▲P<0.05
组别KD组KD合并MP组健康对照组例数24 6 18 CD3+ 67.76±4.21 58.79±5.70 67.43±2.60 CD4+ 40.48±3.31 41.27±8.05 38.68±1.79 CD8+ 25.33±2.01 19.80±2.71* 27.92±1.85 CD19+ 13.97±0.95*△36.00±7.21*▲9.71±0.58 CD4+/CD8+ 1.67±0.07△2.07±0.13*▲1.29±0.09
国内外资料提示,KD与病原微生物感染有关[8],Meta分析提示,金黄色葡萄球菌和A组链球菌、人类微小病毒B19、支原体和衣原体与KD的发生有较明显的相关性[9]。MP是介于细菌和病毒之间的一种能通过除菌器的最小原核微生物,可引起全身感染,除引起呼吸道感染外,常有肺外合并症,如神经系统、心血管系统、血液系统损害等。直接毒性作用及免疫损伤是MP感染发病的主要机制。国内外大量文献报道MP可致人单核细胞、T细胞、巨噬细胞等免疫性细胞过量释放,并释放多种炎症因子,介导机体发生炎症反应,造成组织损伤。有研究[10]表明,支原体作为抗原在体内产生特异性抗体形成免疫复合物,然后激活补体和免疫细胞发挥强大的免疫效应,引起增生和破坏性病变。
本研究结果显示,86例KD中MP感染率为11.63%。合并MP感染者其临床表现以淋巴结肿大及恢复期肢端脱皮显著,但本组例数较少,需进一步大样本研究。WBC、PLT、CRP对鉴别KD是否合并MP感染无显著意义。KD合并MP感染组较KD组 CD8+降低,CD19+、CD4+/CD8+、IgG、C3升高,两组比较差异有统计学意义(P<0.05),提示MP的感染使机体免疫功能更加紊乱,从而可能导致KD的发生。故在KD患儿中,应重视排除是否存在MP感染,以便早期使用大环内酯类药物以清除MP感染。
本组结果显示,KD患儿炎症指标明显升高,体液免疫增强,细胞免疫紊乱;伴MP感染的KD患儿炎症反应更加强烈,免疫功能紊乱更加突出。MP感染是否可直接诱发KD,是否增加冠状动脉病变以及难治性KD的关系仍需大样本多中心研究及长期随访。
[1]胡亚美,江载芳,诸福棠实用儿科学[M].第7版.北京:人民卫生出版社,2002:1204-1205.
[2]Burns JC.The riddle of Kawasaki disease[J].N Engl J Med,2007,356:659-661.
[3]王宏伟.川崎病的病因及发病机制的研究进展[J].中华儿科杂志,2002,40(2):120-121.
[4]黄麟,杨作成.川崎病发病机制的研究进展[J].中华儿科杂志,2009,47(4):265-267.
[5]Ehara H,Kiyohara K,Izumisawa Y,et al.Early activation does not translate into effector differentiation of peripheral CD8T cells during the acute phase of Kawasaki disease[J].Cell Immunol,2010,265:57-64.
[6]丁艳,尹薇,熊越华,等.川崎病患儿免疫功能的检测及临床价值[J].中华风湿病学杂志,2012,16(9):58-592.
[7]Giordani L,Quaranta MG,Marchesi A,et al.Increased frequency of immunoglobulin(Ig)A—secreting cells following Toll like receptor(TLR)-9 engagement in patients with Kawasaki Disease[J].Clin Exp Immunol,2011,163:346-353.
[8]Burguer D,Hamden A.Kawasaki disease:what is the epidemiology telling us about the etiology[J].Int J Infect Dis,2005,9(4):185-194.
[9]李瑞燕,李晓辉,吴泰相.川崎病与病原微生物关系的meta分析[J].临床儿科杂志,2013,31(1):69-72.
[1 0]Palmer AL,Walker T,Smith jc.Acute respiratory distress syndrome in a child with Kawasaki disease[J].South Med J,2005,98:1031-1033.
(收稿:2014-06-21 修回:2014-08-17)
浙江省嘉兴市科技计划项目(No.2012AY1071-12)
浙江省嘉兴市第二医院儿科(嘉兴 314000)
沈方方,Tel:13957375473;E-mail:sffshannon101@sina.com

