P507萃取分离钴、镍离子的实验研究
桑雅丽,崔荣荣,刘春华,于婷婷
(赤峰学院 化学化工学院,内蒙古 赤峰 024000)
1 前言
钴、镍是两种非常重要的有色金属,它们是制造抗氧化合金、高强度合金、精密仪器合金等一些合金材料的重要原料[1].近年来,钴、镍的消耗量一直有较大的增长趋势,所以对钴、镍的分离以及循环再利用显得至关重要[2-3].钴、镍的化学性质相近,在矿石中常常共生或伴生,工业上通常使用溶剂萃取分离钴、镍离子.常用的萃取剂有P204(学名为二(2-乙基己基)磷酸酯)、Cyanex272(学名为二(2,4,4-三甲基戊基)次膦酸)和P507(学名为2-乙基己基膦酸-2-乙基己基酯).虽然P204和Cyanex272可用于分离钴、镍离子,但是使用P204分离钴、镍离子所需要的条件比较苛刻,而且分离系数比较低,一般用于分离钴含量高镍含量低的溶液.Cyanex272价格昂贵,使用成本高,一般用于分离镍含量高钴含量低的溶液[4].而P507是近些年从大量的有机磷萃取剂中筛选出的一种分离钴、镍离子的新型萃取剂[5],它具有对钴、镍离子的分离系数高,毒性低,化学稳定性好、价格比Cyanex272经济等优点.分子结构式如图1所示.
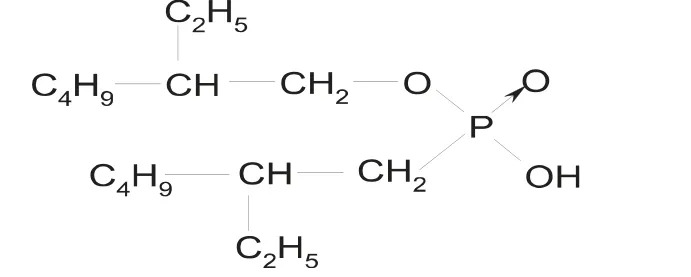
图1 P507分子结构式(HA)
P507可以简写为HA,它通常是以二聚体(H2A2)的形态存在,下式就是它萃取金属离子的反应:
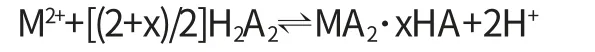
此反应为可逆反应,当反应产生的H+浓度增加使反应达到平衡时,则P507对金属离子的萃取反应终止.为了控制反应中的H+浓度,需先将P507部分转为铵盐.
本实验选用新型萃取剂P507来萃取分离钴、镍离子.在实验中,依据参考文献测出不同条件下水相和有机相中钴、镍离子的浓度[6-7],从而探究出萃取分离钴、镍离子的最佳条件.
2 实验
2.1 实验仪器、药品与试剂的配制
本实验所用仪器主要有TU-1901双光束紫外可见分光光度计,电子分析天平(DENVER instrument),雷磁PH计(PHS-2F),分液漏斗.实验所用药品与试剂列于表1.

表1 实验主要药品及试剂
2.2 实验步骤
2.2.1 皂化有机相
分别量取20%的萃取液(Vp507:V磺化煤油=1:4)20.00mL置于编号为1、2的两只分液漏斗中,各加入10mL蒸馏水轻轻摇动,以洗涤萃取液中残留的酸液,静置2min,分液,保留有机相(如用新萃取液可省略此步骤),再分别加入3.0mL 1.0mol/L的进行皂化处理,振荡20min,静置,待分层完全后(约30分钟),分液,保留上层有机相备用.
2.2.2 萃取
量取15.00mLCo2+、Ni2+标准溶液的混合液(CoCl20.07000mol/L、NiSO40.2000mol/L),加入1号分液漏斗中,充分振荡10min,静置,分液.将分液出的少许水相置于50mL的烧杯中,测试其pH是否为4.20,若pH太高或太低,则将水相重新倒入1号分液漏斗中,滴加稀盐酸或稀氨水,调节至水相pH值为4.20,再重新萃取.一级萃取后,将水相转入已皂化好的2号分液漏斗中,进行二级萃取.二级萃取后,将分液后的水相置于试管中备用.
2.2.3 反萃取
在1号分液漏斗的有机相中加入10mL1.0mol/L的HCl溶液,充分振荡至水相变为粉红色,Co2+几乎全部转入水相中,静置,分液,保留水相于试管中.再加5mL1.0mol/LHCl溶液于1号分液漏斗,充分振荡,静置,分液,合并水相.最后在有机相中加入10mL蒸馏水,充分轻轻摇动分液漏斗,以洗涤掉残留酸液(回收有机相重复使用).
重复上述反萃取操作,将2号分液漏斗的有机相直接进行两次反萃取,分液,合并水相.最后洗涤有机相,并回收重复使用.
2.2.4 钴的含量测定
水相中钴的含量测定
绘制紫外标准曲线:配制100mL100μg/mLCo2+标准溶液,量取2.00、4.00、6.00、8.00、10.00mL该标准溶液,分别置于5个50mL的容量瓶中,再分别加入5mL冰醋酸、0.5g NH4SCN、30mL丙酮,定容.以空白试液作为参比,在620nm的波长下,用1cm的比色皿在紫外分光光度计上测其吸光度.然后以钴的质量浓度为横坐标,吸光度为纵坐标作图,绘制紫外标准曲线.
取实验步骤2.2.2萃取得到的水相试液(含有少量Co2+溶液)1.00mL于50mL的容量瓶中,稀释到刻度线,摇匀.再取上述稀释液2.00mL于50mL的容量瓶中,加5mL冰醋酸、0.5gNH4SCN、30mL丙酮,定容.以空白试液作为参比,在620nm的波长下,用1cm的比色皿在紫外分光光度计上测其吸光度,然后在标准曲线上根据吸光度找出对应的钴含量.
有机相中钴的含量测定
取实验步骤2.2.3反萃取得到的水相试液(含有大量Co2+溶液)1.00mL于50mL的容量瓶中,按照上述测水相中钴离子含量的方法测有机相中钴离子的含量.
2.2.5 镍的含量测定
水相中镍的含量测定
标准紫外曲线的绘制:配制100 mL100μg/mL的Ni2+标准溶液,量取2.00、4.00、6.00、8.00、10.00mL该标准溶液,分别置于5个50mL的容量瓶中,再分别加入4mL20%NaOH溶液、5mL5%(NH4)2S2O8溶液、5mL1%丁二酮肟溶液,静置至显色后定容,摇匀.以蒸馏水为空白,在波长为465nm下,用1cm的比色皿在紫外分光光度计上测其吸光度.然后以镍的质量浓度为横坐标,吸光度为纵坐标作图,绘制紫外标准曲线.
取实验步骤2.2.2萃取得到的水相试液(含有大量Ni2+溶液)1.00mL于50mL的容量瓶中,定容,摇匀.再取上述稀释液2.00mL于3号分液漏斗中,加入10mL蒸馏水、5mL20%柠檬酸钠、10mL1:1,摇匀,加5mL1%丁二酮肟,摇匀,静置5min后加入10mLCHCl3,振荡1min,静置,分液,将下层有机相置于4号分液漏斗中,再加5mL CHCl3置于3号分液漏斗中,振荡1min,静置,分液,将下层有机相置于4号分液漏斗中.在4号分液漏斗中加10mL5%HCl溶液,振荡1min,使大量镍离子反萃取后进入水相,静置,待分层后,分液,将下层有机相置于5号分液漏斗中,再加5mL5%HCl溶液于4号分液漏斗中,重复操作,待分层后,分液,回收有机相.合并反萃取后的水相,置于50mL容量瓶中,再分别加入4mL20%NaOH溶液、5mL5%(NH4)2S2O8溶液、5mL1%丁二酮肟溶液,静置至显色后定容.在波长为465nm下,用1cm的比色皿在紫外分光光度计上测其吸光度,然后在标准曲线上根据吸光度找出对应的镍含量.
有机相中镍的含量测定
取实验步骤2.2.3反萃取得到的水相试液(含有少量Ni2+溶液)1.00mL于50mL的容量瓶中,按照上述测水相中镍离子含量的方法测有机相中镍离子的含量.
2.3 实验数据的处理
钴、镍含量的实验数据记录及处理列于图2、图3、图4、图5、图6、图7、表2、表3.
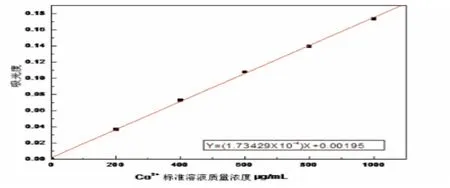
图2 Co2+标准溶液的标准曲线
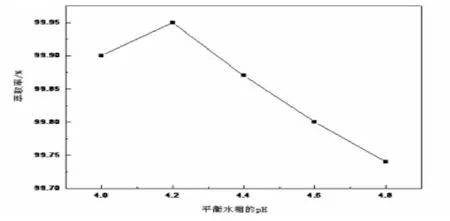
图3 平衡水相pH对萃取率的影响
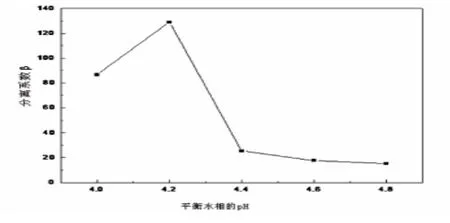
图4 平衡水相pH对分离系数β 的影响
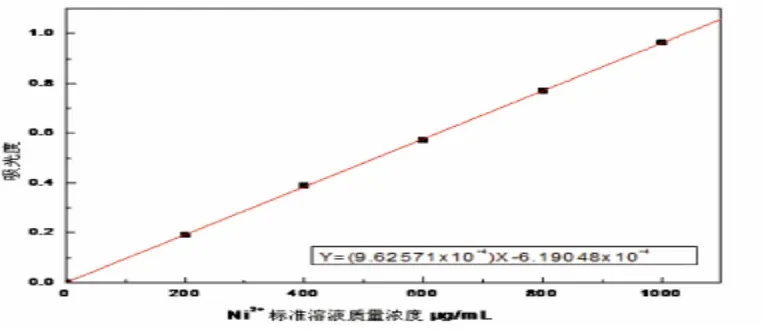
图5 Ni2+标准溶液的标准曲线
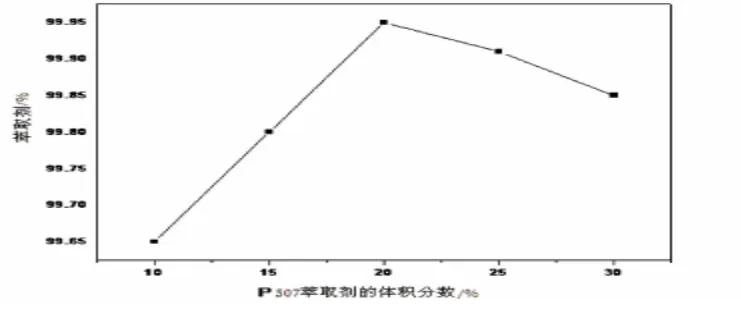
图6 P507萃取剂体积分数对萃取率的影响
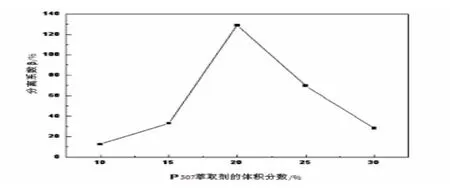
图7 P507萃取剂体积分数对分离系数β 的影响
3 实验结论
由图3可见,随着萃取后平衡水相中的pH增大,钴的萃取率先升高后降低.这是由于P507萃取剂在萃取钴离子的过程中是发生金属阳离子与H+的交换反应.在萃取中,pH对萃取率的影响较大,pH增大,平衡向右移动,钴的萃取率会增大.但是当pH太高时,钴离子极易水解,而且水解的产物不能被P507萃取剂萃取,所以钴的萃取率会下降.由图4可见,当平衡水相的pH值为4.20时,钴、镍的分离系数β 值最大,钴、镍的分离最彻底.因此,平衡水相中pH的最佳值为4.20.
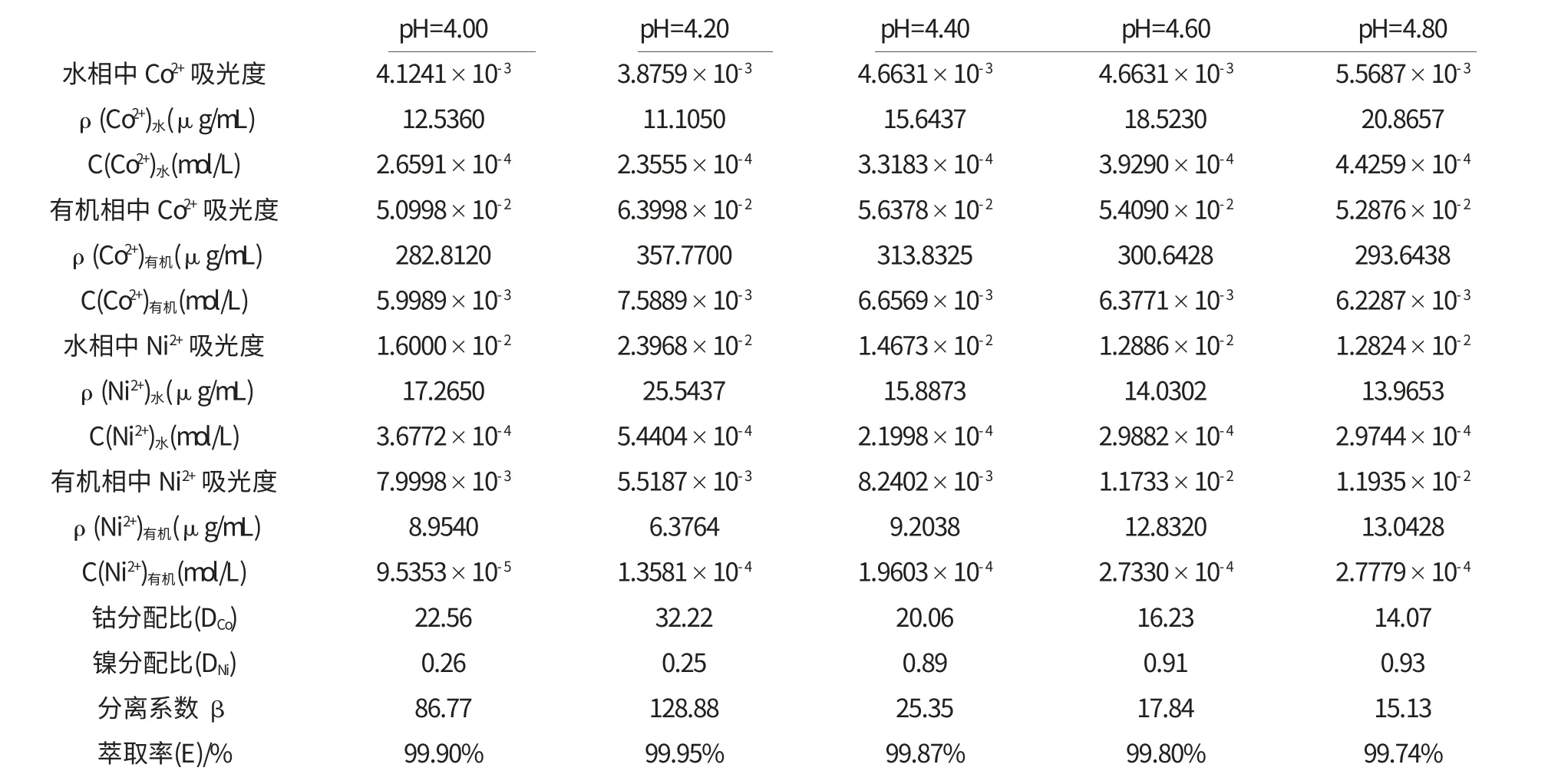
表2 pH不同P507体积分数为20%时钴镍分离的测定数据
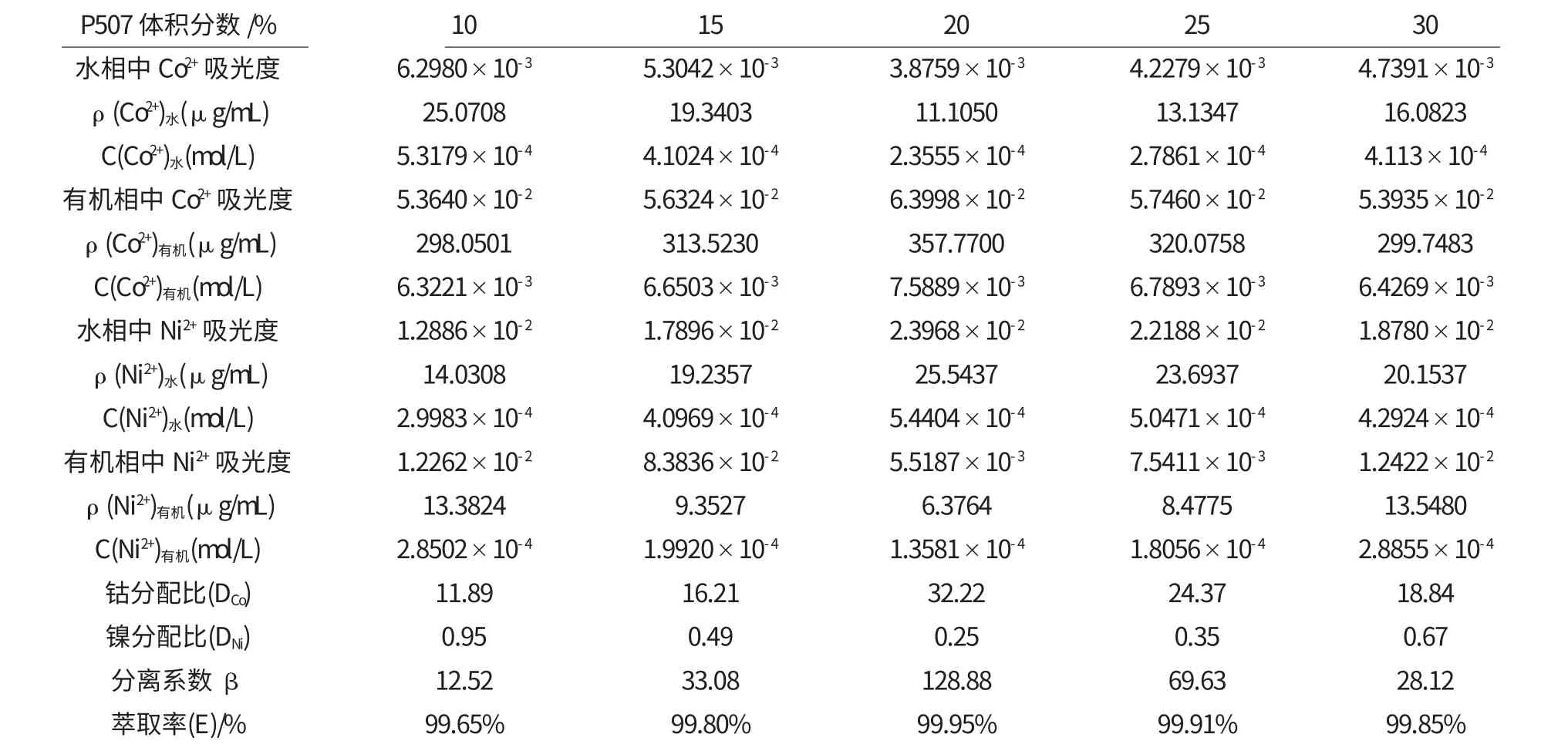
表3 pH为4.20P507体积分数不同钴镍分离的测定数据
由图5、图6可见,在平衡水相的pH为4.20的条件下,随着有机相中P507萃取剂的体积分数增加,钴离子的萃取率先升高后降低.当P507萃取剂的体积分数为20%时,钴的萃取率最高为99.95%,钴、镍的分离系数β 值最大为128.88.P507萃取剂的体积分数过高或过低,钴、镍的分离系数β 都会受到影响,明显降低,钴的萃取率也下降.因此,实验应选择有机相中P507萃取剂的体积分数为20%时较适宜.
在本次萃取分离钴、镍实验中,探索出了平衡水相中pH的最佳值为4.20、有机相中P507萃取剂的最佳体积分数为20%时最适宜.同时,温度、皂化时间、分液是否完全也是影响萃取率、分配比以及分离系数的重要因素.因此,本实验必须始终保证萃取温度在20℃以上,皂化时间大于30min且彻底分液.
〔1〕钟盛华,刘明星,沈杨扬,等.P507 萃取钴镍的分相研究.2012 年中西部地区无机化学化工学术研讨会论,105-107.
〔2〕钟盛华,汪小强,吕永康,等.P507 分馏萃取分离钴镍的研究[J].中国有色金属,2012,41(1):69-71.
〔3〕诸爱士,徐亮,沈芬芳.钴与镍的分离技术研究综述[J].浙江科技学院学报,2007(3):169-174.
〔4〕刘大星.溶剂萃取在钴镍精炼中的应用(上)[J].有色金属再生与利用,2005(10):27-29.
〔5〕袁承业,许庆仁,蒋亚东.高效的钴、镍分离萃取剂-P507[J].中国有色冶炼,1981(2):l-7.
〔6〕曹善文,李朝晖.容量及分光组合法测定PTA 复合催化剂中的钴锰[J].中国石油和化工标准与质量,2013(5):60-61.
〔7〕郭崇武.分光光度法测定镀铬溶液中铜、铁及镍杂质[J].电镀与精饰,2011(1):42-44.
〔8〕钴、镍的萃取分离.无机化学实验[M]..高等教育出版社,2002.137-140.

