上海市耐多药肺结核防治管理模式效果评价
吴哲渊 张青 张祖荣 沙巍 肖和平 陈静 潘启超 沈鑫 袁政安
·论著·
上海市耐多药肺结核防治管理模式效果评价
吴哲渊 张青 张祖荣 沙巍 肖和平 陈静 潘启超 沈鑫 袁政安
目的 分析上海市耐多药肺结核(multi-drug resistant pulmonary tuberculosis,MDR-PTB)防治管理模式实施以来MDR-PTB的筛查效果、治疗情况、治疗转归及其影响因素,以及治疗费用减免情况;评价该模式效果,为大城市MDR-PTB防治管理模式的进一步完善提供依据。方法 上海市自2011年起建立了集筛查、诊断、治疗、管理和费用减免5大策略的MDR-PTB防治管理模式。采用“全面筛查”方式,对2011年1月至2013年12月所有登记的肺结核患者共21 402例进行筛查,发现MDR-PTB患者363例,其中初治患者168例,复治患者195例。比较“全面筛查”方式与“高危人群筛查”方式的效果。363例MDR-PTB患者的年龄中位数为42岁(下四分位数28岁,上四分位数55岁);其中男263例,占72.5%。MDR-PTB患者均由MDR-PTB防治专家组制定化疗及管理方案,其中58例初治患者仍使用原方案进行治疗。共有321例MDR-PTB患者(包括维持原方案治疗的MDR-PTB患者中15例治疗失败及1例复发的患者)制定MDR-PTB方案治疗,其中96.6%(310/321)接受MDR-PTB治疗方案。截止到2014年12月,对211例已停止治疗的患者进行治疗情况、治疗转归及其影响因素,以及费用减免情况分析。结果 高危人群和非高危人群MDR-PTB检出率分别为10.5%(273/2592)和1.4%(90/6328),差异有统计学意义(χ2=390.922,P<0.001)。全面筛查方式比高危人群筛查方式多检出90例MDR-PTB患者,占全部患者的24.8%(90/363)。维持原方案治疗的MDR-PTB患者治愈率69.0%(40/58)。采用MDR-PTB方案治疗的MDR-PTB患者治疗成功率54.5%(115/211),其中初治患者和复治患者治疗成功率分别为68.1%(49/72)和47.5%(66/139),差异有统计学意义(χ2=8.096,P=0.004)。多因素logistic回归分析结果显示,年龄≥40岁(OR=3.20,95%CI=1.58~6.49,P=0.001)、复治(OR=1.98,95%CI=1.05~3.75,P=0.036)与MDR-PTB患者治疗不良转归有关。MDR-PTB患者平均治疗费用为1.70万元,其中政府财政减免经费为1.28万元。结论 上海市建立的耐多药肺结核防治管理模式取得了一定成效,但仍需进一步加强MDR-PTB患者的管理,应用诊断新技术和新药物,确保早期、有效治疗。
结核, 肺/药物疗法; 抗药性, 多种, 细菌; 普查; 临床方案; 上海市
耐多药肺结核(multi-drug resistant pulmonary tuberculosis,MDR-PTB)是影响全球结核病控制效果的主要因素之一,也是全球公共卫生领域的一大挑战。据WHO估计,2013年全球约新发48万例MDR-PTB患者[1]。中国是MDR-PTB高负担国家之一。全国耐药基线调查表明,我国每年新发MDR-PTB患者占全球年新发MDR-PTB患者的1/4,居全球首位[2]。
由于对肺结核患者治疗方案使用的不恰当及督导管理措施的不到位,导致了耐药甚至耐多药结核分枝杆菌的产生;MDR-PTB患者没有得到及时诊断或有效治疗,造成了耐多药结核分枝杆菌的进一步传播,感染者一旦发病即为MDR-PTB。MDR-PTB患者使用的二线抗结核药物相比一线药物更为昂贵但效果较差。为达到良好杀菌效果,MDR-PTB的推荐疗程长达20个月[3],但治疗成功率仅为48%[1]。同时不良反应发生概率更高,治疗依从性更差,治疗管理难度更大。因此,MDR-PTB的防控已成为全球结核病防控工作的热点和难点之一。
尽管我国的MDR-PTB负担严重,但是由于受到资源和条件的限制,我国的MDR-PTB防控工作起步较晚。上海是我国经济最为发达的地区之一,结核病防控网络也较为完善、防控措施均可落实到位[4]。为及时发现MDR-PTB患者,并给予规范有效的治疗,提高患者治愈率,减少MDR-PTB的进一步传播,遏制MDR-PTB的流行,上海市从2011年起在全市范围内启动实施了MDR-PTB预防控制项目,建立了集MDR-PTB筛查、诊断、治疗、管理和费用减免五大策略的MDR-PTB防治管理模式。本研究对项目实施以来的MDR-PTB筛查效果、治疗情况、治疗转归、治疗转归的影响因素及治疗费用减免情况进行了分析,以期为今后进一步制定和完善防控措施提供依据,也可为全国其他城市地区的MDR-PTB防控工作提供借鉴。
材料与方法
一、MDR-PTB防治管理模式
1.MDR-PTB筛查:采用全面筛查的方式。上海市所有综合性医疗机构或社区卫生服务中心发现的疑似肺结核患者转诊至结核病定点医院,全部进行胸部X线摄影、痰涂片和痰培养检查;除上海市肺科医院外,其余结核病定点医院将所有患者首次培养阳性菌株(再次发现的培养阳性菌株根据临床需要)送上海市CDC结核病实验室进行传统一线抗结核药物[链霉素(S)、异烟肼(H)、利福平(R)、乙胺丁醇(E)]的药物敏感性试验(drug susceptibility test, DST)和菌种鉴定。DST及菌种鉴定方法见文献[5]。上海市肺科医院对本院就诊的患者进行一线抗结核药物的DST和菌种鉴定。
2.MDR-PTB诊断:DST检测结果显示为至少同时对H、R耐药且菌种鉴定为结核分枝杆菌复合群的患者,由结核病定点医院主治医生将该患者的临床资料提交上海市耐多药肺结核病防治专家组统一定诊并制订化疗及管理方案,专家组由本市结核病定点医院结核科、内科、胸外科及CDC相关专家5~6名组成。
3.MDR-PTB治疗:专家组遵循国家《耐多药肺结核防治管理工作方案》[6]和中国防痨协会《耐药结核病化学治疗指南(2010年)》[7]为确诊的MDR-PTB患者制定化疗方案。本市指定3家耐多药肺结核病定点医院,负责MDR-PTB患者的住院和门诊治疗。经专家组确诊的MDR-PTB患者转诊至MDR-PTB定点医院,临床医生严格按照专家组制定的方案进行规范化治疗。原则上MDR-PTB患者前2个月需住院治疗,以便于早期发现并及时处置药物不良反应,提高患者对治疗的依从性。如治疗过程中由于各种原因需要更改治疗方案,MDR-PTB定点医院需再次提交专家组会诊决定。患者使用注射剂时可根据就诊方便,选择在MDR-PTB定点医院或其他结核病定点医院注射药物。
4.MDR-PTB督导管理:确诊的MDR-PTB患者由专家组制定督导管理措施。专家组将确诊患者信息反馈给居住地CDC,后者接收信息后于2周内会同社区医生上门访视患者并签订治疗管理协议。患者开始治疗后,社区医生每月访视患者1次,评价患者病情及就诊服药情况,督促患者按时就诊与服药,为患者提供就诊指导、健康教育、感染控制、轻微不良反应的处理方式等服务。社区医生培训家庭督导员负责督导患者日常服药,无合适家庭督导员的患者,由社区医生采取送药上门、服药点服药等方式督导服药。社区医生将患者治疗和随访信息反馈至辖区CDC。辖区CDC每6个月访视患者1次,为患者提供健康教育、心理疏导服务,协助解决患者治疗过程中的问题。
5.MDR-PTB治疗费用减免:上海市为常住人口中经专家组统一定诊的MDR-PTB患者给予一个疗程(一般为2年)的治疗费用减免[8]。患者需全程在MDR-PTB定点医疗机构治疗,签订治疗管理协议,全程接受督导管理,方能获得减免。减免范围包括常用国产二线抗结核药物及仍需使用的一线药物、治疗监测所需的检查项目、特定对象的护肝药物(每月不超过100元,最长不超过2年)、住院床位费补助(不超过60 d)、手术费用(限1次手术中的手术费、麻醉费和材料费)、注射费用。减免范围内的项目在扣除患者自身各种医疗保险基金负担部分后,全部由政府财政予以减免。维持原一线方案治疗的患者仍按照《上海市菌阳肺结核病政府减免治疗办法》[9],对治疗过程中符合规定的抗结核药物、痰涂片检查、痰培养检查、胸部X线摄影检查、肝功能检查等项目的费用进行减免报销。
二、相关定义
(1)MDR-PTB:DST检测结果至少同时对H、R耐药的肺结核病。(2)广泛耐药结核病(extensively drug-resistant tuberculosis, XDR-TB):DST检测结果同时对H、R耐药外,至少还对任意一种氟喹诺酮类药物和任意一种二线注射剂(阿米卡星、卡那霉素、卷曲霉素)耐药的结核病。(3)本地患者和外地患者:本地患者是指具有本市户籍的患者;非本市户籍患者即归为外地患者。(4)治疗成功和不良转归:本研究采用《耐多药肺结核防治管理工作方案》[6]推荐的转归定义,治愈和完成治疗定义为治疗成功;其他转归定义为不良转归。(5)高危人群和非高危人群:本研究中高危人群的定义与《耐多药肺结核防治管理工作方案》[6]中的MDR-PTB高危人群定义相同,即慢性排菌患者或复治失败患者;密切接触耐多药肺结核患者的涂阳肺结核患者;初治失败患者;复发与返回患者;治疗3个月末痰涂片仍阳性的初治涂阳患者。除此之外的肺结核患者定义为非高危人群。
三、研究对象
1.筛查效果分析:2011年1月至2013年12月全市登记的肺结核患者21 402例纳入本研究。其中,开展痰培养检查患者18 559例(86.7%),培养阳性10 025例(54.0%)。培养阳性患者中,进行菌种鉴定及一线药物DST患者8920例(89.0%),其中感染结核分枝杆菌复合群患者7958例(89.2%),感染非结核分枝杆菌患者962例(10.8%)。在感染结核分枝杆菌复合群的患者中共发现MDR-PTB患者363例,其中初治患者168例,复治患者195例(表1)。将筛查对象根据抗结核药物治疗史进行分类,对全面筛查方式与高危人群筛查方式结果进行比较。其中初治患者根据治疗前与疗程中的痰涂片结果进一步分为如下几类:(1)Ⅰ类患者,疗程中痰涂片检查未发现阳性的初治涂阳患者;(2)Ⅱ类患者,疗程中痰涂片检查未发现阳性的初治涂阴患者;(3)Ⅲ类患者,治疗3个月末痰涂片仍阳性的初治涂阳患者;(4)Ⅳ类患者,初治失败患者(疗程中痰涂片阳性的初治涂阴患者);(5)Ⅴ类患者,即为复治患者,包括慢性排菌或复治失败患者及复发患者。根据高危人群定义,Ⅰ、Ⅱ类患者为非高危人群,Ⅲ、Ⅳ、Ⅴ类患者为高危人群。
2.治疗情况、治疗转归、治疗转归影响因素及费用减免情况分析:363例确诊MDR-PTB患者中,年龄中位数为42岁(下四分位数28岁,上四分位数55岁);男263例,占72.5%;本地患者205例,占56.5%;合并糖尿病患者65例,占17.9%;XDR-TB患者36例,占9.9%(表2)。58例初治患者在确诊MDR-PTB前使用初治标准方案(2H-R-Z-E/4H-R)临床治疗有效,痰涂片阴转且肺部病变明显吸收,因此仍使用原方案进行治疗;疗程延长至1年,并密切观察痰涂片、痰培养及病变吸收情况;一旦后续痰培养阳性且DST结果再次诊断为MDR-PTB,立即转入MDR-PTB治疗。共有321例患者由专家组制定耐多药肺结核方案治疗(包括确诊后即制定MDR-PTB方案治疗的患者305例、维持原方案治疗的MDR-PTB患者中15例因治疗失败和1例因复发而重新制定MDR-PTB方案的患者),其中拒绝治疗10例(包括外地患者返乡5例),在开始治疗前死亡1例,因此接受MDR-PTB方案治疗的患者共有310例(96.6%)。

表1 2011—2013年全市初治与复治患者进行MDR-PTB筛查情况
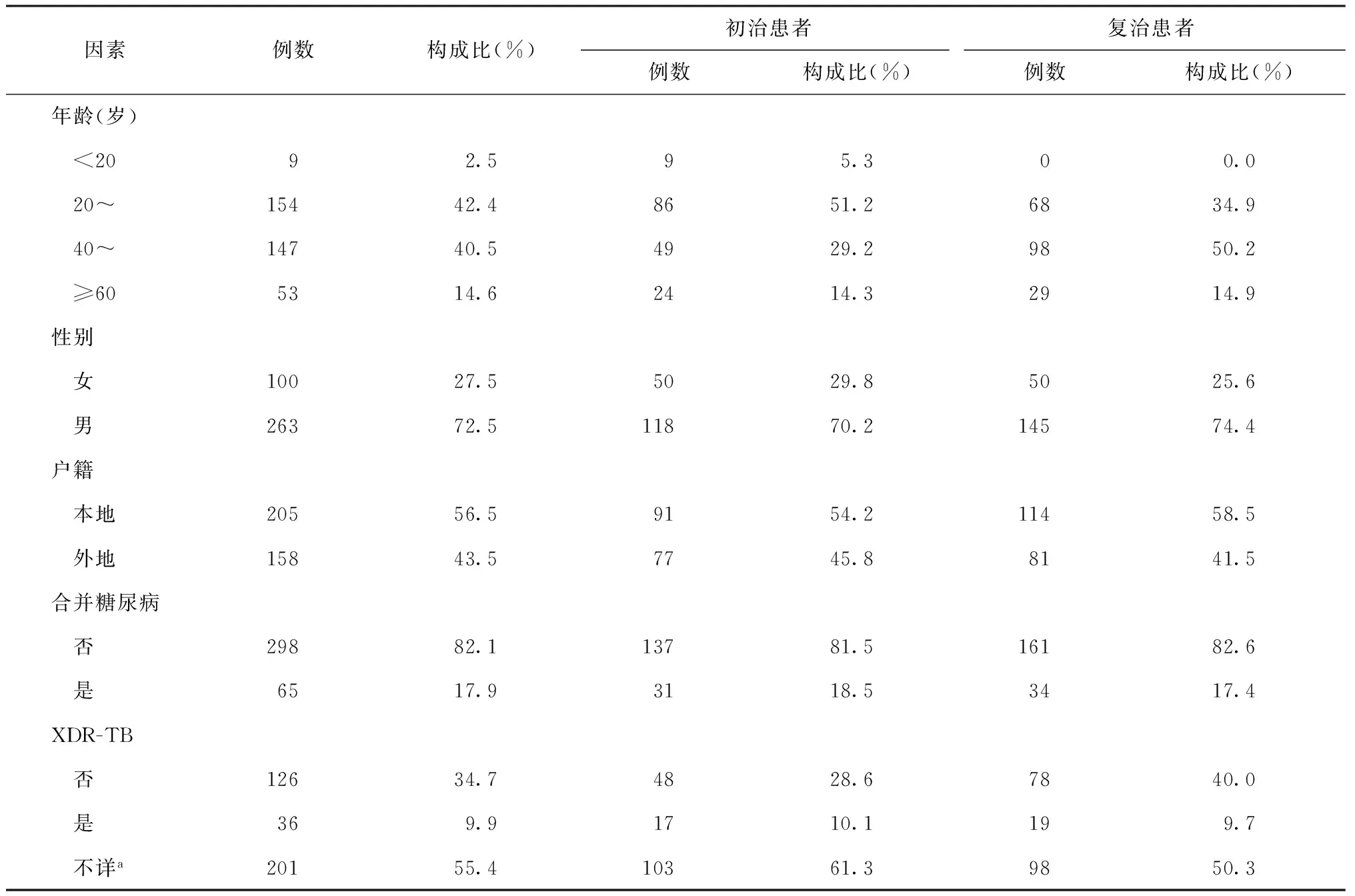
表2 不同因素在363例MDR-PTB患者中的分布
注a:未对二线抗结核药物进行DST检测,因此无法判断是否为XDR-TB患者
四、统计学分析
患者信息采用Excel 2007软件整理,采用SPSS 17.0软件进行统计学分析。单因素统计分析采用卡方检验、Wilcoxon秩和检验,P<0.05时判断差异有统计学意义。多因素统计分析采用非条件logistic回归分析,单因素分析中全部变量进入多因素回归模型,使用enter法,P<0.05时判断差异有统计学意义。
结 果
一、筛查效果分析
采用高危人群筛查方式,在高危人群中共可检出MDR-PTB患者273例,检出率为10.5%(273/2592),显著高于非高危人群[检出率1.4%(90/6328)],两者比较差异有统计学意义(χ2=390.922,P<0.001)。采用全面筛查方式时,除高危人群筛查方式发现的MDR-PTB患者外,在非高危人群中还检出90例患者,占全部MDR-PTB患者数的24.8%(90/363)。此外,66例Ⅲ类患者中的MDR-PTB患者发现时间可提早3个月以上,12例Ⅳ类患者中的MDR-PTB患者发现时间也有不同程度的提前(表3)。
二、MDR-PTB患者治疗及转归情况
(一)维持原方案治疗的58例MDR-PTB患者治疗及转归情况
治愈40例(69.0%),丢失3例(5.2%),因后续痰培养阳性且DST结果再次为MDR-PTB而转入MDR-PTB治疗15例(25.9%)。对40例治愈患者进行随访,平均随访时间16个月,结果发现:2例(5.0%)外地患者在治愈6个月后复发,其中1例经DST确诊为MDR-PTB,遂在本市转入MDR-PTB治疗;另1例在外地进行MDR-PTB治疗。
(二) 采用MDR-PTB方案治疗的211例MDR-PTB患者治疗及转归情况
1.治疗情况:曾住院治疗患者占全部患者的37.0%(78/211),其中初治患者41.7%(30/72),复治患者34.5%(48/139)。平均住院时间31 d,其中初治患者27 d,复治患者34 d。经统计学检验,初治患者和复治患者的住院率差异无统计学意义(χ2=1.036,P=0.309),平均住院时间差异无统计学意义(Wilcoxon秩和检验,P=1.000)。17例(8.1%)初治患者的初始方案采用耐多药肺结核标准化治疗方案[6Z-Cm-Lfx-PAS-Pto/18Z-Lfx-PAS-Pto(Z:吡嗪酰胺;Cm:卷曲霉素;Lfx:左氧氟沙星;PAS:对氨基水杨酸;Pto:丙硫异烟胺)],其余194例(91.9%)患者均由专家组根据抗结核用药史、二线药物DST结果、患者个体情况(合并症、不良反应)等制定个体化方案治疗,疗程2年。
2.MDR-PTB患者治疗转归情况:治愈96例(45.5%),完成治疗19例(9.0%),死亡29例(13.7%),失败39例(18.5%),丢失26例(12.3%),其他(确诊为非结核分枝杆菌病)2例(0.9%),治疗成功率54.5%(115/211)。初治患者治疗成功率68.1%(49/72),复治患者治疗成功率47.5%(66/139),经统计学分析,χ2=8.096,P=0.004,差异有统计学意义(表4)。
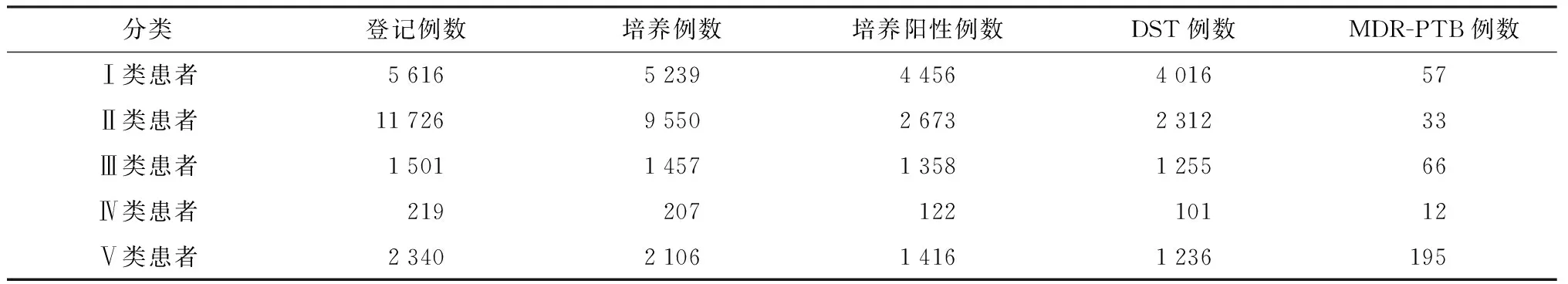
表3 不同类别患者MDR-PTB筛查的结果比较
注 Ⅰ类患者:疗程中痰涂片检查未发现阳性的初治涂阳患者;Ⅱ类患者:疗程中痰涂片检查未发现阳性的初治涂阴患者,Ⅲ类患者:治疗3个月末痰涂片仍阳性的初治涂阳患者;Ⅳ类患者:初治失败患者(疗程中痰涂片阳性的初治涂阴患者);Ⅴ类患者即为复治患者:慢性排菌或复治失败患者以及复发患者。Ⅰ、Ⅱ类患者为非高危人群,Ⅲ、Ⅳ、Ⅴ类患者为高危人群

表4 采用MDR-PTB方案治疗的初治和复治MDR-PTB患者的转归分析
注a:确诊为非结核分枝杆菌病;b:初治和复治患者间治疗成功率的比较
三、MDR-PTB患者治疗转归影响因素分析
单因素分析发现,患者不良转归与年龄≥40岁、男性、复治有关(P<0.05)(表5)。不良转归的患者中,XDR-TB及合并糖尿病的比例高于治疗成功的患者,但是差异无统计学意义(P>0.05)。多因素分析结果显示,年龄≥40岁(OR=3.20,95%CI=1.58~6.49,P=0.001)、复治(OR=1.98,95%CI=1.05~3.75,P=0.036)与治疗不良转归有关(表6)。
四、费用减免情况
MDR-PTB患者平均治疗费用为1.70万元(外地患者1.76万元,本地患者1.68万元,Wilcoxon秩和检验,P=0.492);其中政府财政减免经费为1.28万元(外地患者1.57万元,本地患者1.14万元,Wilcoxon秩和检验,P=0.006)。
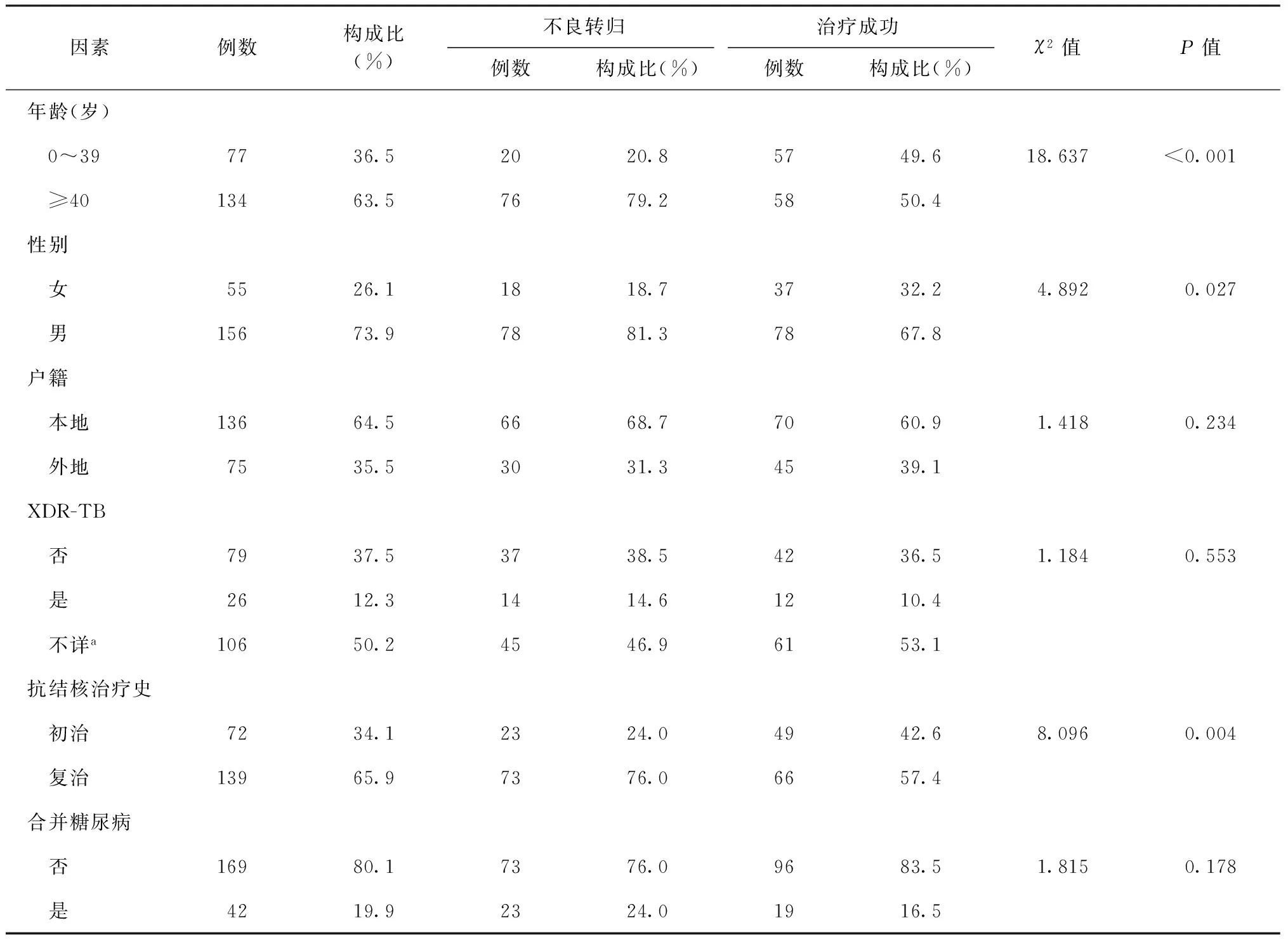
表5 耐多药肺结核患者不良转归相关影响因素
注a:未对二线抗结核药物进行DST检测,因此无法判断是否为XDR-TB患者
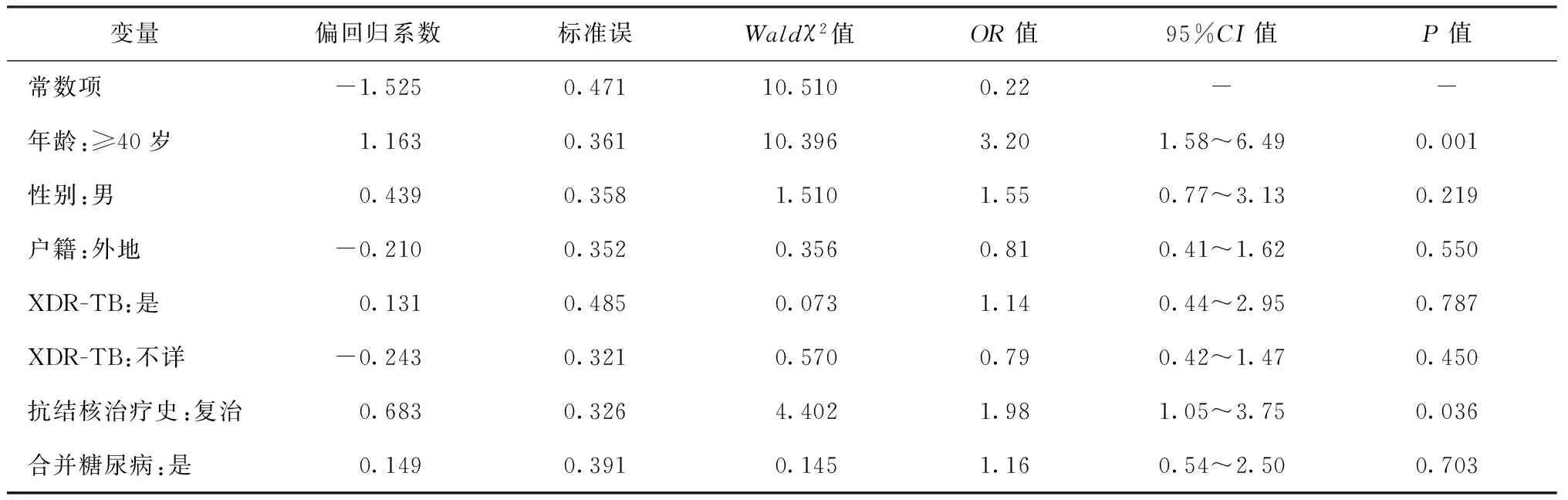
表6 耐多药肺结核患者不良转归多因素回归分析
注 “-”表示不必计算
讨 论
近年来耐药结核病疫情的上升给上海的结核病控制工作带来新的挑战[5]。上海市依托“三位一体”模式[4],加强“医防合作”,自2011年起建立了实验室“全面筛查”、专家组“统一定诊”、指定医院“定点治疗”、疾病预防控制中心和社区卫生服务中心“强化督导”、政府提供“减免治疗”的MDR-PTB防治管理模式,以提高MDR-PTB发现水平,规范诊断与治疗,加强治疗随访管理,提高治疗效果。经过3年多的探索与实践,这一模式取得了较好的成效,MDR-PTB患者治疗成功率达54.5%,与国际平均水平相当[1]。
WHO建议,各地区应该根据自身的技术能力和资源情况,确定MDR-PTB的筛查对象[10]。目前,我国MDR-PTB的筛查对象主要包括5类高危人群[6]。其中,治疗3个月末痰涂片仍阳性的初治涂阳患者和初治失败患者主要基于痰涂片结果来判定,因而疗程中痰涂片阴性而痰培养阳性的初治患者(非高危人群)不包括在内。各地研究报道均证实,高危人群筛查方式筛查效率高[11-14],是我国目前实验室诊断能力及资源经费相对有限的情况下恰当的MDR-PTB筛查方式。本研究结果也支持这一筛查策略,发现高危人群中MDR-PTB的检出率显著高于非高危人群(P<0.001)。但是,通过分析发现,采用全面筛查方式比高危人群筛查方式可多发现24.8%的MDR-PTB患者,还可提早治疗3个月末痰涂片仍阳性的初治涂阳患者和初治失败患者中的MDR-PTB患者(占全部MDR-PTB患者的21.5%)的发现时间并及时治疗。由此可见,虽然初治患者中MDR-PTB检出率较低,但是由于初治患者基数大,初治患者中发现MDR-PTB的例数也多,可达全部MDR-PTB患者例数的1/2左右。在条件允许的情况下,“全面筛查”将有助于提高MDR-PTB患者的发现水平,也将有助于缩短检出时间,达到早发现和早治疗的目的。
上海市建立的MDR-PTB防治管理模式取得了一定成绩:321例拟采用耐多药肺结核方案治疗的MDR-PTB患者中,96.6%的患者在社区医务人员的动员下接受抗结核药物治疗,远高于同时期全球基金项目报告的64.8%[14];MDR-PTB治疗成功率达到54.5%,与目前世界平均水平相当[1]。这些成绩可能归功于规范化的诊断与治疗、强化的督导管理,以及大力度的政府减免治疗。然而,目前的治愈水平距离WHO要求的2015年MDR-PTB治疗成功率达到75%[15]的目标还有很大距离,与某些国家和地区的水平也有不小差距[16-18]。这些项目取得的优异结果可能得益于更为积极的治疗策略,以及有效的提高患者依从性措施。本研究中,MDR-PTB患者丢失率高达12.3%。可能的原因在于MDR-PTB患者开始治疗后面临着生活和治疗上双重的经济困难[19],以及药物不良反应、长期肌内注射、服药等的痛苦与不便,难以支持长达2年的疗程。因此,在加强动员、争取每位患者接受治疗的同时,需进一步完善政府减免治疗及其他关怀支持政策,创新督导管理措施,丰富社区管理方式,提高患者的治疗依从性。此外,近年来研发的抗结核新药在临床试验中获得了较好的治疗结果,贝达喹啉已获美国FDA批准[20],德拉马尼(delamanid)已获欧盟批准[21]。我国也需加快抗结核新药的评价、审批、应用,为MDR-PTB、尤其是XDR-TB的控制提供有力支持。
本研究结果显示,复治MDR-PTB患者获得不良转归的风险是初治患者的1.98倍,与以往研究结果一致[16, 22-23]。Faustini 等[24]研究发现,复治患者患MDR-PTB的风险是初治患者的10倍。Dheda等[25]研究指出,MDR-PTB治疗史还是死亡的危险因素。复治患者可能存在依从性差、治愈信心下降、治疗疾病的动力不足等内在原因。因此,对于抗结核药物全敏感的患者应规范诊治,尽可能治愈患者,避免中断治疗和复发;而对于复治患者应作为重点对象加强督导管理,并提供心理支持等措施,提高治疗依从性和治疗效果。
本研究存在以下局限性:由于缺乏该模式实施前的历史资料,因此无法进行该模式实施效果的前后比较研究;由于未对MDR-PTB患者的经济负担状况资料进行收集、分析,政府减免治疗的效果有待进一步评价。
本研究显示,上海市建立的MDR-PTB防治管理模式在患者发现、诊断治疗、督导管理方面取得了一定成效,为“三位一体”背景下的耐多药肺结核防治管理模式提供了样本,可为全国其他城市地区的MDR-PTB防控工作提供借鉴。今后仍需进一步加强MDR-PTB患者的有效治疗和管理,一方面要优化完善相关措施提高患者治疗的依从性、减少丢失率,确保每位MDR-PTB患者能够接受治疗;另一方面对于治疗效果较差的高危人群,如复治MDR-PTB患者等,要深入分析治疗效果较差的原因和机制,采取相应措施;同时,还应推广耐药结核快速检测技术的应用,加快抗结核新药的评价与应用,以达到早期快速诊断和有效治疗的目标。
志谢 上海市耐多药肺结核防治管理模式的建立和运行得到了上海市耐多药肺结核病诊治、防控专家组,以及全市结核病定点医院、各区县CDC、社区卫生服务中心工作人员的大力支持。
[1] World Health Organization. Multidrug-resistant tuberculosis (MDR-TB) 2014 update. Geneva: World Health Organization, 2014.
[2] Zhao Y, Xu S, Wang L, et al. National survey of drug-resistant tuberculosis in China. N Engl J Med, 2012, 366(23):2161-2170.
[3] Falzon D, Jaramillo E, Schunemann HJ, et al. WHO guidelines for the programmatic management of drug-resistant tuberculosis: 2011 update. Eur Respir J, 2011, 38(3):516-528.
[4] 张胜年, 袁政安, 梅建, 等. 上海市“三位一体”结核病防治模式成效初探. 中国防痨杂志, 2007, 29(1):74-77.
[5] 李静, 张阳奕, 武洁, 等. 2007—2012年上海市结核病耐药趋势分析. 中国防痨杂志, 2014, 36(1):25-30.
[6] 王宇. 耐多药肺结核防治管理工作方案. 北京: 军事医学科学出版社, 2012.
[7] 肖和平. 耐药结核病化学治疗指南(2010年). 北京: 人民卫生出版社, 2011.
[8] 上海市卫生局, 上海市财政局. 关于下发《上海市耐多药肺结核病政府减免治疗费用办法》的通知. 2012-11-2.
[9] 上海市人民政府办公厅. 上海市人民政府办公厅转发市卫生局、市财政局制订的上海市菌阳肺结核病政府减免治疗办法的通知. 2003-11-11.
[10] World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis. Geneva: World Health Organization, 2008.
[11] 吴惠忠, 尹建军, 钟耐容, 等. 广东省全球基金耐多药结核病项目阶段性实施情况分析. 中国防痨杂志, 2013, 35(10):799-802.
[12] 周美兰, 陈梓, 王坚杰, 等. 武汉市耐多药肺结核防治项目患者发现和近期治疗效果分析. 中国防痨杂志, 2012, 34(5):299-303.
[13] 李海涛, 张修磊, 徐欣, 等. 山东省耐多药肺结核可疑者筛查情况分析. 中国医药科学, 2012, 2(17):121-122,164.
[14] 徐彩红, 马伟, 李仁忠, 等. 耐多药肺结核患者发现和纳入治疗情况分析. 中国预防医学杂志, 2014, 15(6):546-549.
[15] World Health Organization. The global plan to stop TB 2011—2015: Transforming the fight towards elimination of tuberculosis. Geneva: World Health Organization,2010.
[16] Leimane V, Dravniece G, Riekstina V, et al. Treatment outcome of multidrug/extensively drug-resistant tuberculosis in Latvia, 2000—2004. Eur Respir J, 2010, 36(3):584-593.
[17] Mitnick CD, Shin SS, Seung KJ, et al. Comprehensive treatment of extensively drug-resistant tuberculosis. N Engl J Med, 2008, 359(6):563-574.
[18] Chan PC, Huang SH, Yu MC, et al. Effectiveness of a government-organized and hospital-initiated treatment for multidrug-resistant tuberculosis patients—a retrospective cohort study. PLoS One, 2013, 8(2):e57719.
[19] 陈静, 魏晓林, 李洪娣, 等. 上海市流动人口肺结核病人接受治疗影响因素研究. 中国防痨杂志, 2009, 31(6):337-340.
[20] Diacon AH, Pym A, Grobusch MP, et al. Multidrug-resistant tuberculosis and culture conversion with bedaquiline. N Engl J Med, 2014, 371(8):723-732.
[21] Skripconoka V, Danilovits M, Pehme L, et al. Delamanid improves outcomes and reduces mortality in multidrug-resistant tuberculosis. Eur Respir J, 2013, 41(6):1393-1400.
[22] Tang S, Tan S, Yao L, et al. Risk factors for poor treatment outcomes in patients with MDR-TB and XDR-TB in China: retrospective multi-center investigation. PLoS One, 2013, 8(12):e82943.
[23] 郝晓晖, 姚岚, 唐神结, 等. 初治耐多药肺结核临床疗效及其转归队列分析. 中华传染病杂志, 2012, 30(3):157-161.
[24] Faustini A, Hall AJ, Perucci CA. Risk factors for multidrug resistant tuberculosis in Europe: a systematic review. Thorax, 2006, 61(2):158-163.
[25] Dheda K, Shean K, Zumla A, et al. Early treatment outcomes and HIV status of patients with extensively drug-resistant tuberculosis in South Africa: a retrospective cohort study. Lancet, 2010, 375(9728):1798-1807.
(本文编辑:范永德)
Effectiveness of an integrated multi-drug resistant pulmonary tuberculosis control model in Shanghai, China
WU Zhe-yuan*, ZHANG Qing, ZHANG Zu-rong, SHA Wei, XIAO He-ping, CHEN Jing, PAN Qi-chao, SHEN Xin, YUAN Zheng-an.
*Department of tuberculosis control, Shanghai Municipal Center for Disease Control and Prevention, Shanghai 200336, China
SHEN Xin, Email: shenxin@scdc.sh.cn; YUAN Zheng-an, Email: yuanzhengan@scdc.sh.cn
Objective To evaluate the effectiveness of an integrated multi-drug resistant pulmonary tuberculosis (MDR-PTB) control model in Shanghai from the aspects of patient detection, treatment, treatment outcomes and its associated factors and also medical cost reimbursement, in order to provide evidence for the improvement of MDR-PTB control model in metropolises of China. Methods An integrated MDR-PTB control model was implemented in 2011, composed of MDR-PTB patient detection, expert panel consultation and diagnosis, treating in designated hospitals, case management and medical cost reimbursement. From January 2011 to December 2013, all 21 402 registered pulmonary tuberculosis (PTB) patients were screened. 363 MDR-PTB patients (median age 42, interquartile range 28-55) were detected, among whom 168 were new patients and 195 were previously treated cases. 263 were males accounting for 72.5%. The effectiveness of full screening of all patients and only those MDR-PTB high-risk TB patients was compared. The expert panel designed chemotherapy regimen for each MDR-PTB patient. 58 new patients were treated with original regimen due to their favorable treatment reaction (e.g. the negative third month sputum smear) when MDR-PTB were confirmed. Totally, 321 patients, including 16 (15 failed and 1 was recurrent) from those using original regimen, were treated with MDR-PTB regimen and 96.6% (310/321) initiated treatment. Before 31 December 2014, 211 patients had discontinued treatment and were included in the analysis of treatment, treatment outcomes and its associated factors and also medical cost reimbursement. Results The proportions of MDR-PTB patients in high-risk group and non-high-risk group were 10.5% (273/2592) and 1.4% (90/6328) respectively. The difference was statistically significant (χ2=390.922,P<0.001). Ninety more MDR-PTB patients (24.8%) were detected in non-high-risk group accounting for 24.8%(90/363) of all MDR cases. Out of 58 patients who were treated with original regimen, 40 (69.0%) were cured. 54.5% (115/211) of those using MDR-PTB regimen were successfully treated. The treatment success rate in new and previously treated patients were 68.1% (49/72) and 47.5% (66/139) respectively. The difference was statistically significant (χ2=8.096,P=0.004). In a logistic model, age≥40 (OR=3.20,95%CI=1.58-6.49,P=0.001) and previously treated (OR=1.98,95%CI=1.05-3.75,P=0.036) were independently associated with poor treatment outcomes. The average medical cost for a MDR-PTB patient was 17 000 RMB and the imbursement offered by the government reached 12 800 RMB. Conclusion The integrated MDR-PTB control model implemented in Shanghai has achieved some effectiveness. It is still essential to improve case management and utilize advanced diagnosis techniques and novel drugs to ensure the early and effective treatment.
Tuberculosis, pulmonary/drug therapy; Drug resistance, multiple, bacterial; Mass screening; Clinical protocols; Shanghai
10.3969/j.issn.1000-6621.2015.11.008
“十二五”国家科技重大专项(2013ZX10004903;2013ZX10003009);上海市卫生系统优秀人才培养计划(XYQ2011051)
200336上海市疾病预防控制中心结核病防治科(吴哲渊、张祖荣、陈静、潘启超、沈鑫、袁政安);同济大学附属上海市肺科医院结核科(张青、沙巍、肖和平)
注:吴哲渊与张青对本研究具有同等贡献,为并列第一作者
沈鑫,Email: shenxin@scdc.sh.cn;袁政安,Email: yuanzhengan@scdc.sh.cn
2015-07-09)

