BiPAP联合噻托溴铵对老年COPD稳定期患者的疗效及对肺功能、前清蛋白和炎性因子水平的影响
刘 茵,孙 林,艾 伟,周红兵,夏 敏
0 引言
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种高发病率和致死率的呼吸系统疾病,具有慢性气流阻塞的特征,病程时间长,并且可出现进行性发展,严重威胁人类健康[1]。目前COPD位居全球死因的第4位,且患病人群多以中老年人为主[2]。噻托溴铵是COPD稳定期的一线临床应用药物,也是美国胸科学会/欧洲呼吸学会指南推荐的Ⅱ级以上COPD患者使用的药物。但临床实践发现,单纯支气管扩张剂的治疗效果十分有限,且易导致病情反复,难以满足患者的需求,且常对生活质量产生较大影响[3]。因此探索有效的治疗措施,以促进COPD患者肺功能改善和临床症状是亟待解决的重要课题。双水平气道正压通气(Bi-level positive airway pressure,BiPAP)是近年来治疗COPD的一种新方法,可通过提供吸气辅助,把患者的潮气量“加大”,减少呼吸肌做功,使其得以充分休息,进而加速病情的恢复[4]。本研究拟以我院诊治的78例老年稳定期COPD患者为研究对象,探讨BiPAP联合噻托溴铵的临床应用疗效及其对肺功能、前清蛋白(Prealbumin,PAB)和炎性因子水平的影响,现报道如下。
1 资料与方法
1.1 临床资料 选择2009年4月至2013年12月于我院呼吸内科诊治的78例老年COPD患者为研究对象,年龄61~78岁,平均(63.32±7.29)岁,男42例,女36例;COPD的诊断标准严格按照中华医学会呼吸病学分会COPD组编订的《COPD诊治指南(2007年修订版)》执行[5]。纳入标准:①所有患者均经病史、临床症状、体征及检查结果确诊,且均为稳定期Ⅱ级(中度)及其以上;②经治疗后FEV1/FVC<70%且FEV1占预计值的百分比为 30% ~70%;③入选前4周内均未出现COPD的急性加重,且未使用长效支气管扩张剂2周及以上或短效支气管扩张剂48 h以上;④血、尿常规、心电图检查等无明显异常;⑤对本项目知情同意且依从性良好。排除标准:①有哮喘或结核病史、肺部手术病史或其他严重的呼吸系统疾病;②出现咳嗽、咯痰、呼吸困难等COPD急性加重前期症状等;③合并如心肌梗死、心衰等心脑血管系统疾病和糖尿病、高血压等慢性疾病;④对噻托溴铵或BiPAP使用有禁忌证者。
将患者按随机数字表法分为噻托溴铵组和BiPAP+噻托溴铵组(联合组),每组39例。两组患者年龄、性别、体重、心率及吸烟史等比较差异均无统计学意义(P>0.05)。见表1。
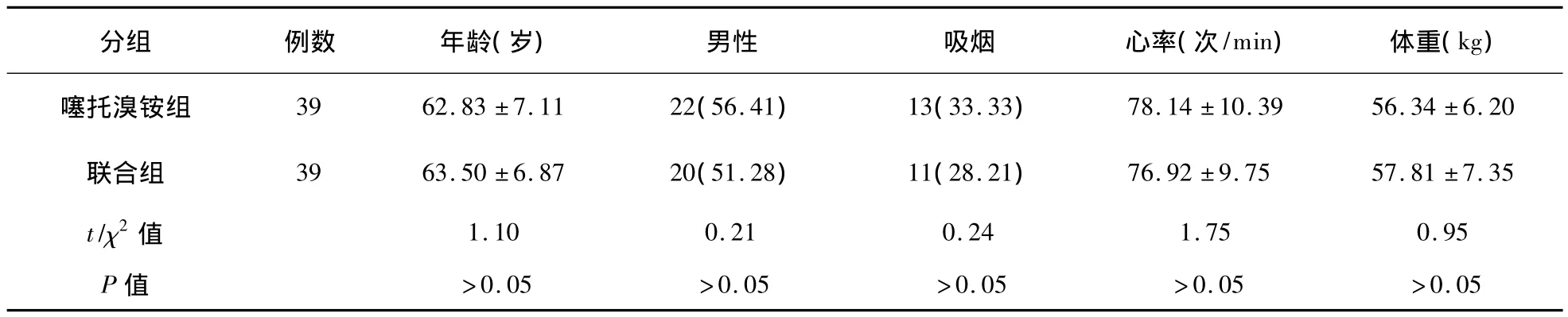
表1 两组患者一般临床资料比较(例,%)
1.2 治疗方法 两组患者均予以常规氧疗,其中噻托溴铵组患者给予噻托溴铵粉吸入剂18 μg(德国勃林格殷格翰公司,商品名:思力华,批准文号:H20050268),1次/d吸入治疗,疗程持续12周。而联合组则在此基础上同时利用BiPAP无创机械通气,采取S-T通气模式,呼吸频率调节至12~16次/min,氧流量5 L/min,吸气压力8~18 cmH2O,呼气压力4~6 cmH2O。每日通气时间选择在夜间或午休时,治疗时间累积在8 h以上,疗程持续12周。
1.3 生活质量评分、呼吸困难分级和COPD评估测试 采用圣乔治医院呼吸问题调查问卷(St.George respiratory questionnaire,SGRQ)评估患者的生活质量[6]。调查问卷包括症状维度、活动维度和影响维度3个维度,每个维度分别计0~100分,患者的分值越高则反映其生活质量水平越低。评分过程采取盲法并由专职人员在2 h内完成。
呼吸困难分级采用英国医学研究委员会呼吸困难分级评分(中文版)进行评估[7],0分:剧烈活动时感到呼吸困难;1分:快步行走或行走于斜坡时感到呼吸困难;2分:较多数人慢的速度行走于平地时感到呼吸困难;3分:在平地上停止行走数分钟后仍感到呼吸困难;4分:因呼吸困难导致无法出门甚至在进行轻微活动时也感觉呼吸困难。采用COPD疾病评估测试(COPD Assessment Test,CAT)问卷[8]对患者予以咳嗽、咳痰、胸闷、睡眠、精力、情绪和运动、耐力8个方面的评估。依据患者的病情对每个项目做出评分:即轻微影响0~10分,中等影响11~20分,严重影响21~30分,非常严重影响31~40分。
1.4 肺功能及血气分析 采用日本福田株式会社生产的St-75肺功能仪和由北京普朗新技术有限公司提供的诺瓦血气分析仪,分别对两组患者的肺功能和血气分析指标进行检测。肺功能检测指标包括:1秒用力呼气容积(FEV1)、FEV1占预计值百分比(FEV1%pre)、FEV1占用力肺活量比值(FEV1/FVC)。血气分析指标包含:动脉血氧分压(PaO2)和血二氧化碳分压(PaCO2)。
1.5 炎性因子、超敏C-反应蛋白(hs-CRP)和前清蛋白水平测定 分别于治疗前后抽取两组患者的清晨空腹静脉血,采用酶联免疫吸附试验法(Enzyme-linked immunosorbent assay,ELISA)测定炎性因子白细胞介素(IL)-4、IL-6、IL-8、IL-10、肿瘤坏死因子 α(Tumor necrosis factor-α,TNF-α)和前清蛋白的水平。白细胞介素和TNF-α的ELISA试剂盒均购自于深圳晶美生物工程有限公司,前清蛋白(Prealbumin,PAB)的检测试剂盒则由北京艾然生物科技有限公司提供。ELISA的检测过程严格按照说明书要求由专业检测人员操作完成。hs-CRP水平则利用胶乳增强免疫透射比浊法测定,试剂盒由杭州华得森生物科技有限公司提供。
1.6 统计分析 所有数据采用SPSS 17.0软件进行分析和整理。计量资料采取±s表示,两组间的比较应用独立样本的t检验,治疗前后的组内比较则采用配对t检验;计数资料以率和构成比表示,组间比较利用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后生活质量评分比较 如表2所示,治疗前,两组患者生活质量评分的症状维度、活动维度和影响维度比较,差异无统计学意义(P>0.05);治疗后,两组患者的生活质量三个维度评分均降低(P<0.05),且联合组患者的改善效果更为明显(t症状维度=8.51,P < 0.01;t活动维度=4.26,P <0.05;t影响维度=5.26,P <0.01)。

表2 两组患者治疗前后生活质量评分比较
2.2 两组患者治疗前后呼吸困难分级和CAT评分 如表3所示,治疗前,两组患者的呼吸困难分级和CAT评分值比较,差异无统计学意义(P>0.05);治疗后,两组患者的呼吸困难分级和CAT评分值均明显降低(P<0.05),且联合组治疗后的CAT分值明显低于单独噻托溴铵组(t=4.16,P<0.05),而呼吸困难分级得分两组间比较则无明显差别(t=1.03,P >0.05)。
2.3 两组患者治疗前后肺功能指标比较 如表4所示,治疗前两组患者3项肺功能指标比较差异无统计学意义(P>0.05);治疗后,FEV1、FEV1%pre和FEV1/FVC均升高(P<0.05),且与噻托溴铵组比较,联合组肺功能各项指标改变更为显著(tFEV1=5.15,P <0.01;tFEV1%pre=8.26,P <0.01;tFEV1%pre=7.26,P <0.01)。
2.4 两组患者治疗前后血气分析指标比较 如表5所示,治疗前两组患者的PaO2和PaCO2比较差异无统计学意义(P>0.05);治疗后,PaO2和PaCO2均呈现不同程度的改善(P<0.05);且联合组的PaO2和PaCO2变化幅度明显优于噻托溴铵组(tPaO2=10.58,P < 0.01;tPaCO2=7.56,P <0.01)。
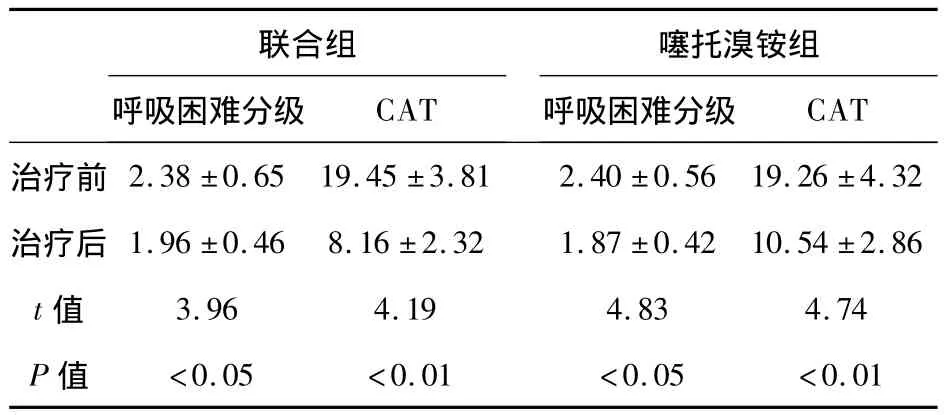
表3 两组患者治疗前后呼吸困难分级和CAT评分比较
2.5 两组患者治疗前后炎性因子相关指标和PAB水平比较 如表6所示,治疗前两组患者炎症因子和PAB比较差异均无统计学意义(P>0.05);治疗后,IL-4、IL-6、IL-8、TNF-α 和 hs-CRP均降低,而PAB和IL-10则显著升高(P<0.05);且联合组患者上述指标的改善程度明显优于噻托溴铵组(P<0.05)。
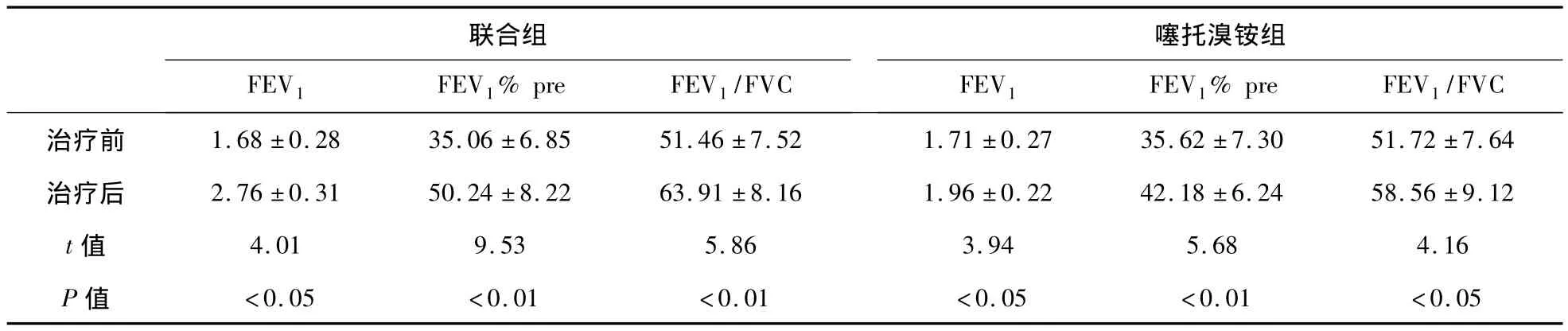
表4 两组患者治疗前后肺功能指标比较

表5 两组患者治疗前后血气分析指标比较
3 讨论
COPD是一种进展型的呼吸系统疾病,随着疾病进程的推延,患者的气道气流受限会逐渐加重,肺功能和血液氧供给也会相应下降,尤其是对于免疫力和抵抗力均低下的老年患者而言更是如此。因此,对COPD患者的长期监测和治疗成为防止疾病恶化的重要举措[9]。当前,针对稳定期COPD患者的治疗经常采用长效抗胆碱能药物噻托溴铵,每日吸入1次即可获得约24 h的持续支气管扩张作用,临床疗效明显且患者的依从性和耐受性均良好[10]。本研究结果也显示,单独噻托溴铵治疗组患者在持续12周的治疗疗程结束后,肺功能和血气分析指标均较治疗前明显改善,而且生活质量、CAT及呼吸困难分级得分也均有所好转。这一结果再次印证了噻托溴铵是COPD稳定期患者治疗的理想用药。然而,在临床实践中,虽然长效抗胆碱能药物的使用能够在一定程度上缓解COPD患者的临床症状,但该方式仍不足以满足患者的需求,肺功能的降低、供氧不足和呼吸不畅给患者的生活造成了诸多不良的影响。因此,本研究在应用噻托溴铵的基础上采取Bi-PAP辅助进行治疗。BiPAP是一种经鼻面罩双水平气道正压通气的无创通气模式,能够改善肺泡的通气功能,增加通气量和潮气量,增加血氧的浓度和肺顺应性,促使PaCO2的降低,同时对呼吸肌群提供帮助,减少呼吸肌的收缩或舒张,保障其充分休息,以加速COPD患者肺功能的恢复。本研究结果也充分显示,BiPAP联合噻托溴铵组患者的肺功能、血气分析指标、CAT及生活质量评分的改善程度更为显著,表明BiPAP联合噻托溴铵的治疗策略效果更佳,对于减缓COPD的进展速度或急性复发具有良好的作用。更为重要的是,Bi-PAP是无创通气,可避免部分患者因病情加重而运用气管插管,而且该方式经济适用,对减轻患者疾病负担也有重要作用。
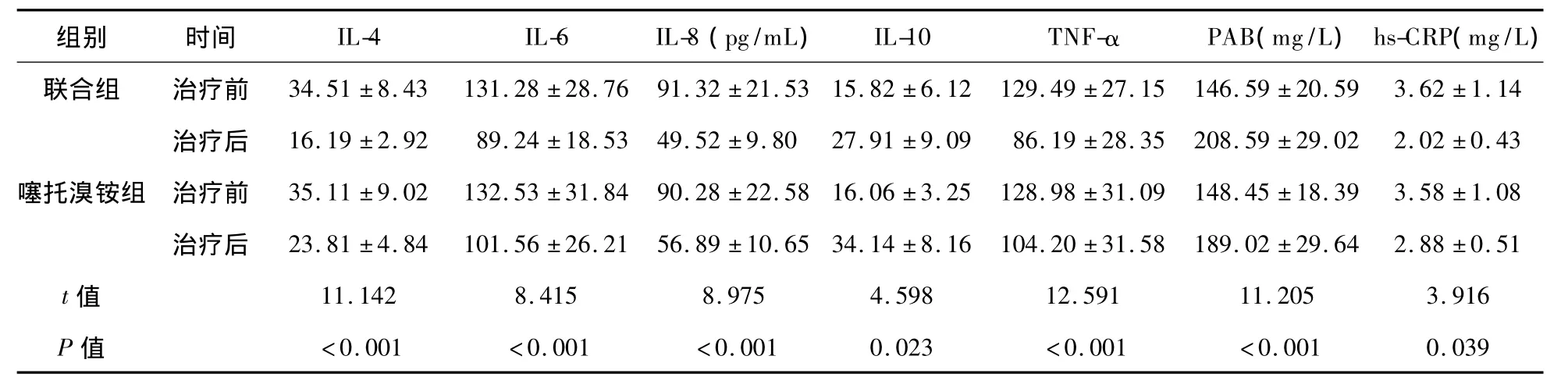
表6 两组患者治疗前后炎性因子相关指标和PAB水平比较(ng/L)
研究表明,COPD并不是单纯的呼吸系统疾病,而是具有广泛性肺外损伤的全身性疾病,其中最为显著的全身效应就是炎症反应[11]。目前已发现的COPD的全身慢性炎症反应包括炎症细胞(如中性粒细胞)、巨噬细胞及T淋巴细胞浸润,IL-4、IL-6、IL-8和 TNF-α 释放。相似的炎症反应也同样在全身的血液循环中发现,如血液炎症标志物hs-CRP水平的升高等[12-13]。IL-10则是一种抗炎性因子,发挥下调炎症反应和拮抗炎性介质的作用。本研究结果显示,在COPD患者血液中IL-4、IL-6、IL-8、TNF-α 和 hs-CRP 的含量增加,IL-10水平下降,提示稳定期COPD患者同样具有一定的炎症反应。本研究结果显示,治疗后两组患者的上述指标水平均明显下降,而且BiPAP联合噻托溴铵的改善幅度明显优于单独噻托溴铵治疗组,表明BiPAP在改善肺功能的同时,也可以通过干预机体的循环过程减轻全身的炎症反应。另外,PAB也是急性时相反应的一个极为敏感的指标之一,与白细胞总数、中性粒细胞百分比等反映炎症的指标相比,具有辅助诊断和快速检测的特征。在急性COPD发作期,炎症反应会消耗大量的PAB,导致氧合能力下降[14]。因此,本研究也对比检测了PAB的变化水平。结果显示,治疗后两组患者的PAB水平均逐步恢复,而且BiPAP联合噻托溴铵的升高趋势更明显,表明该治疗方式也具有纠正血清低PAB的作用。
综上所述,本研究结果发现,BiPAP联合噻托溴铵对老年稳定期COPD患者具有明显的临床疗效,且能够改善肺功能及血气分析指标,降低炎症反应和纠正低PAB血症。
[1] Vestbo J,Hurd SS,Agustí AG,et al.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease:GOLD executive summary[J].Am J Respir Crit Care Med,2013,187(4):347-365.
[2] De Marco R,Pesce G,Marcon A,et al.The coexistence of asthma and chronic obstructive pulmonary disease(COPD):prevalence and risk factors in young,middle-aged and elderly people from the general population[J].PLoS One,2013,8(5):e62985.
[3] Beier J,Kirsten AM,Mróz R,et al.Efficacy and safety of aclidinium bromide compared with placebo and tiotropium in patients with moderate-to-severe chronic obstructive pulmonary disease:results from a 6-week,randomized,controlled Phase IIIb study[J].COPD,2013,10(4):511-522.
[4] Yazici M,Uzun K,Ulgen MS,et al.The acute effect of bi-level positive airway pressure on heart rate variability in chronic obstructive pulmonary disease patients with hypercapnic respiratory failure[J].Anadolu Kardiyol Derg,2008,8(6):426-430.
[5] 中华医学会呼吸病学会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南[J].中华内科杂志,2007,46(3):254-261.
[6] Tafti SF,Cheraghvandi A,Mokri B,et al.Validity and specificity of the Persian version of the Saint George Respiratory Questionnaire[J].J Asthma,2011,48(6):589-592.
[7] 刘欣欣,王浩彦.慢性阻塞性肺疾病呼吸困难评价[J].心肺血管病杂志,2007,26(1):59-61.
[8] Lee SD,Huang MS,Kang J,et al.The COPD assessment test(CAT)assists prediction of COPD exacerbations in high-risk patients[J].Respir Med,2014,108(4):600-608.
[9] Karbasi-Afshar R,Aslani J,Ghanei M.Efficacy and safety of inhaler steroids in COPD patients:Systematic review and metaanalysis of randomized placebo-controlled trials[J].Caspian J Intern Med,2014,5(3):130-136.
[10] Wise RA,Anzueto A,Cotton D,et al.TiotropiumRespimat inhaler and the risk of death in COPD[J].N Engl J Med,2013,369(16):1491-1501.
[11] Singh R,Mackay AJ,Patel A,et al.Inflammatory thresholds and the species-specific effects of colonising bacteria in stable chronic obstructive pulmonary disease[J].Respir Res,2014,15(1):114.
[12] Bade G,Khan MA,Srivastava AK,et al.Serum cytokine profiling and enrichment analysis reveal the involvement of immunological and inflammatory pathways in stable patients with chronic obstructive pulmonary disease[J].Int J Chron Obstruct Pulmon Dis,2014,5(9):759-773.
[14] 孔令霞,李晓辕,徐建国.COPD合并2型糖尿病患者血清高敏C反应蛋白及前清蛋白水平的变化[J].中国老年学杂志,2013,33(5):1043-1044.

