吉西他滨联合立体定向放疗对局部晚期胰腺癌效果
郭建平,李珞
(1 淄博市妇幼保健院肿瘤科,山东 淄博 255021; 2 淄博市中心医院科研办公室)
吉西他滨联合立体定向放疗对局部晚期胰腺癌效果
郭建平1,李珞2
(1 淄博市妇幼保健院肿瘤科,山东 淄博 255021; 2 淄博市中心医院科研办公室)
目的 评价吉西他滨联合立体定向放射治疗局部晚期胰腺癌的效果及安全性。方法 局部晚期胰腺癌病人37例,其中接受吉西他滨化疗联合立体定向放疗(联合组)18例,仅接受吉西他滨化疗(化疗组)19例。所有病人随访4~24个月,观察近期疗效、远期疗效及不良反应发生情况。结果 联合组和化疗组近期有效率分别为77.8%、36.8%,两组疗效比较差异有显著性(uc=2.542,P<0.05)。联合组病人中位总生存时间为13.8个月,化疗组为9.5个月。两组不良反应发生率差异无显著性(P>0.05)。结论 吉西他滨联合立体定向放射治疗局部中晚期胰腺癌能提高局部控制率,延长总生存时间,且具有很高安全性。
胰腺肿瘤;放射疗法,计算机辅助;立体定位技术;药物疗法
胰腺癌早期症状不典型,大多数病人就诊时已属中晚期,大约40%的晚期胰腺癌为不能手术切除的局部晚期胰腺癌[1],单纯放疗或化疗治疗效果均不理想。吉西他滨治疗胰腺癌效果肯定,又有放射增敏作用[2]。美国国立综合癌症网络(NCCN)已将吉西他滨归入晚期胰腺癌化疗的一线用药。立体定向放疗可提高放疗增益比。2011年 5月—2013年 9月,我科应用吉西他滨化疗,或吉西他滨化疗联合陀螺旋转式立体定向放射治疗局部晚期胰腺癌37例,本文对其临床资料进行回顾性分析,评价吉西他滨联合陀螺旋转式立体定向放射治疗局部晚期胰腺癌的效果及安全性。
1 资料与方法
1.1一般资料
经病理证实的局部晚期胰腺癌病人37例,其中采用陀螺旋转式立体定向放疗联合吉西他滨化疗者18例(联合组),仅接受吉西他滨单药化疗者19例(化疗组)。入选标准:①经CT、MRI检查或手术证实为不能手术切除的局部晚期胰腺癌病人;②卡氏评分(KPS)≥70分;③有临床可测量或可评估的病灶;④预计生存期>3个月;⑤血常规和肝肾功能检查证实能耐受放化疗,能耐受固定体位20 min以上;⑥病人同意接受本研究。两组病人一般资料比较差异无显著性(P>0.05)。见表1。
1.2治疗方法
1.2.1化疗 化疗组方案:吉西他滨 1 g/m2静滴 30 min,第 1、8、15天执行,28 d为 1周期,共化疗2~6周期。联合组首程采用同步化疗,具体方案为:吉西他滨 0.5 g/m2静滴 30 min,放疗治疗开始第 1、8天执行,放疗结束3周后开始序贯化疗,方案同化疗组,共2~6周期。化疗期间检测两组血常规、血生化,监测不良反应,治疗期间每月复查胸腹部、颅脑CT或MRI,发现病情进展时停止化疗。
1.2.2放疗 采用陀螺旋转式立体定向放疗定位计划系统。病人禁食4~6 h,定位前口服15 g/L泛影葡胺约500 mL,立体定位体架内置真空负压垫体模,病人仰卧其中,双手上举握住头顶上方握杆,抽气固定,画体表标记并记录三维坐标。扫描时快速静脉注射碘海醇约100 mL,采用12排螺旋CT扫描,层厚为3 mm,扫描完成后将图像传输至三维治疗计划系统,由医师勾画肿瘤靶区(GTV)及危及器官靶区,计划靶区(PTV)为GTV均匀外扩1 cm。物理师制定治疗计划,使50%等剂量线覆盖100%的PTV,70%等剂量线覆盖80%以上的GTV。全组PTV周边剂量为365~420 kGy,中位处方剂量为390 kGy,每次28 kGy,每周5次,共13~15次,模拟后进行治疗。重要组织器官受照射剂量均控制在其耐受量之下。
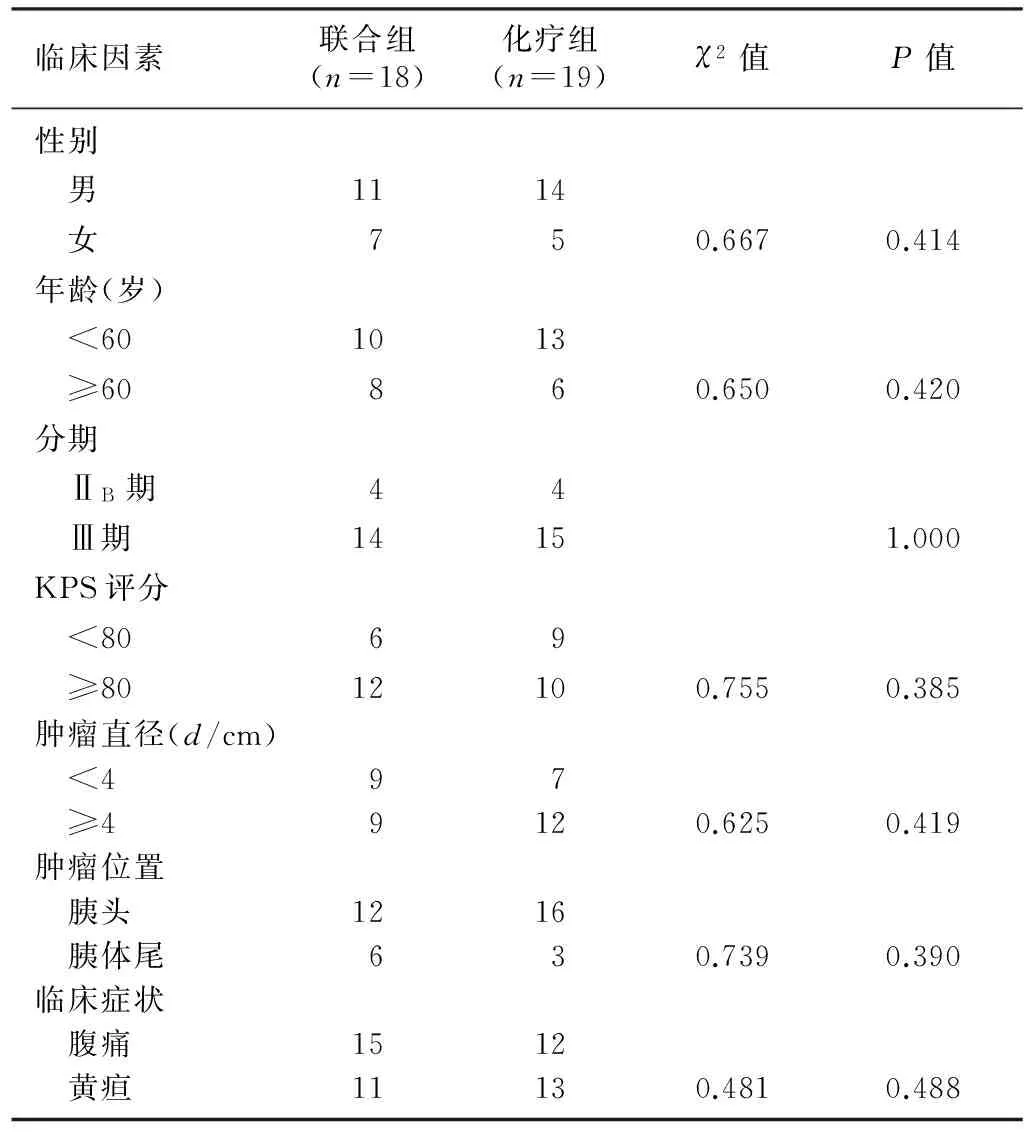
表1 两组一般资料比较(例)
1.3疗效评价
1.3.1近期疗效 治疗结束后3个月,病人行胸腹部、颅脑CT或MRI复查,观察病灶体积变化及有无新发病灶,采用WHO的分类标准进行近期疗效评定。①完全缓解(CR):所有可测量的病灶完全消失;②部分缓解(PR):所有可测量的病灶缩小≥50%;③稳定(SD):病灶缩小<50%,或增大未超过25%;④进展(PD):1个或多个病灶增大≥25%,或出现新的病变。CR+PR+SD为治疗有效。
1.3.2远期疗效 病人随访4~24个月,中位时间11.6个月,随访率为100%。所有病人治疗开始后每月复查1次,治疗结束后第1年每3个月复查1次,第2年起至少每6个月复查1次。复查项目包括胸腹部、颅脑CT或MRI。记录无进展生存时间(PFS)和总生存时间(OS)。
1.3.3不良反应 观察治疗期间病人不良反应,主要包括消化道反应、骨髓抑制、肝功能损害等,参照RTOG标准分1~4级[1]。
1.4统计学分析
应用SPSS 13.0软件进行统计学处理,等级资料比较采用秩和检验;应用Kaplan-Meier方法计算PFS和OS,并用Log-rank检验比较两组间差异。
2 结 果
2.1两组近期疗效比较
两组病人均完成治疗计划。联合组CR者0例,PR者4例,SD者10例,PD者4例,总有效率为77.8%;化疗组CR者0例,PR者1例,SD者6例,PD者12例,总有效率为36.8%,两组疗效比较差异有显著性(uc=2.542,P<0.05)。
2.2两组远期疗效比较
联合组中位OS为13.8个月,化疗组中位OS为9.5个月,两组生存率曲线比较差异有显著意义(χ2=0.757,P<0.05)。联合组中位PFS为9.0个月,化疗组为7.0个月,两组比较差异无显著意义(χ2=0.468,P>0.05)。见图1、2。
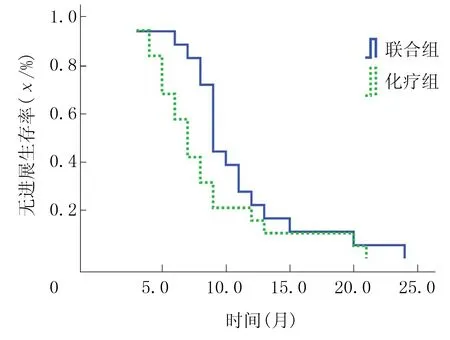
图1 两组病人PFS图
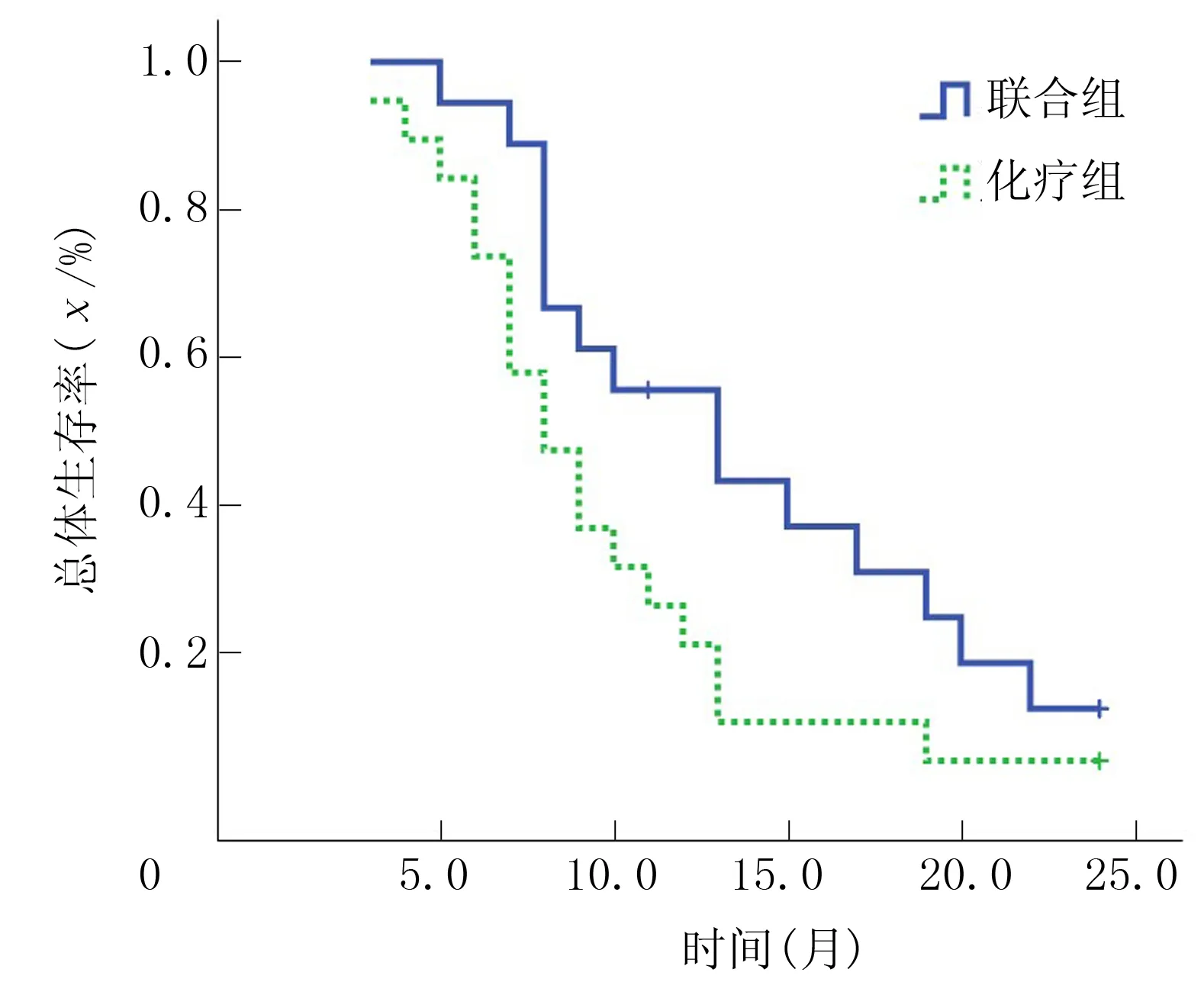
图2 两组病人OS图
2.3两组不良反应比较
两组病人治疗期间主要的不良反应包括消化道反应、骨髓抑制、肝功能损伤等,多数反应较轻,无4级毒性反应。两组均未见消化道穿孔、大出血等严重并发症发生。两组病人不良反应比较,差异无显著性(P>0.05)。见表2。
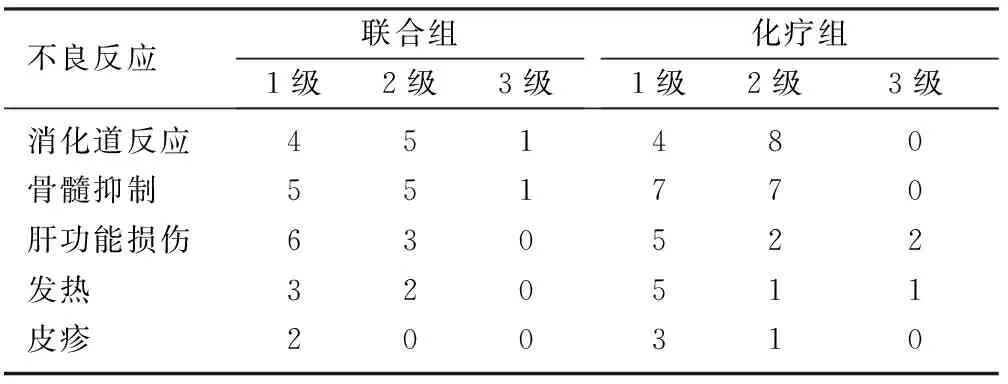
表2 两组主要不良反应比较(例)
3 讨 论
胰腺癌恶性程度高,一般不治生存期6~12个月,胰头癌更短,病人常由于梗阻性黄疸造成肝损害死亡。胰腺癌治疗效果极差,5年总的生存率仅为2%~3%[3]。刘东波等[4]认为,Syndecan-1和E-cadherin在胰腺癌的发生发展中起重要作用,其表达水平可作为判断胰腺癌生物学行为的参考指标。胰腺癌对放疗的敏感度不高,且胰腺毗邻多个放射耐受较差器官,常规放疗无法给予根治性剂量。ALLEN 等[5]研究结果显示,常规放疗联合吉西他滨化疗最大耐受量仅为39 Gy。
陀螺旋转式立体定向放疗系统是目前世界上最先进的精确放疗设备之一,它采用了航天陀螺仪的旋转原理。陀螺旋转三次聚焦形成的特有的“陀螺峰”剂量场,超越了质子和重离子的“布拉格峰”形成的剂量场,使靶区剂量分布更为合理,病变组织接受更高剂量射线照射,减少正常组织受辐照剂量,可以更加优化治疗计划。因此,显著提高了治疗效果,降低了放疗不良反应的发生率和损伤程度。本文结果显示,联合组应用陀螺旋转式立体定向放疗并未增加病人不良反应;随访期间未出现放射性肝炎、肠道梗阻、肠道穿孔、脊髓坏死等严重晚期并发症。
目前,以吉西他滨为基础的同步放化疗已成为局部晚期胰腺癌的标准治疗方案[3]。美国ASCO 2005年和2006年报道的几项临床研究结果显示,晚期胰腺癌联合化疗效果并不优于吉西他滨单药治疗。STEFAN等[6]研究认为,采用吉西他滨或紫杉醇的一线联合方案治疗晚期胰腺癌是一个有效的、可管理的选择。KE等[7]研究认为,吉西他滨联合S1维持治疗对于局部晚期胰腺癌耐受性好,有希望成为标准治疗方案。HERRMANN等[8]随机Ⅲ期临床研究结果显示,与吉西他滨单用组比较,吉西他滨与卡培他滨联用治疗晚期局限性或转移性胰腺癌并未能进一步提高病人的生存期。STATHOPOULOS等[9]随机Ⅲ期对照研究比较了晚期胰腺癌病人吉西他滨单用或与伊立替康联用效果,结果显示在改善生存率方面联合化疗并无优势。众多研究表明,吉西他滨与放疗并用时有协同作用。吉西他滨对人胰腺癌细胞BXPC-3有放射增敏作用,其主要机制可能是:①影响细胞周期的再分布,主要是S期阻滞;②引起凋亡相关基因表达的改变,其中Bax基因表达增高,而Bcl-2基因表达下降[10]。蓝川[11]研究结果显示,放疗联合吉西他滨化疗治疗胰腺癌,原发灶控制效果明显好于单纯放疗,症状和一般状况改善也较为明显,无严重不良反应,长期存活率也较传统疗法更高。林根来等[12]研究结果显示,吉西他滨局部化疗联合三维适形放射治疗,能够提高局部晚期胰腺癌近期疗效,并延长中位生存期。郑伟等[13]报道,放疗联合吉西他滨治疗胰腺癌能够显著延长PFS,但不能改善OS。于会明等[14]研究显示,放疗联合吉西他滨治疗胰腺癌可以改善相关症状,但不能改善OS。本文研究结果显示,联合组与化疗组病人PFS差异无显著性,但联合组OS长于化疗组;两组常见的不良反应是消化道反应、骨髓抑制和肝功能损害,但病人均能耐受,两组不良反应发生率比较差异无显著性。但吉西他滨化疗联合放疗时,仍需注意血液系统不良反应。
本文病例数不多,所用吉西他滨化疗方案与文献报道也有差别;本文采用陀螺旋转式立体定向放疗照射剂量、分割次数等与相关文献报道也不一致。穆晓峰等[15]认为,由于放疗分割模式及治疗理念不同,在胰腺癌同步放化疗过程中吉西他滨的应用剂量有较大差异,疗效也不尽相同。此外,本文为回顾性研究。因此,需更大样本的随机对照研究来进一步评判吉西他滨化疗或联合陀螺旋转式立体定向放射治疗局部晚期胰腺癌的效果及副作用。
[1] PARKER S L, TONG T, BOLDEN S, et al. Cancer statistics, 1996[J]. CA-A Cancer Journal for Clinicians, 1997,47(1):5-27.
[2] BLACKSTOCK A W, MORNEX F, PARTENSKY C, et al. Adjuvant gemcitabine and concurrent radiation for patients with resected pancreatic cancer: a phase Ⅱ study[J]. British Journal of Cancer, 2006,95(3):260-265.
[3] 殷蔚伯. 肿瘤放射治疗学[M]. 4版. 北京:中国协和医科大学出版社, 2008:840-1145.
[4] 刘东波,李玉军,李宏,等. 胰腺癌组织Syndecan-1与E-cadherin表达及意义[J]. 齐鲁医学杂志, 2011,26(4):305-307.
[5] ALLEN A M, ZALUPSKI M M, ROBERTSON J M, et al. Adjuvant therapy in pancreatic cancer: phase Ⅰ trial of radiation dose escalation with concurrent full-dose gemcitabine[J]. International Journal of Radiation Oncology Biology Physics, 2004,59(5):1461-1467.
[6] STEFAN B, MICHAEL H, STEPHAN K, et al. Long-term progression-free survival in a metastatic pancreatic cancer patient treated with first-line nab-paclitaxel and gemcitabine[J]. In Vivo, 2014,28(6):1189-1192.
[7] KE Q H, ZHOU S Q, YANG J Y, et al. S-1 plus gemcitabine chemotherapy followed by concurrent radiotherapy and maintenance therapy with S-1 for unresectable pancreatic cancer[J]. World Journal of Gastroenterology, 2014,20(38):13987-13992.
[8] HERRMANN R, BODOKY G, RUHSTALLER T, et al. Gemcitabine plus capecitabine compared with gemcitabine alone in advanced pancreatic cancer: a randomized, multicenter, phase Ⅲ trial of the Swiss group for clinical cancer research and the central european cooperative oncology group[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2007,25(16):2212-2217.
[9] STATHOPOULOS G P, SYRIGOS K, ARAVANTINOS G, et al. A multicenter phase Ⅲ trial comparing irinotecan-gemcitabine (IG) with gemcitabine (G) monotherapy as first-line treatment in patients with locally advanced or metastatic pancreatic cancer[J]. British Journal of Cancer, 2006,95(5):587-592.
[10]李显桃,赵洪瑜,王燕,等. 吉西他滨对人胰腺癌细胞系BXPC-3的放射增敏作用及其机制探讨[J]. 山东医药, 2011,51(21):62-63.
[11]蓝川. 放射治疗联合药物化疗治疗局部晚期胰腺癌的临床分析[J]. 中国医药指南, 2013,11(2):231-232.
[12]林根来,曾昭冲,吴铮,等. 吉西他滨局部化疗联合或不联合三维适形外放疗治疗局部晚期胰腺癌的临床观察[J]. 临床肿瘤学杂志, 2012,17(3):240-245.
[13]郑伟,聂青,康静波,等. 立体定向放疗联合吉西他滨治疗胰腺癌的临床观察[J]. 临床肿瘤学杂志, 2011,16(11):995-1000.
[14]于会明,刘运芳,于金明. 三维适形放疗联合吉西他滨治疗局部晚期胰腺癌的疗效分析[J]. 中华放射肿瘤学杂志, 2006,15(1):55-56.
[15]穆晓峰,王迎选,宁健,等. 低分割高剂量适形放疗同步吉西他滨治疗胰腺癌的Ⅰ期临床研究[J]. 临床肿瘤学杂志, 2011,16(7):630-633.
(本文编辑 黄建乡)
GEMCITABINE COMBINED WITH STEREOTACTIC RADIOTHERAPY FOR LOCALLY ADVANCED PANCREATIC CANCER
GUOJianping,LILuo
(Department of Oncology, Maternal and Child Health Hospital of Zibo, Zibo 255021, China)
ObjectiveTo evaluate the efficacy and safety of gemcitabine combined with stereotactic radiotherapy for locally advanced pancreatic cancer (LAPC).MethodsThirty-seven patients with LAPC were enrolled in this study,18 of them received combined therapy (combined group), and 19 were given chemotherapy only (chemotherapy group). All the patients were followed 4-24 months. The local control rate, long-term efficacy and adverse reaction rates were assessed.ResultsThe local control rate in the combined therapy group was 77.8% vs. 36.8% in the chemotherapy group, the difference between the two groups was significant (uc=2.542,P<0.05). The median overall survival time in the combined group was 13.8 months, and that in the chemotherapy group was 9.5 months. There was no significant difference between the two groups with regard to adverse reactions (P>0.05).ConclusionGemcitabine chemotherapy plus stereotactic radiotherapy can raise local control rate in the treatment of locally advanced pancreatic cancer with prolongation of overall survival time and high safety.
pancreatic neoplasms; radiotherapy, computer-assisted; stereotaxic techniques; drug therapy
2014-07-26;
2014-12-09
郭建平(1977-),男,硕士,主治医师。
李珞(1982-),女,主管护师。
R735.9
A
1008-0341(2015)03-0277-04

