湿涝胁迫对平作和垄作花生渗透调节能力与产量及品质的影响
刘 娟,张 俊,臧秀旺,汤丰收,董文召,苗利娟,张忠信,徐 静
(河南省农业科学院经济作物研究所,河南郑州450002)
花生(Arachis hypogaea L.)是中国重要的经济作物,总产量居油料作物第1位,在国民经济中占有重要地位。花生适应半干旱和半湿润条件,在中国从北部温带到南部热带的季风湿润、半湿润气候区均有种植。长期以来,有关花生干旱的研究甚多,认为花生是耐旱性较强的作物,而对花生涝害问题关注较少[1]。河南是中国花生的主要产区之一,近年来,由于该区降水充沛且降水量在年份间与年内的分配极不均匀,夏秋涝害现象时有发生,严重影响了花生生长发育和产量及品质[2]。研究表明,渍害能够引起花生叶片黄化、植株矮小,产量大幅降低,严重者甚至造成绝收[3]。因此,湿涝对花生的危害不可低估,如何科学防灾、减灾,降低湿涝胁迫危害,对花生高产栽培有重要意义[4-5]。研究表明,湿涝胁迫造成花生生长环境缺氧,并诱发一系列生理生化变化,进而对花生生长发育、生理代谢和产量形成产生综合影响。在逆境条件下,植物会积累渗透调节物质来抵御外界环境的不利影响,且渗透调节物质含量对水分胁迫的响应较为复杂,与作物类型、胁迫程度及不同生育时期等密切相关[6-8]。脯氨酸、可溶性糖等均是重要的渗透调节物质。研究表明,多种逆境胁迫条件,如干旱、高温等都会造成植物体内脯氨酸的积累[9]。脯氨酸除作为渗透调节剂以外,还有储存能量、储存氮素、保持细胞结构稳定和酶系统的兼容性溶质的作用,从而提高作物抵御逆境的能力[10]。可溶性糖不仅是植物生长发育的能量来源和结构物质,还是植物逆境条件下的重要渗透调节物质[11-12]。渗透调节物质可以影响作物的抗性,从而影响作物的生长发育过程。然而,除广东、山东等省曾调研涝害或土壤过湿对花生产量的影响以外,目前极少开展花生湿涝胁迫的研究[5]。湿涝胁迫对花生渗透调节能力的影响尚不十分明确,不同种植方式间差异均缺乏研究。为此,本试验采用平作和垄作2种方式模拟湿涝逆境的试验方法,研究湿涝胁迫对花生渗透调节能力及产量和品质的影响,为缓解花生涝害和稳定产量、品质提供实用的减灾、避灾措施和理论依据。
1 材料与方法
1.1 试验地点与材料
试验于2013年在河南省农业科学院试验基地进行,供试土壤为沙壤土,0~20 cm土层养分含量:有机质 7.7 g·kg-1,速效氮 80.15 mg·kg-1,速效磷 25.00 mg·kg-1和速效钾 141.60 mg·kg-1。供试花生材料为珍珠豆型花生品种远杂9102。
1.2 试验设计
试验采用完全随机区组设计,种植方式(X)为主区,设平作和垄作2个处理;湿涝处理(Y)为副区,设正常水分对照、结荚期湿涝、成熟期湿涝3个处理,共计6个处理组合,分别为:平作正常水分(A)、平作结荚期湿涝(B)、平作荚果成熟期湿涝(C)、垄作正常水分(D)、垄作结荚期湿涝(E)、垄作荚果成熟期湿涝(F)。采用人工淹水模拟湿涝胁迫,重复3次。试验中平作每个重复种植8行,行距40 cm;垄作每个重复种植4垄,每垄2行,垄距80 cm,垄高10~12 cm,垄面宽55~60 cm,垄内小行距30~35 cm;平作和垄作行长(垄长)均为6.67 m,穴距16 cm,每穴2粒。结荚期湿涝处理时间为2013-08-15—2013-08-25,荚果成熟期湿涝处理时间为2013-08-25—2013-09-04。不同时期湿涝处理均持续10 d,湿涝处理期间保持土壤含水量处于饱和状态,水层约5 cm左右,对照则按需正常浇水。试验田块于2013-06-05播种,2013-09-20收获,其他管理措施同一般高产田。
1.3 生理指标及测定方法
分别于处理前(2013-08-15)、结荚期湿涝后(2013-08-25)、荚果成熟期处理后(2013-09-04),采取主茎上倒数第3片展开复叶,迅速放入冰盒中带回室内,放于-80℃超低温冰箱内保存,测定相关生理生化指标。
叶绿素含量的测定:在田间采用手持式叶绿素测定仪活体测定叶绿素含量。
游离脯氨酸含量的测定:采用茚三酮显色法测定[13]。
可溶性糖含量的测定:采用苯酚显色法测定可溶性糖含量[14]。
可溶性蛋白质含量的测定:用考马斯亮G-250 染色法[14]。
1.4 花生产量及品质测定
成熟后,将各处理荚果晾晒干,按小区测产,并折合成公顷产量。采用近红外分析仪测定花生品质。
2 结果与分析
2.1 湿涝胁迫对花生叶片叶绿素含量的影响
图1可以看出,试验处理开始后,随着生育进程推进,花生叶片叶绿素含量均呈下降趋势。与正常供水的对照相比,在平作和垄作两种方式下,湿涝胁迫花生叶片叶绿素含量均明显下降。垄作花生叶片叶绿素含量高于平作。统计分析表明,种植方式之间叶绿素含量差异不显著,湿涝处理之间差异极显著,两者互作差异不显著。垄作正常水分比平作正常水分处理的叶绿素含量高7.73%;垄作结荚期湿涝比平作的叶绿素含量高8.23%;垄作荚果成熟期湿涝比平作高7.91%。结荚期遇湿涝时,花生叶绿素含量下降量大于成熟期湿涝,说明结荚期湿涝对植株生理影响更大,而垄作可有效缓解这种危害,有利于促进光合作用和产量形成。

图1 不同处理叶片叶绿素含量的变化Fig.1 Changes of chlorophyll content in leaf of different treatments
2.2 湿涝胁迫对花生叶片脯氨酸含量的影响
脯氨酸是植物体内重要的渗透调节物质,逆境条件下植物体内脯氨酸大量积累,在植物组织中起着渗透调节和稳定细胞机能等作用[9]。图2表明,3个取样时期,垄作花生叶片脯氨酸含量均高于平作,在结荚期湿涝后,脯氨酸含量迅速增加,结荚期湿涝处理与对照间差异达到极显著水平,分别比对照增加67.79%(平作)和 103.53%(垄作),垄作的脯氨酸含量显著大于平作,湿涝处理结束后脯氨酸含量有所下降。在荚果成熟期湿涝,花生叶片脯氨酸含量亦有明显增加,但增加幅度小于结荚期处理,分别增加了 38.76%(平作)和 58.65%(垄作)。至处理结束,湿涝处理间脯氨酸含量差异达到极显著水平,以成熟期湿涝处理的脯氨酸含量最高。由此可见,在湿涝条件下,垄作花生叶片能积累较多的脯氨酸,可有效地缓解花生生育后期受到湿涝胁迫的危害,抵御环境胁迫的不利影响。
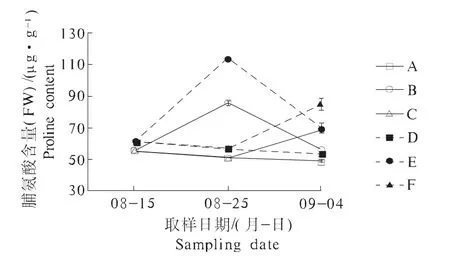
图2 不同处理叶片脯氨酸含量的变化Fig.2 Changes of proline content in leaf of different treatments
2.3 湿涝胁迫对花生叶片可溶性糖含量的影响
逆境胁迫条件下,可溶性糖是植物渗透调节的重要物质之一。由图3可以看出,在结荚期和荚果成熟期,湿涝胁迫均显著降低了花生叶片可溶性糖含量,种植方式间差异达到显著水平,垄作的可溶性糖含量显著大于平作。结荚期湿涝,平作降低幅度为38.69%,明显高于垄作的降低幅度,即9.16%。荚果成熟期湿涝,平作花生叶片可溶性糖含量的降低幅度为25.04%,也高于垄作的降低幅度,即 11.75%。

图3 不同处理叶片可溶性糖含量的变化Fig.3 Changes of soluble sugar content in leaf of different treatments
可见,湿涝胁迫显著影响了花生叶片可溶性糖积累,对花生植株生长造成了不利影响,而平作受湿涝影响程度要高于垄作,垄作有效地减缓了湿涝对花生生长造成的危害。
2.4 湿涝胁迫对花生叶片可溶性蛋白质含量的影响
叶片可溶性蛋白质是植株各种活性酶类等的总和,其含量变化可以作为反映植株抗涝性的生理指标之一。从图4可以看出,试验处理开始后,随生育进程推进,各处理花生叶片可溶性蛋白质含量均呈下降趋势,种植方式之间差异极显著,垄作极显著高于平作。湿涝处理后可溶性蛋白质含量极显著低于正常供水处理,与正常供水相比,结荚期湿涝处理可溶性蛋白质含量分别下降40.26%(平作)和7.05%(垄作);成熟期湿涝处理分别下降30.97%(平作)和11.98%(垄作)。与平作相比,垄作花生湿涝处理下可溶性蛋白质含量降幅较小,垄作花生保持了较高的可溶性蛋白质含量,有利于维持叶片生理特性,保证植株正常生长发育。

图4 不同处理花生叶片可溶性蛋白质含量的变化Fig.4 Changes of soluble protein content in leaf of different treatments
2.5 湿涝胁迫对平作和垄作花生产量和品质的影响
当土壤含水量过高时,花生下针会受到明显抑制,土壤含水量为田间持水量80%以上时,会造成茎叶徒长和倒伏,导致开花和下针减少。由裂区多重比较统计分析可知(表1),2种种植方式以及3种湿涝处理间产量差异均达到极显著水平,两者互作差异达到显著水平。垄作产量极显著高于平作,结荚期湿涝产量极显著低于正常水分和成熟期湿涝处理。结荚期湿涝胁迫,垄作花生产量比平作增加20.42%,成熟期湿涝胁迫,垄作产量比平作增加13.22%。平作条件下湿涝胁迫花生产量比正常供水分别降低22.10%(B)和11.34%(C);垄作条件下分别降低13.76%(E)和 7.72%(F),说明湿涝胁迫条件下垄作比平作有利于减小产量的损失。湿涝胁迫对花生的油酸、亚油酸、脂肪和蛋白质含量均产生了影响,湿涝胁迫降低了油酸和脂肪的含量,种植方式间差异均达到了极显著水平,结荚期湿涝和成熟期湿涝均与正常供水处理差异达显著水平,但两者之间差异不显著。湿涝胁迫提高了蛋白质和亚油酸的含量,种植方式间蛋白质含量差异显著,表现为平作大于垄作,亚油酸含量差异不显著;湿涝胁迫处理间蛋白质和亚油酸的含量差异达极显著。湿涝胁迫影响了花生子粒的发育进程,从而阻碍了脂肪的合成,促进蛋白质的合成,油酸含量的减少和亚油酸含量的升高,降低了油脂的稳定性,不利于花生的贮藏和加工。与平作相比,垄作提高了湿涝胁迫花生的油酸和脂肪含量。

表1 湿涝胁迫对平作和垄作花生产量和品质影响Table 1 Effect of waterlogging on peanut yield and quality under flat planting and ridge planting condition
3 结论与讨论
湿涝是农业生产中主要的非生物逆境之一,也是花生生育后期极易发生的自然灾害。中国易发生湿涝的地区主要为长江中下游平原和黄淮平原[15-18],这也是中国花生的重要产区。良好的水分条件是花生正常生长发育并获得高产的保证,湿涝导致花生根系发育受阻,生理功能紊乱,严重影响产量和品质。随着湿涝的发生,作物叶绿素含量降低,羧化酶活性下降,叶片发生早衰和脱落[19]。本试验条件下,平作和垄作方式下,结荚期和成熟期湿涝胁迫均降低了花生叶绿素和可溶性蛋白质含量,影响了叶片的光合作用等生理功能,最终降低了花生产量。
水淹不是湿涝对植物的主要危害原因,主要原因是由于植物的生存环境中水分过多所引起的次生胁迫而导致的。在湿涝条件下,花生根部缺氧,会诱发产生过量的活性氧自由基,使花生细胞因氧化变质而衰老和死亡。湿涝发生后,作物通过内部生理代谢等途径来适应环境变化,在一定范围内植物细胞能主动积累有机物质,通过渗透调节作用来抵御逆境,以维持作物的生命力[19]。但重度湿涝胁迫使植株根系无氧呼吸时间过长,导致有些有机物质含量迅速下降,严重影响了作物的生命代谢活动[20]。研究表明,在逆境胁迫条件下植物会积累脯氨酸,脯氨酸的积累是植物对水分胁迫的一种普遍性反应[21]。脯氨酸有调节细胞质的渗透势、提高植物细胞原生质渗透压、提高植物体抗逆性的作用[22]。本试验发现,垄作花生叶片能积累较多的脯氨酸,可有效地缓解花生生育后期受到湿涝胁迫的危害。因此,在逆境条件下垄作花生可有助于提高植株抗氧化能力及逆境适应性。可溶性糖是叶片细胞在逆境条件下积累的另一种有机物质,植物可以通过高储备和高消耗体内碳水化合物的含量来增强抗逆性。例如小麦叶、茎、胚根和不定根中的非结构性碳水化合物在湿害后成倍累积,排湿后又降低[23]。本研究表明,湿涝后可溶性糖含量一直降低,可能与取样时间较晚、可溶性糖的消耗有关。蛋白质作为细胞内含量最丰富的生物大分子,是生物体结构和功能最为重要的基础物质之一。可溶性蛋白质在一定范围内可调节细胞渗透压,以保持细胞内外的渗透平衡,从而抵抗逆境带来的伤害[24]。本试验中,结荚期湿涝胁迫危害大于成熟期;垄作使叶片的可溶性糖和蛋白质含量均保持在较高水平,有利于维持叶片生理功能,减缓湿涝对花生生长发育的影响。平作和垄作是花生生产常采用的栽培方式,与平作相比,垄作提高了湿涝胁迫花生的油酸和脂肪含量,能够明显降低湿涝胁迫带来的危害,因此,在可能出现湿涝的地区,更适宜采用垄作的方式来种植花生。
[1] 赵 伟,李 林,戈 蕾,等.不同花生品种幼苗期耐涝性差异分析[J].贵州农业科学,2009,7(12):84-86.
[2] 汤丰收,臧秀旺,韩锁义,等.淮河流域夏播花生规范化种植技术集成与示范[J].河南农业科学,2012,41(6):54-57.
[3] 张 凤,王媛媛,张佳蕾,等.不同生育时期淹水对花生生理性状及产量、品质的影响[J].花生学报,2012,41(2):1 -7.
[4] 程延年.未来气候变化对我国花生生产的影响[J].花生科技,1993(1):1-5.
[5] 李 林,邹冬生,刘登望,等.花生等农作物耐湿涝性研究进展[J].中国油料作物学报,2004,26(3):105-110.
[6] BOYER I S.Plant productivity and environment[J].Science,1982,218:443 -448.
[7] 张智猛,宋文武,丁 红,等.不同生育时期花生渗透调节物质含量和抗氧化酶活性对土壤水分的响应[J].生态学报,2013,33(14):4257 -4265.
[8] 刘祖琪,张石诚.植物生理抗性学[M].北京:中国农业出版社,1994.
[9] 朱 虹,祖元刚,王文杰,等.逆境胁迫条件下脯氨酸对植物生长的影响[J].东北林业大学学报,2009,37(4):86-89.
[10] 张福锁.环境胁迫与植物营养[M].北京:北京农业大学出版社,1993.
[11] SARKAR R K,DE R N,REDDY J N,et al.Studies on the submergence tolerance mechanism in relation to carbohydrate,chlorophyll and specific leaf weight in rice(Oryza sativa L.)[J].Journal of plant physiology,1996,149(5):623 -625.
[12] DAS K K,SARKAR R K.Post flood changes on the status of chlorophyll,carbohydrate and nitrogen content and its association with submergence tolerance in rice[J].Plant Archives,2001,1(1/2):15 -19.
[13] 张宪政,陈凤玉,王荣富.植物生理分析技术[M].沈阳:辽宁科学技术出版社,1994.
[14] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[15] 冯道俊.植物水涝胁迫研究进展[J].中国水运,2006,6(10):253 -254.
[16] 葛均筑,展 茗,赵 明,等.湿涝胁迫对玉米生理生化的影响研究进展[J].中国农学通报,2012,28(21):7-11.
[17] LI J C.Waterlogging physiology of wheat and its relation with wheat productivity[J].Plant Physiol Commun,1997,33(4):304 -312.
[18] 时明芝,周保松.植物涝害和耐涝机理研究进展[J].安徽农业科学,2006,34(2):209 -210.
[19] 魏凤珍,李金才,董 琦.孕穗期至抽穗期湿害对耐湿性不同品种冬小麦光合特性的影响[J].植物生理学通讯,2000,36(2):199 -121.
[20] 张福锁.环境胁迫与植物根际营养[M].北京:中国农业出版社,1997.
[21] 汤章城.逆境条件下植物脯氨酸的累积及其可能的意义[J].植物生理学通讯,1984(1):15-22.
[22] 王 娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学通报,2001,18(4):459-465.
[23] 周苏玫,王晨阳,张重义,等.土壤渍水对冬小麦根系生长及营养代谢的影响[J].作物学报,2001,27(5):673-679.
[24] 焦芳婵,毛 雪,李润植.植物抗逆性的基因工程改良[J].世界农业,2001(5):38-39.

