高温胁迫下受小热休克蛋白26(sHSP26)影响的玉米叶绿体蛋白质的研究
李娜娜,杨彦芳,赵飞云,胡秀丽
(河南农业大学生命科学学院,河南郑州450002)
农作物在生长发育过程中常常会遭遇许多胁迫,而高温胁迫是其遭遇的最普遍的非生物胁迫,严重降低了农作物的产量[1]。因此,提高农作物的耐热性,使其在胁迫环境下保产并增产迫在眉睫。植物sHSPs是核基因编码的蛋白质,其大小为15~43 kD的不同蛋白质,正常条件下它参与细胞内蛋白质新生肽链的折叠、转运、成熟及变性蛋白质的降解,而在胁迫条件下主要维持蛋白质的可溶状态,使解折叠的蛋白质重新折叠成有活性的构型,这些小热休克蛋白在提高植物耐热性方面发挥着重要作用[2-3]。最近的研究表明,通过转基因方法将sHSPs转入植物后能提高植物的抗性[4]。定位于叶绿体的sHSPs通常有3个高度保守区域,分别命名为Ⅰ、Ⅱ和Ⅲ区域,前2个区域存在于所有的小热休克蛋白中,而区域Ⅲ(富含甲硫氨酸)只存在于 CP-sHSPs中[5]。HARNDAHL 等[6]发现叶绿体sHSP内富含甲硫氨酸的а-螺旋区域被氧化成为亚砜后,直接导致叶绿体sHSP寡聚体构象的改变,随之其类似分子伴侣功能丢失,而当这些甲硫氨酸亚砜重新被还原后,叶绿体sHSP构象及类似分子伴侣功能恢复。说明叶绿体sHSP内这个特有的加Met保守区域对于结合底物蛋白非常关键。因此,在胁迫条件下,这种结构的变化可以保护植物免遭氧化胁迫[7-8]。HECKATHORN 等[9]在1998年证明了在番茄中叶绿体小分子热激蛋白能够在高温逆境下提升PSⅡ整个电子传递链的电子传递速度,并且在高温胁迫下对PSⅡ的保护作用发生很迅速。许多植物在氧化或高温胁迫下都有CP-sHSP26的表达,以保护PSⅡ的光化学活性免受氧化和高温胁迫的影响[4,7-8]。先前试验已证明,玉米幼苗在高温胁迫下可诱导sHSP26的高度表达[10],但CP-sHSP26在高温胁迫下的功能机制仍不清楚。因此,本研究以玉米品种郑单958叶片为试验材料,运用双向电泳(2-DE)和质谱分析等技术,确定高温胁迫下与sHSP26相关的蛋白质及其与叶绿体之间的关系。为研究CP-sHSP26保护玉米抗高温胁迫的作用机制提供新的理论依据。
1 材料与方法
1.1 试验材料
以耐干旱[11]玉米品种郑单958为试验材料,采用水培方式培养。用质量分数为2%NaClO对玉米种子消毒10 min,蒸馏水冲洗数次后浸种8 h,然后在培养箱中28℃催芽1 d,随后选取萌发一致的种子种在盛有培养介质的周转箱中,并放在光照培养箱中培养。光照培养箱的温度控制在28℃/22 ℃(昼/夜),光合有效辐射为400 μmol.m-2.s-1,相对湿度(75±5)%,光周期14 h/10 h(昼/夜)。当玉米幼苗的第2片叶完全展开后,对其进行高温胁迫,高温胁迫是将温度从28℃以2℃·h-1升高至42℃并维持1 h,共处理8 h,随后取下第2叶片用于叶绿体的制备。
1.2 测定项目与方法
1.2.1 叶绿体的提取及完整度的检测 依据MUNNE-BOSCH等[11]方法提取叶绿体。随后使用荧光显微镜对叶绿体完整度进行检测。
1.2.2 叶绿体的处理 因为sHSP26是诱导型蛋白,由核基因控制在高温胁迫下表达,在此条件下我们分别用水、免疫球蛋白(IG)和AT-sHSP26处理纯化的叶绿体。其比为1∶3 000,孵育30 min之后,40℃ 热激 10 min,立即保存于 -80℃备用[11]。
1.2.3 叶绿体蛋白质提取及含量的测定 叶绿体蛋白的提取采取 WANG等[12]方法,采用 BRADFORD[13]法测定蛋白质的含量。
1.2.3 sHSP26 Western blot 分析 将含有 25 μg蛋白质样品在12.5%SDS-PAGE凝胶上电泳,电泳后将蛋白质转移到PVDF膜上,用抗玉米sHSP26多克隆抗体检测 ,免疫复合物用辣根过氧化物酶偶联的二抗(山羊抗兔)进行检测,印记使用3,3-二氨基联苯胺四盐酸盐显色[14]。试验至少重复3次。
1.2.4 2-DE 2-DE 采用 WANG 等[15]的方法。试验至少重复3次。
1.2.5 数据处理和图像分析 运用Excel 2003对所得数据进行处理。用软件Image Master 2D Platinum 6.0(GE Healthcare公司)对凝胶双向电泳图像进行分析处理,包括背景的消减、斑点的检测、匹配、分子质量和等电点计算,获取斑点位置坐标及蛋白质点量值的标准化分析等。
1.2.6 MALDI-TOF质谱分析 利用基质辅助激光解吸电离/飞行时间(MALDI/TOF)质谱分析待测定的双向电泳蛋白点。将胶中差异显著的蛋白点挖出,使用含500 ng胰蛋白酶的50 mmol· L-1碳酸氢铵(pH值8)在室温酶解过夜后,对所得肽段依次使用体积分数1%三氟乙酸(TFA)的水溶液、含体积分数50%乙腈的0.2%TFA水溶液抽提、冻干后,再用ZipTipTMC18把肽段洗涤干净,然后把肽段重新悬浮在10 μL的0.1%TFA水溶液中。Tip头先用50%乙腈洗涤3次后再水化、再用0.1%TFA水溶液洗涤3次后进行平衡,平衡后吸入肽段溶液10次以确保结合。包含肽段的tip头用0.1%TFA的水溶液洗涤3次,接着使用3 μL的50%乙腈/0.2%TFA水溶液把肽段洗脱下来。制备好的样品在质谱仪上采用反射模式分析的正离子谱测定,飞行管长2.7 m,离子源加速电压为20 kV,反射电压为23 kV,N2激光波长为377 nm,脉冲宽度为3 ns,离子延迟提取100 ns,质谱信号单次扫描累加50次,胰蛋白酶自切降解峰作为内部标准校正,获得肽质量指纹图谱(PMF)。
1.2.7 数据库查询和蛋白质信息分析 用Mascot Distiller软件(Matrixscience)对PMF图谱进行单同位素峰识别,用Mascot软件(Matrixscience,http://www.matrixscience.com)对获得的肽段质荷比 (m/z)数值进行检索。用SWISS-PROT数据库 (http://www.expasy.org/sprot/)和 NCBI数据库(http://www.ncbi.nlm.nih.gov/)进行搜索分析,进而得到蛋白质的名称、相对分子质量(Mr)和等电点(pI)。在网站 http://workbench.sdsc.edu/中点击Click to Enter the Biology Workbench 3.2进入蛋白质工具(Protein tool)界面进行蛋白质理化性质等分析。
1.2.8 放氧速率的测定 应用 Chlorolab-2液相氧电极系统 (Hansatech,Norfolk,England),在25 ℃含有 20 mmol· L-1NaHCO3的 50 mmol·L-1Tris-HCl buffer,pH 值7.5溶液中测定叶绿体的放氧速率,其光强为1 600 μmol·m-2·s-1[16]。试验至少重复3次。
2 结果与分析
2.1 AT-sHSP26处理效果检测
参照HECKATHORN等[9]方法用sHSP26抗体处理分离的叶绿体。为进一步检测AT-sHSP26是否转入玉米叶片叶绿体并发挥了作用,用免疫印迹技术分析了sHSP26的相对丰度,结果如图1-A、图1-B所示,经AT-sHSP26处理后,sHSP26相对含量明显降低。表明AT-sHSP26已成功转入叶绿体并影响了sHSP26的含量。
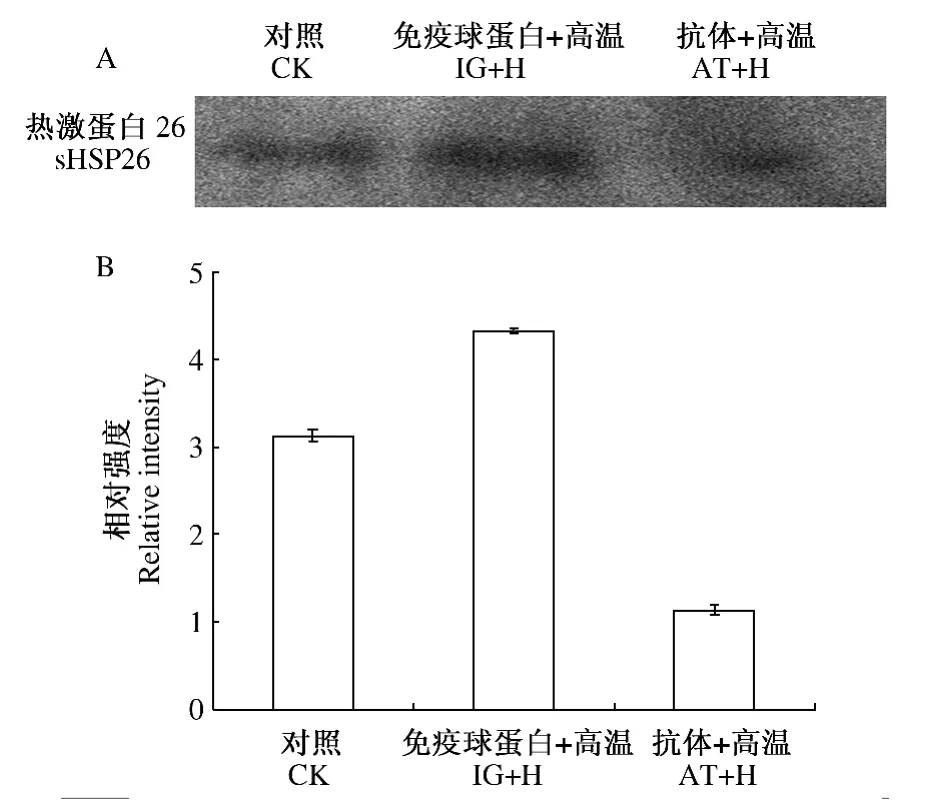
图1 玉米叶绿体蛋白sHSP26 western blot分析(A)及其相对强度分析(B)Fig.1 Western blot analysis of the sHSP26(A)and relative intensity(B)in maize chloroplast proteins
2.2 受sHSP26影响的叶绿体蛋白质的鉴定
为了证明sHSP26对叶绿体蛋白质的影响,提取叶绿体之后分别经免疫球蛋白和AT-sHSP26处理,进行高温处理后提取蛋白质进行双向电泳分离。经双向电泳图谱比较分析发现24个差异蛋白点(图3-A),经鉴定后表明属于14个蛋白质(表1),根据其功能(表1)归为6种类别:光反应(42%)、ATP 合成(29%)、卡尔文循环(17%)、染色质合成(4%)、胁迫蛋白(4%)和未知蛋白(4%)(图4)。与IG处理相比,用 sHSP26抗体(AT-sHSP26)处理后,与光合作用相关的蛋白质(ATP合酶 α,β和 γ亚基、放氧增强子蛋白(OEE1)、叶绿素a/b结合蛋白、细胞色素b6/f复合体铁硫亚基、光系统Ⅰ反应中心亚基Ⅳ4和铁硫中心蛋白)表达下调(图3-B),说明高温胁迫下这些蛋白质受到了sHSP26的影响,同时证明了sHSP26保护了这些蛋白质免受高温的伤害,并在植物光合作用中扮演着至关重要的角色。

图3 受sHSP26影响的叶绿体蛋白的鉴定Fig.3 Identify of chloroplast proteins affected by sHSP26

表1 高温胁迫下受sHSP26影响的玉米叶绿体蛋白的鉴定Table 1 Identification of maize chloroplasts protein affected by sHSP26 under heat stress

续表Continuing table
2.4 sHSP26对叶绿体PSII中心放氧活性的影响
为了证明sHSP26对玉米叶绿体PSⅡ活性的影响,通过用sHSP26抗体(AT-sHSP26)和免疫球蛋白(IG)预处理玉米叶绿体后,再进行高温处理,对上述制备的叶绿体进行放氧测定作为反应叶绿体PSⅡ活性。结果显示,高温胁迫下其PSⅡ的放氧速率与IG处理相比明显下降(图5)。表明高温胁迫下 sHSP26保护了 PSⅡ的活性,暗示了sHSP26具有提高PSⅡ抗高温胁迫的能力。
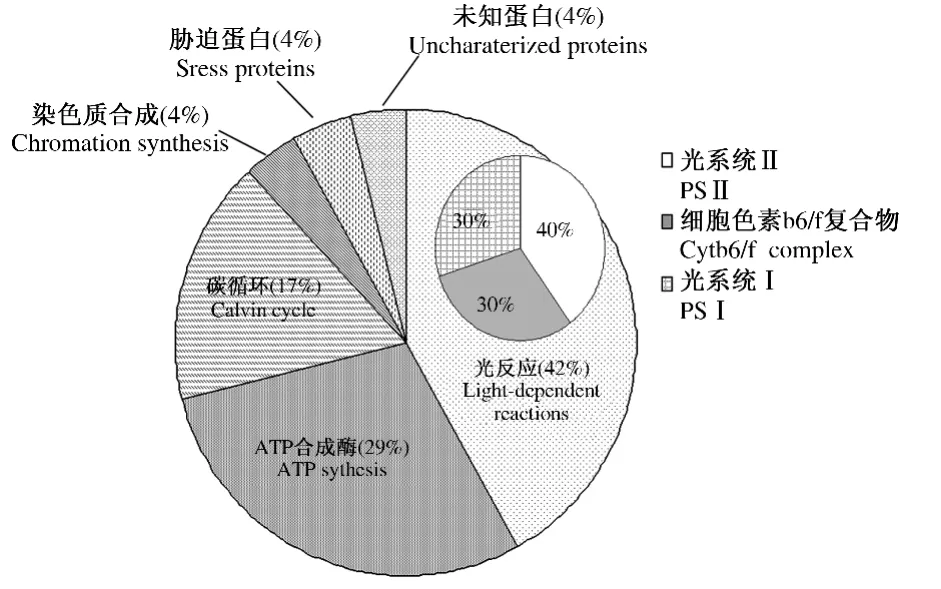
图4 高温胁迫下已鉴定玉米叶绿体蛋白质的功能分类Fig.4 Functional classification of maize chloroplasts protein identified under heat stress
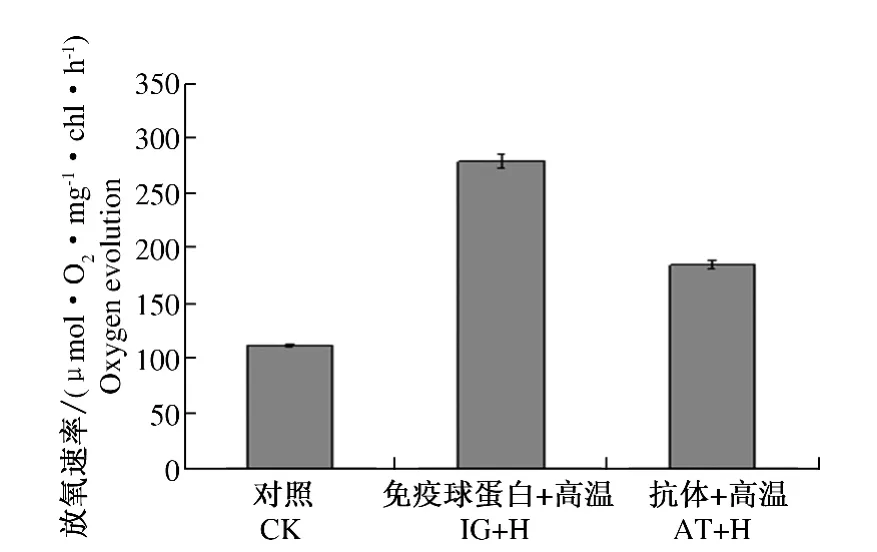
图5 玉米叶绿体的放氧速率Fig.5 The rate of O2evolution in maize chloroplasts
3 讨论
植物在生长发育过程中形成了许多调节机制来适应周围环境的胁迫,常常通过诱导和积累sHSPs达到增强抗性的目的[2]。目前对sHSPs的研究主要集中在不同胁迫条件诱导其表达,比如:干旱、高温、氨基酸类似物、金属、紫外线、ABA等[17-21]。在高等植物中,几乎所有胁迫都能诱导sHSPs的表达,这些对研究植物响应不同胁迫提供了新的依据。本实验组先前研究证明,高温胁迫下sHSP26在玉米叶片中大量表达,并参与热激反应[10]。在本研究中发现一些在高温胁迫下受sHSP26保护的蛋白质,并且这些蛋白质主要参与光合作用中光反应和卡尔文循环。光反应主要由4种蛋白复合体来传递:PSⅡ、细胞色素b6/f复合体、PSⅠ和ATP合酶复合体。在本研究中,存在17个蛋白质(点 1、2、3、4、5、6、7、8、9、10、12、16、18、19、21、22和24)参与光反应,其中4个蛋白质(点6、9、10 和12)属于 PSⅡ,3 个蛋白质(点 16、18 和21)属于细胞色素b6/f复合体,3个蛋白质(点19、22 和24)属于 PSⅠ,7 个蛋白质(点1、2、3、4、5、7和8)属于ATP合酶复合体,另外有4个蛋白质(点11、13、14和15)属于卡尔文循环。
在植物中,热损伤的主要指标之一是放氧复合体(OEC)和PSⅡ中的相关辅助因子及固碳作用中的Rubisco酶和ATP合成系统[22]。放氧复合体蛋白包括OEE、OEE1和OEE2,属于核编码的叶绿体蛋白,在响应高温胁迫时 OEE表达上调[23]。CP-sHSPs不但能够保护植物PSII和类囊体膜免受高温胁迫,而且能保护光合电子传递和 OEC[24~26]。在藜中1个22 kD的CP-sHSPs能特异性与PSⅡ中耐热OEC蛋白相互作用[27],在高羊茅中,高温胁迫下CP-HSP26过表达,显著增加了PSⅡ(Fv/Fm)光化学活性[28]。在本研究中,AT-HSP26转化后OEE1(点6)表达下调(图3-B),并且高温胁迫下PSⅡ的放氧速率显著降低(图5)。前人研究显示,在水稻和杨树中,高温胁迫显著增加了叶绿体ATP合酶CF1的α链[29]。细胞色素b6/f复合体是光合电子传递链中非常重要的组分,包含许多小亚基,在PSⅡ到PSⅠ电子传递过程中发挥着重要作用[30]。细胞色素b6/f复合体可能参与了热胁迫机制[31]。在本研究中,高温胁迫下细胞色素b6/f复合体的铁硫亚基表达增加,经AT-sHSP26处理后其表达量降低(点16、18和21)(图3-B)。果糖-1,6-二磷酸激酶(FBA)作为卡尔文循环中的1个酶,参与核酮糖-1,5-二磷酸(RuBP)的合成。高温胁迫增加FBA的表达或许可以维持CO2的累积效率[25]。本研究中,高温胁迫下FBA表达上调,用AT-sHSP26处理后,抑制FBA表达量的增加(图3-B)。高温胁迫增加了整个电子传递效率,Ab(met)和Ab(a)的加入,均降低了高温下电子传递速率[9]。同样在本研究中,用AT-sHSP26处理后光合反应速率明显降低(图5),说明sHSP26保护了高温胁迫对PSⅡ的损伤。
本研究显示,sHSP26与玉米叶绿体蛋白质在高温胁迫下的相关性,sHSP26能够维持PSⅡ功能的稳定和能量的合成,使玉米叶片免受高温胁迫的损伤。本研究结果为揭示胁迫应答反应中蛋白互作提供了重要的依据,为进一步阐明sHSP26保护玉米叶绿体的功能及阐明光合作用机制提供了理论依据。
[1] RASUL G,CHAUDHRY Q Z,MAHMOOD A,et al.Effect of temperature rise on crop growth and productivity[J].Pakistan J Meteorol,2011,8(15):53 -62.
[2] SUN W,MOTANGU M V,VERBRUGGEN N.Small heat shock proteins and stress tolerance in plants[J].Biochimica et Biophysica Acta,2002,1577(1):1-9.
[3] JAYA N,GARCIA V,VIRLING E.Substrate binding site flexibility of the small heat shock protein molecular chaperones[J].Proc Natl Acad Sci USA,2009,106(37):15604-15609.
[4] CHAUHAN H,KHURANA N,NIJHAVAN A,et al.The wheatchloroplastic smallheatshock protein(sHSP26)is involved in seed maturation and germination and imparts tolerance to heat stress[J].Plant Cell Environ,2012,35(11):1912-1931.
[5] CHEN Q,VIERLING E.Analysis of conserved domains identifies a unique structural feature of a chloroplast heat shock protein[J].Mol Gen Genet,1991,226(3):425-431.
[6] HARNDAHL U,KOKKE B P,GUSTAVSSON N,et al.The chaperone-like activity of small heat shock protein is lost after sulfoxdation on conserved methionines in surface-exposed amphipathic а-helix[J].Biochim Biophys Acta,2001,1545(1 -2):227 -337.
[7] LEE B H,WON S H,LEE H S,et al.Expression of the chloroplast-localized small heat shock protein by oxidative stress in rice[J].Gene,2000,245(2):283 - 290.
[8] H RNDAHL U,BUFFONI-HALL R,OSTERYOUNG K W,et al.The chloroplasst heat shock protein undergoes oxidation-dependent conformational changes and may protect plants against oxidative stress[J].Cell Stress Chaperon,1999,4(2):129-138.
[9] SCOTT A H,CRAIG A D,THOMAS D S.et al.The small,methionine-rich chloroplast heat-shock protein protects photosystem II electron transport during heat stress[J].Plant Physiol,1998,116(1):439 -444.
[10] HU X L,LI Y H,LI C H,et al.Characterization of small heat shock proteins associated with maize tolerance to combined drought and heat stress[J].J Plant Growth Regul,2010,29(4):455 -464.
[11] MUNNE-BOSCH S,ALEGRE L.Drought-induced changes in the redox state of-tocopherol,ascorbate and the diterpene carnosic acid in chloroplasts of labiatae species differing in carnisic acid contents[J].Plant Physiology,2003,131(4):1816-1825.
[12]WANG W,VIGNANI R,SCALI M,et al.Auniversal and rapid protocol for protein extraction from recalcitrant plant tissues proteomic analysis[J].Electrophoresis,2006,27(13):2782-2786.
[13]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical.Biochemisry,1976,72:248-254.
[14] HU X L,LIU R X,LI Y H,et al.Heat shock protein 70 regulates the absciisic acid-induced antioxidant response of maize to drought and heat stress combination[J].PlantGrowthRegulation, 2010, 60(3):225-235.
[15] WANG W,WU X L,XIONG E H,et al.Improving gel-based proteome analysis of soluble protein extracts by heat prefractionation[J].Proteomics,2012,12(7):938-943.
[16] ZHANG Z S,LI G,GAO H Y,et al.Characterization of photosynthetic performance during senescence in staygreen and quick-leaf-senescence Zea mays L.Inbred Line[J].Plos One.2013,7(8):e42936.
[17] LINDQUIST S,CRAIG E A.The heat-shock proteins[J].Annu.Rev.Genet,1998,22(1):631 -677.
[18] VIERLING E.The role of heat shock proteins in plants[J].Annu Rev Plant Physiol Plant Mol Biol,1991,42(1):579-620.
[19] BANZET N,RICHAUD C,DEVEAUX Y,et al.Accumulation of small heat shock proteins,including smitochondrial HSP22,induced by oxidative stress and adaptive response in tomato cells[J].Plant J,1998,13(4):519-527.
[20]HU X L,LU M H,LI C H,et al.Differential expression of proteins in maize roots in response to abscisic acid and drought[J].Acta Physiol Plant,2011,33(6):2437-2446.
[21] LIU T X,ZHANG L,YUAN Z L,et al.Indentification of proteins regulated by ABA in response to combined drought and heat stress in maize roots.Zea mays L.inbred lines[J].Plos One,2013,25(2):e42936.
[22] ALLAKHVERDIEV S I,KRESLAVSKI V D,KLIMOV V V,et al.Heat stress:an overview of molecular responses in photosynthesis[J].Photosynth Res,2008,98(1):541-550.
[23] LI W M,WEI Z W,QIAO Z H,et al.Proteomics analysis of alfalfa response to heat stress[J].Plos One,2013,8(12):e82725.
[24] HAQ NU,AMMAR M,BANO A,et al.Molecular characterization of chenopodium album chloroplast small heat shock protein and its 460 expression in response to different abiotic stresses[J].Plant Mol Biol Rep,2013,31(6):1230-1241.
[25] HECKATHORN S A,DOWNS C A,Coleman A J S.Small heat shock proteins protect electron 463 transport in chloroplasts and mitochondria during stress[J].Am Zool,1999,39(6):865 -876.
[26] T R K Z,GOLOUBINOFF P,HORVATH I,et al.Synechocystis HSP17 is an amphitropic protein that stabilizes heat-stressed membranes and binds denatured proteins for subsequent chaperone-mediated refolding[J].Pro-ceedings of the National Academy of Sciences of USA,2001,98(6):3098-3103.
[27] DOWNS C A,COLEMAN J S,HECKATHORN S A.The chloroplast 22-Ku heat-shock protein:a lumenal protein that associates with the oxygen evolving complex and protects photosystemⅡ during heat stress[J].J Plant Physiol,1999,155:477 -487.
[28] KIM K H,ALAM I,Kim Y G,et al.Overexpression of a chloroplast-localized small heat shock protein OsHSP26 confers enhanced tolerance against oxidative and heat stresses in tall fescue[J].Biotechnol.Lett,2012,34(2):371-377.
[29] FERREIRA S,HJERNO K,LARSER M,et al.Proteome profiling of Populus euphratica Oliv upon heat stress[J].Ann Bot,2006,98(2):361 -377.
[30] CRAMER W A,ZHANG H,YAN J,et al.Transmembrane traffic in the cytochrome b6/f complex[J].Annu.Rev.Biochem,2006,75(1):769-790.
[31] BOUCHER N,HARNOIS J,CARPENTIER R.Heatstress stimulation of electron flow in a photosystemⅠsubmembrane fraction[J].Biochem Cell Biol,1990,68(7-8):999-1004.

