燕麦多酚提取物对冷却猪肉保鲜效果的研究
杨文平,郝教敏,王泽华,杨珍平,杨 华,朱迎春
(1.华北理工大学生命科学学院,河北唐山063000;2.山西农业大学食品科学与工程学院,山西太谷030801;3.山西农业大学农学院,山西太谷030801)
随着人们生活水平的不断提高,冷却肉已成为中国鲜肉加工发展的必然趋势。国内外关于冷却肉保鲜有许多种方法,如化学防腐、生物防腐以及物理防腐等,各种方法均有优缺点[1-3]。其中将从天然植物提取的活性抗氧化成分应用于冷却肉的方法,因其低毒、安全、有效而备受青睐[4-8]。植物多酚为植物体内具有多元酚结构的次生代谢物,存在于植物的皮、根、叶、果中,含量较高[9],抗氧化作用较强,主要表现在:直接清除活性氧自由基,抑制脂质过氧化反应,螯合金属离子,激活细胞内抗氧化防御系统,有效提高食品保鲜期,延缓腐败变质,降低亚硝酸盐残留等[10-16]。燕麦(Avena sativa),为一年生禾本科燕麦属植物,在中国种植历史悠久,遍及中国各山区、高原和北部高寒冷凉地带。一般分为带稃型皮燕麦(Hulled oats)和裸粒型裸燕麦两大类。燕麦是一种健康营养食品,不仅含有优质蛋白质和大量的水溶性膳食纤维(SDF)等营养成分[17],而且含有多种抗氧化活性物质,包括大量植酸、甾醇、维生素E等,其中最主要的抗氧化成分是多酚类物质。研究表明,燕麦多酚具有很强的抗氧化作用、清除自由基(·OH,O-2·)活性、抑制低密度脂蛋白LDL氧化(潜在的抗动脉粥样硬化能力)等功能[18]。燕麦多酚还具有较强的铁还原能力和清除DPPH·自由基能力[19]。相同条件下,燕麦多酚的抗氧化能力是燕麦油脂中甾醇的1.4倍[20]。纵观前人研究,关于燕麦多酚的提取方法及抗氧化活性评价方面的研究虽然较多,而将其应用在冷却肉保鲜方面的研究报道却很少。因此,本研究拟以引进品种加拿大皮燕麦的籽实为材料,研究其多酚提取物对冷却猪肉的保鲜效果,为燕麦多酚在冷却肉保鲜中的开发利用提供理论依据。
1 材料与方法
1.1 材料
皮燕麦(加燕OA1017-1)子粒,引自加拿大,于山西省左云县栽培种植并收获。原料肉:冷却排酸的新鲜猪后腿肉。
1.2 试剂
三氯乙酸、硫代巴比妥酸、醋酸、氯仿等试剂均为分析纯。
1.3 仪器与设备
FZ102型微型植物粉碎机,pH211型精密酸度计,美产WSC-Ⅱ型色差计,A25-福鲁克高剪切分散乳化机,TDA-8002型电热恒温水浴锅,TDL-4型离心机,WFJ2100型可见光分光光度计,DHG-9243BS-Ⅲ型电热恒温鼓风干燥箱。
1.4 试验方法
1.4.1 原料处理 将干净的燕麦子粒粉碎干燥后放入干净白色塑料袋内,避光低温保存。
1.4.2 燕麦多酚的提取 依本课题组前期试验筛选的最佳水浴醇提工艺:体积分数为66%乙醇,料液比为1∶10,66 ℃水浴浸提123 min,过滤,得到质量浓度为0.150 g·L-1燕麦多酚a;将燕麦多酚a得到质量浓度为0.075 g·L-1燕麦多酚 b。将2种质量浓度的燕麦多酚保藏备用。
1.4.3 肉样处理 将新鲜猪后腿肉在洁净消毒的案板上除去筋膜,切分为大小均匀、质量约(50±4)g的肉块。随机分为3组,每组3个重复。每组分别用无菌蒸馏水(对照CK)、燕麦多酚a、燕麦多酚b蘸浸10 min,浸泡用量1 000 mL,处理后静置15 min,准确称量,浅盘包装,放入(4±1)℃可调冰箱中冷藏,备用。
1.4.4 指标测定方法 对冷藏的3组肉样,分别测定肉样初始(浅盘包装2 h后测定)及3、6、9、12、15 d的色差、pH值、滴水损失、2-硫代巴比妥酸与丙二醛反应产物(TBARS)、总挥发性盐基氮(TVB-N)、细菌总数等指标。
肉色测定采用美产WSC-Ⅱ型色差计[21],测定肉样的亮度Hunter L*和红度a*值。pH值测定根据GB/T 9695.5—2008《肉与肉制品pH 测定》,评价标准:新鲜肉 pH值5.8~6.2;次鲜肉pH值6.3 ~6.6;变质肉 pH 值 6.7 以上[22]。滴水损失DL的测定采用直接称重法[23]。TVB-N值测定采用半微量扩散法[24-25],评价标准:鲜肉≤0.20 mg·g–1;变质肉 >0.20 mg·g–1。细菌总数测定按照 GB/T 4789.2—2010《食品卫生微生物学检验—菌落总数测定》,采用牛肉膏蛋白胨营养琼脂培养基—平板倾注计数法[26],评价标准:新鲜肉<4,次鲜肉4~6,变质肉>7。TBARS值测定采用硫代巴比妥酸反应物法[27]。
1.5 数据处理与统计分析
分别采用Excel和Sigma Plot 10.0数理统计分析软件进行数据处理与绘图,结果用平均值表示。所得数据用SAS 9.1.3统计分析软件,进行方差分析与多重比较。
2 结果与分析
2.1 不同处理对贮存期内冷却猪肉细菌总数和挥发性盐基氮TVB-N值的影响
微生物是冷却猪肉鲜度发生变化的重要因素。从图1可知,随着贮存期的延长,所有处理冷却猪肉细菌总数CFU均呈上升趋势(P<0.05)。从贮存第3天到贮存第15天,同一贮存期内,多酚处理组较空白组的细菌总数均显著降低(P<0.05),说明燕麦多酚提取物具有明显的抑菌保鲜效果。贮存9 d后,空白组冷却猪肉细菌总数达到变质肉的范畴;而多酚处理组冷却猪肉在贮存12 d时细菌总数仍未达到变质肉的标准。2个多酚处理组相比,冷藏前6 d,冷却猪肉细菌总数差异不显著(P>0.05),但冷藏9 d后,多酚浓度越高,越有利于抑制冷却猪肉细菌的繁殖(P<0.05)。高质量浓度多酚处理组冷却猪肉贮存15 d时细菌总数仍在次鲜肉标准范围内。
挥发性盐基氮(TVB-N)是判定鲜肉制品鲜度等级的重要指标[28]。由图2可知,随着贮存时间的延长,所有处理的TVB-N值均呈上升趋势(P<0.05)。贮存到第12天,3个处理的TVB-N值均没有超过国家鲜肉标准 0.20 mg·g–1(P <0.05);但贮存到第15天,空白组TVB-N值超过了国家鲜肉标准0.20 mg·g–1(P <0.05),冷却肉腐败变质。同一贮存期内,多酚处理组较空白组显著降低了冷却猪肉TVB-N值(P<0.05)。多酚a组与多酚b组相比也降低了冷却猪肉TVB-N值(P<0.05)。
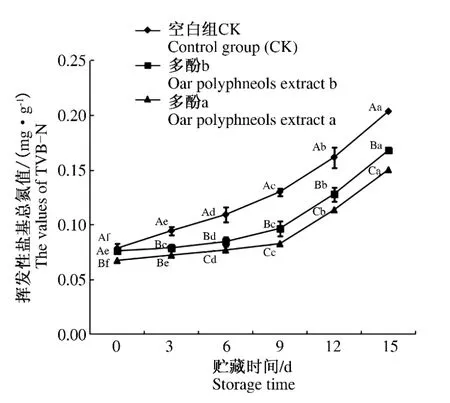
图2 燕麦多酚提取物对贮存期内冷却猪肉TVB-N值的影响Fig.2 Effects of oats polyphenols extract on the values of TVB-N for chilled pork during storage
2.2 不同处理对贮存期内冷却猪肉脂质抗氧化能力的影响
硫代巴比妥酸反应物值(TBARS值)一般用来评价脂质抗氧化能力。由图3可知,随着冷却猪肉贮存时间的延长,所有处理组的TBARS值先降低,后有所升高。处理当天,不同处理组间的TBARS值差异不大(P>0.05);贮存第3天,多酚a组较其他2组显著降低了TBARS值;贮存第6天直至第15天,多酚组较空白组显著抑制了TBARS的生成(P<0.05),且多酚a组比多酚b组抑制效果更好,说明较高质量浓度的燕麦多酚有利于提高冷却猪肉的脂质抗氧化能力。
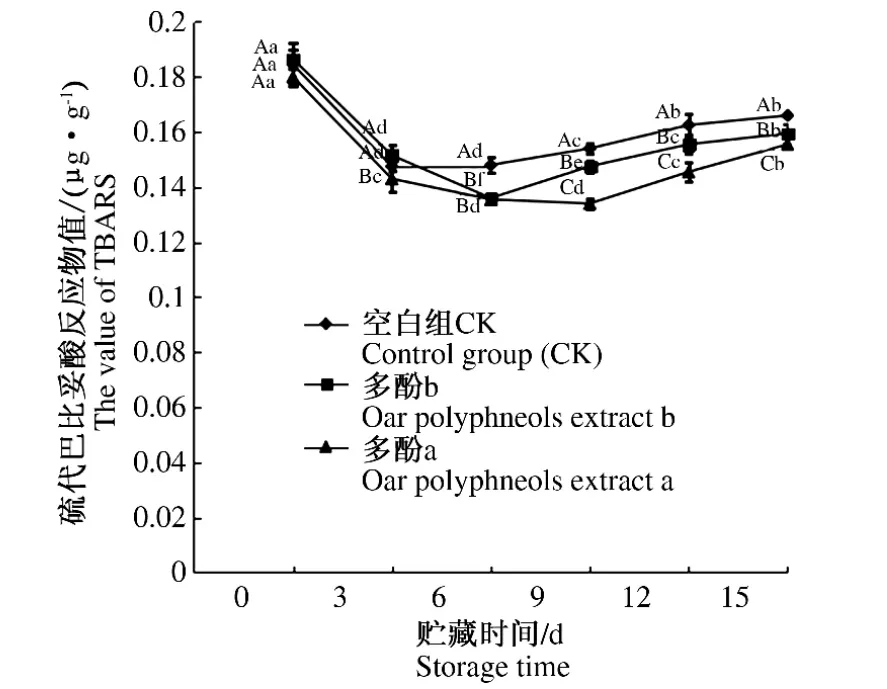
图3 燕麦多酚提取物对贮存期内冷却猪肉TBARS值的影响Fig.3 Effects of oats polyphenols extract on the values of TBARS for chilled pork during storage
2.3 不同处理对贮存期内冷却猪肉滴水损失率的影响
贮存时间延长,会加剧冷却猪肉组织细胞膜脂质氧化,增大细胞膜通透性,使细胞液及血液从组织内部渗出,既影响冷却肉美观,也使营养和滋味成分大量流失。由图4可知,随着贮存时间的延长,冷却猪肉的滴水损失率(汁液流失率)升高(P<0.05)。同一贮存期内,空白处理组比多酚处理组滴水损失率显著增加(P<0.05),可见燕麦多酚提取物能有效地阻止冷却猪肉的汁液流失,提高猪肉的保水性。多酚a组与多酚b组对于提高冷却猪肉的保水性效果差异不显著(P>0.05)。

图4 燕麦多酚提取物对贮存期内冷却猪肉滴水损失率的影响Fig.4 Effects of oats polyphenols extract on the dripping loss of chilled pork during storage
2.4 不同处理对贮存期内冷却猪肉色差的影响
肉色与肉品质紧密相关,也是衡量肉新鲜度和卫生程度的重要指标。影响肌肉颜色发生变化的主要是肌红蛋白。生猪死后,肌肉中氧气供给终止,肌红蛋白与氧分离形成还原态Mb,肌肉呈紫色;把猪肉切片放置在空气中,还原态Mb从切开的断面获得氧气,从而和氧结合形成氧合态MbO2,肌肉呈红色;含有二价铁离子(Fe2+)的氧合态MbO2和还原态Mb都会自动氧化,生成含有三价铁离子(Fe3+)的高铁肌红蛋白MMb,肌肉呈褐色。随放置时间延长,高铁肌红蛋白MMb在肉中沉积,导致猪肉褐变,肉的表面亮度(L*)降低,品质下降。Mb氧合或MMb还原的速率越快,MbO2含量越高,L*值越大。由图5可知,随着贮存时间延长,所有处理的亮度L*值均明显减小(P<0.05)。在同一贮存期内,除处理当天外,多酚处理组相比空白组亮度L*值均明显提高(P<0.05)。
由图6可知,随着贮存时间延长,所有处理的红度a*值均明显减小(P<0.05),肉色由鲜红色转变为红褐色。在同一贮存期内,除处理当天外,多酚处理组相比空白组红度a*值均明显提高(P <0.05)。
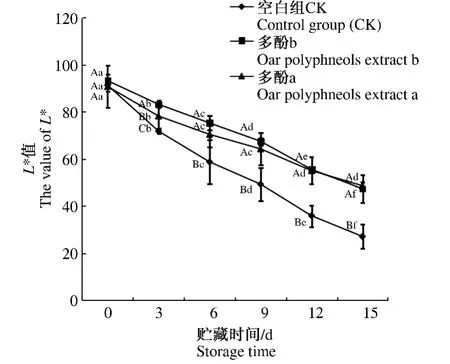
图5 燕麦多酚提取物对贮存期内冷却猪肉亮度L*的影响Fig.5 Effects of oats polyphenols extract on the lightness of chilled pork during storage

图6 燕麦多酚提取物对贮存期内冷却猪肉红度a*的影响Fig.6 Effects of oats polyphenols extract on the redness of chilled pork during storage
综上所述,燕麦多酚提取物能够显著抑制冷却猪肉高铁肌红蛋白MMb的积累速率,延缓冷却猪肉表面亮度和红度的降低。就整个贮存期而言,2个多酚处理组对冷却猪肉表面亮度和红度的影响没有显著差异(P>0.05)。
2.5 不同处理对贮存期内冷却猪肉pH值的影响
由图7可知,不同处理方式下,随着贮存时间的延长,冷却猪肉pH值均呈上升趋势(P<0.05)。同一贮存期内,多酚处理组相比空白组冷却猪肉pH值显著降低(P<0.05),说明燕麦多酚有效地抑制了冷却猪肉微生物的繁殖,抑制了猪肉的腐败变质。在贮存前9 d,多酚a组与多酚b组冷却猪肉pH值差异不显著(P>0.05),而到贮存第12天及第15天,多酚a组相比多酚b组冷却猪肉pH值明显降低(P<0.05),说明在冷却肉的保鲜过程中,较高质量浓度的燕麦多酚提取物保鲜作用更为明显。
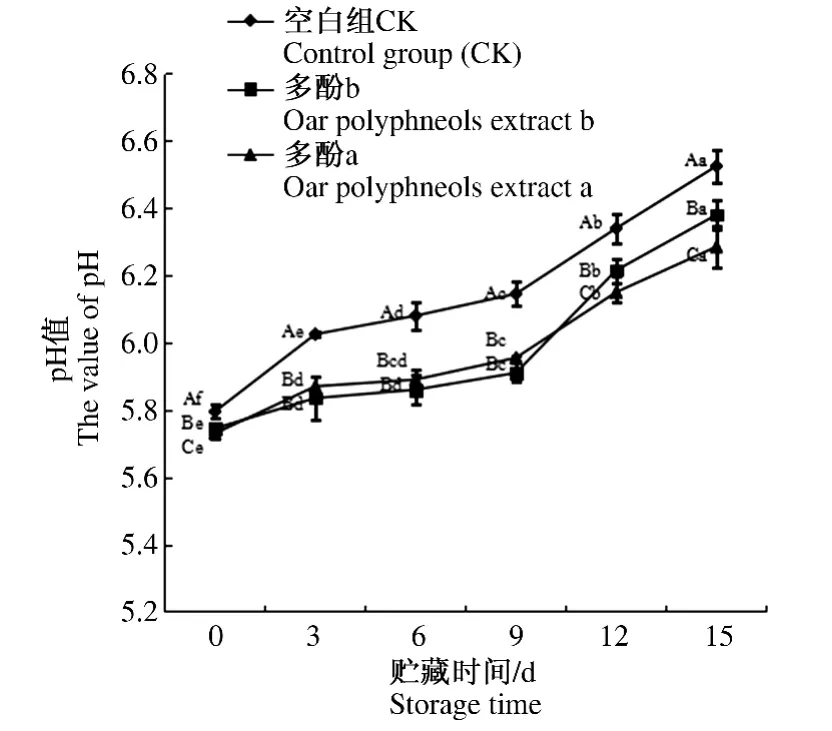
图7 燕麦多酚提取物对贮存期内冷却猪肉pH的影响Fig.7 Effects of oats polyphenols extract on the pH of chilled pork during storage
3 讨论
冷却肉处于低温环境条件下,许多细菌的生长受到抑制,但冷却肉携带的一些嗜冷菌,即使在较低温度下,其繁殖速度也并不会完全停止,且随着贮存时间的延长,微生物繁殖可以提高肉中各种酶活性,特别是微生物代谢产生的蛋白酶可引起冷却肉组织蛋白质分解,并发生脱胺、脱羧反应而产生氨、氮和胺类等各种碱性含氮物质(TVB-N),进而使冷却肉腐败变质[29]。本研究结果表明,冷却猪肉用多酚处理后,肉中的细菌总数减少,微生物繁殖被抑制,延迟了肉中挥发性盐基氮TVB-N的升高,从而减缓了肉腐败变质的速度,延长了货架期。多酚质量浓度越高,作用效果越明显。
脂质氧化主要是不饱和脂肪酸在氧的作用下发生的一系列变化。TBARS涵盖了大部分氧化伤害产生的醛酮类物质,因而常作为诊断组织伤害和脂质过氧化程度的指标[30-31]。植物多酚与蛋白质以疏水键和多点氢键方式发生复合反应,使冷却猪肉表面发生收敛,减少水分蒸发,从而达到提高猪肉保水性的目的。随着贮存时间延长,微生物的生长繁殖加剧,对冷却猪肉肌肉组织结构的破坏越来越严重,致使冷却猪肉的汁液流失增加,大量营养物质流失;同时,微生物分泌的蛋白酶将会分解猪肉组织蛋白和氨基酸,使其降解形成氨类等碱性物质[32],从而使猪肉pH值不断增高,最终引起肉品腐败变质。本研究结果表明,TBARS值开始1周内有所降低,原因是猪肉通过冷却处理,降低了肉品脂肪的氧化,1周后,TBARS值有所上升,说明随着贮存时间延长,猪肉脂质氧化程度上升。比较各个处理发现,多酚处理后的猪肉,其TBARS、滴水损失率和pH值均显著降低(P<0.05),且较高质量浓度多酚处理组效果更好。可见,较高质量浓度多酚提取物显著抑制了TBARS的生成,提高了冷却猪肉脂质抗氧化能力,减少了冷却猪肉汁液流失。
植物多酚是植物中所含有的单宁及与单宁有生源关系的化合物。单宁特有的分子结构对于蛋白质有很好的结合作用。本试验中,冷却猪肉在贮存12 d时,测得的空白组、多酚b组和多酚a组的TVB-N 值分别为0.1 615、0.1 279 和0.1 135 mg·g–1,多酚b组和多酚a组相对于空白组TVB-N值降幅分别为20.80%、29.72%;测得的空白组、多酚b组和多酚 a组的 TBARS值分别为0.163、0.156和0.146 μg·g–1,多酚 b 组和多酚 a 组相对于空白组TBARS值降幅分别为4.29%、10.43%。结果表明,多酚提取物在冷却猪肉的保鲜过程中主要是作用于蛋白质,通过与蛋白质的结合,提高其存在的稳定性,从而减缓猪肉的腐败变质,延长冷却猪肉的货架期。
植物多酚具有天然的抗氧化和抑菌作用,且安全价廉,是一种天然的抗氧化剂和防腐剂。本研究采用燕麦多酚提取物对冷却猪肉进行处理,无论从微生物指标和理化指标方面,还是从肉色感官方面,都是比较理想的,且以燕麦多酚提取物质量浓度为0.150 g·L-1时,冷却猪肉的保鲜效果最好,可以贮存15 d。
[1] 王中凤,曾凡坤,章道明.猪肉保鲜技术研究[J].中国食品学报,2001,1(2):44-47.
[2] 贾英民,王 玲,马爱进,等.牛肉真空复合保鲜技术研究[J].农业工程学报,2002,18(1):118-121.
[3] 马俪珍,南庆贤,戴瑞彤,等.乳酸菌发酵液保鲜冷却猪肉的效果研究[J].中国农业科学,2004,37(8):1222-1228.
[4] 夏秀芳,孔保华.香辛料保鲜液与壳聚糖淀粉复合膜在冷却肉保鲜中的应用[J].食品科学,2007,28(11):590-595.
[5] 孙卫青,马俪珍,南庆贤.天然保鲜液对冷却猪肉保鲜效果的研究[J].中国农业科学,2007,40(8):1835-1842.
[6] 马俪珍,南庆贤.2种保鲜液处理冷却猪肉后的微生物、理化以及生物胺含量的变化[J].食品工业科技,2003,24(5):31-33.
[7] 郝教敏,马俪珍,王如福,等.多源复合天然保鲜剂对冷却猪肉的保鲜效果[J].中国食品学报,2012,12(6):113-119.
[8] HAO JIAOMIN,YANG WENPING,YANG HUA,et al.The application of a compound natural preservative solution to chilled beef and mutton under vacuum packaging during refrigerated storage[J].Food Science and Technology Research,2013,19(4):591-599
[9] 宋立江,狄 莹,石 碧.植物多酚研究与利用的意义及发展趋势[J].化学进展,2000,12(2):161 -170.
[10]廖春丽,汤缓缓,杨闪闪.苹果多酚抑制油脂氧化与抑菌特性的研究[J].中国调味品,2012,37(6):31-34.
[11]楼鼎鼎,戚炯炯,张 英,等.竹叶抗氧化物在双汇西式肉制品中的应用研究[J].中国食品学报,2006,6(3):111-114.
[12]郑立红,刘秀凤,梁建兰,等.3种活性成分对低温香肠中亚硝酸钠残留的影响[J].中国食品学报,2010,10(3):157-162.
[13]李 泽,靳 烨.天然抗氧化剂茶多酚在肉制品上的应用[J].农产品加工学刊,2006(11):67- 69.
[14]郝教敏,梁海燕,汪建国,等.茶叶浸提液对肉制品中亚硝酸盐的清除效应[J].食品研究与开发,2012,33(5):196-201.
[15] YANG HUA,MENG PEIPEI,XIONG YOULING,et al.Oxidation in HiOx-packaged pork longissimus muscle predisposes myofibrillar and sarcoplasmic proteins to N-nitrosamine formation in nitrite-curing solution[J].Meat Science,2013,95:465 -471.
[16] YANG HUA,MENG PEIPEI,WANG RUI,et al.Effect of oxidized myofibrils protein subjected to mutiple freeze-thaw cycles on N-nitrosamine formation in vitro model system[J].Journal of Advances in Chemical Engineering.2012,550-553,1590–1594.
[17]刘焕云,李慧荔,赵 红.燕麦麸中水溶性膳食纤维提取工艺优化[J].农业机械学报,2008,39(7):103-106
[18]李 莺,籍保平,周 峰,等.燕麦提取物清除自由基及抑制低密度脂蛋白氧化能力研究[J].食品科学,2008,29(6):75-78.
[19]李巨秀,李利霞,曾王旻,等.燕麦多酚化合物提取工艺及抗氧化活性的研究[J].中国食品学报,2010,10(5):14-21.
[20]魏 决,万 萍,罗 雯,等.燕麦油脂中甾醇和多酚的抗氧化活性研究[J].食品研究与开发,2011,32(9):9-12.
[21]刘 源,王锡昌,罗 殷.冰鲜法对黄鳍金枪鱼片品质的影响[J].食品科学,2010,31(2):273-276.
[22]中国国家标准化管理委员会.GB/T 9695.5—2008肉与肉制品pH测定[S].北京:中国标准出版社,2008:1- 4.
[23]占秀安,许梓荣.不同硒源对肥育猪鲜肉肉色和滴水损失的影响[J].畜牧兽医学报,2004,35(5):505 -509.
[24]质量技术监督行业职业技能鉴定指导中心组.食品质量检验—肉蛋及制品类[M].北京:中国计量出版社,2006:171-174.
[25]中国国家标准化管理委员会.GB/T 5009.44—2003肉与肉制品卫生标准的分析方法[S].北京:中国标准出版社,2003:354.
[26]中国国家标准化管理委员会.GB 4789.2—2010食品安全国家标准食品微生物学检验——菌落总数测定[S].北京:中国标准出版社,2010:1-5.
[27] MA LIZHEN,XIONG YOULING.Textural attributes and oxidative stability of pork longissimus muscle injected with marbling-like emulsified lipids[J].Meat Science,2011,(89):209 -216.
[28] BOTTA J R,LAUDER J T,JEWER M A.Effect of methodology on total volatile basic nitrogen(TVB-N)determination as an index of quality of fresh atlantic cod(Gadus morhua)[J].Journal of Food Science,1984,49(3):734-736.
[29]王中凤.猪肉保鲜技术研究的报告[J].中国畜产与食品,1999(6):310-311.
[30]李国林,李 莉,印大中.TBARS的新应用—表征羰基紧张[J].激光生物学报,2003,12(2):112-116.
[31]余灯广,高秋华,胡锦东,等.TBARS法测定胰岛素口腔喷雾剂中脂质过氧化物研究[J].分析科学学报,2005,21(1):78-80.
[32] DIMITRIOS G,IOANNIS A,PANAGIOTA K,et al.Effect of rosemary extract,chitosan and α -tocopherol on microbiological parameters and lipid oxidation of fresh pork sausages stored at 4 ℃[J].Meat Science,2007,76:172-181.

