短日照诱导对小豆叶片内源激素含量及其平衡的影响
董伟欣,路战远,任 帅,张彦立,谢 颍,刘 明,魏 岩,张月辰
(1.河北农业大学农学院,河北保定071001;2.内蒙古自治区农牧业科学院,内蒙古呼和浩特010000;3.石家庄农业学校,河北石家庄050000)
小豆作为研究光周期的良好材料,在光周期诱导过程中对小豆叶片激素的变化研究较少,且只对一个品种的一种或几种激素含量进行测定[1],很少涉及激素之间的比例及平衡状况,所以本研究采用早熟品种和晚熟品种通过不同生育阶段短日照诱导来研究几种激素含量的变化以及激素之间的动态平衡较有意义。在光周期诱导下,植物的生长和发育受激素含量及其平衡关系的影响[2-3],如随着日照时间逐渐变短,IAA,GA3,ZR含量逐渐减少,ABA含量逐渐增加,IAA,GA3,ZR与ABA起拮抗作用[4]。韩天富等[5]在开花前对超早熟大豆品种东农36进行短日处理,明显加快开花后发育进程,降低叶片中的ABA和ZRs含量,在幼苗期对晚熟品种自贡冬豆进行10 d左右的短日照处理,之后置于15 h长日照下,叶片的IAA含量高于全期长日照处理,ABA含量低于全期长日照处理。王成章等[6]研究发现,在8 h短日照处理下,3个不同秋眠性苜蓿品种的ABA含量为秋眠性品种Vernal>半秋眠性品种CW 502>非秋眠性品种CUF 101。另有研究表明,不同光周期处理对ABA和GA3的影响不同,短日照处理可以使菊花叶片的GA3和IAA含量减少,CTK和ABA含量增加,且CTK/IAA和CTK/GA3以及ABA/IAA和ABA/GA3比值也增加,有利于菊花花芽分化并提前开花[7]。WOOLEY 等[8]研究发现,长日照处理能促进GA3含量增加而使ABA含量降低。从以上资料可以看出,许多研究者只在不同短日照处理后研究其不同植物激素含量的变化,近年来,光周期处理下各种植物激素的含量以及他们之间的平衡关系有一些报道[7,9,10]。然而,通过不同生育阶段短日照诱导来研究不同激素的含量以及他们之间的平衡关系尚缺乏系统性。因此,本研究以早熟品种白红2号和晚熟品种唐山红小豆作为试验材料,采用酶联免疫法对不同生育阶段短日照诱导下的小豆叶片进行激素含量测定,为小豆在短日照胁迫下植株体内的激素含量变化及平衡提供理论参考。
1 材料与方法
1.1 试验设计
本试验以早熟品种白红2号、晚熟品种唐山红小豆作为试验材料(河北省农林科学院粮油作物研究所提供),于2012—2013年在河北农业大学教学试验基地进行,设置自然光照CK、处理Ⅰ:10 h光/14 h暗(出苗-分枝)、处理Ⅱ:10 h光/14 h暗(分枝-开花)、处理Ⅲ:10 h光/14 h暗(出苗-开花)4种处理,处理方法是每天18:00用黑红布遮光,次日早晨8:00揭开,田间种植采用随机区组设计,小区面积5 m×1.5 m,每个小区种植3行,行距40 cm,株距15 cm,每个处理重复3次。不同生育时期短日照处理完毕后在自然条件下生长至成熟。生育期间的管理同大田。
1.2 试验方法
1.2.1 取样方法 在开花期,结荚期和鼓粒期3个生育时期,于上午8:00采取自上数第2个完全展开的三出复叶测定内源激素。
1.2.2 样品预处理 将0.5 g称好的新鲜样品从-80℃取出后放入预冷的研钵中,加入少量的石英砂,加入2 mL样品提取液,在冰浴下研磨成匀浆,再用2 mL提取液分次将研钵冲洗干净,一并转入试管中,摇匀后放置在4℃冰箱中,之后4 000 r·min-1离心15 min,上清液过C-18固相萃取柱去除杂质和色素,将过柱后的样品转入5 mL塑料离心管中,真空浓缩干燥或用氮气吹干,除去提取液中的甲醇,用样品稀释液定容以待测定。
1.2.3 内源激素测定 激素测定采用酶联免疫技术(ELISA),试剂盒由中国农业大学化控室提供,试剂的配置参照何钟佩[11]的方法,使用美国BIO-RAD 680自动酶联测读仪进行OD值测定。试验结果采用logit曲线计算样品激素含量。
2 结果与分析
2.1短日照诱导对小豆发育进程的影响
由表1可以看出,与对照相比,不同生育阶段短日照诱导使2个品种的开花期和成熟期提前,白红2号提前的时间分别为3,1和5 d,唐山红小豆提前的时间分别为12,8和14 d,同时,2个品种的开花累计促进率也显著提高,不同生育阶段短日照诱导使2个品种开花提早时间不同,且处理Ⅲ提前最多,处理Ⅰ次之,处理Ⅱ提前最少,晚熟品种唐山红小豆对短日照更敏感,开花提早时间更多。

表1 短日照诱导对小豆发育进程的影响Table 1 Effects of short-day photoperiod inducement on flowering parameters of adzuki bean
2.2 短日照诱导对小豆叶片中4种激素含量的影响
2.2.1 短日照诱导对小豆叶片中GA1+3含量的影响 短日照诱导使2个小豆品种叶片中的GA1+3含量从开花至鼓粒期呈下降趋势,与对照相比,处理Ⅲ降低最多,处理Ⅰ次之,处理Ⅱ降低最少。白红2号在开花期的处理Ⅰ和处理Ⅲ与对照相比明显降低,处理Ⅱ降低不显著,3个处理在结荚期和鼓粒期与对照相比都有一定程度降低,但差异不显著。唐山红小豆在开花期的处理Ⅲ与对照相比明显降低,处理Ⅰ和处理Ⅱ降低不明显,但3个处理在结荚期和鼓粒期与对照相比都显著降低(图1)。
2.2.2 短日照诱导对小豆叶片中ABA含量的影响 由图2可知,短日照诱导使2个品种的ABA含量在3个生育阶段呈升高趋势。白红2号在开花期的处理Ⅲ明显高于对照,处理Ⅰ和处理Ⅱ升高不明显,在结荚期处理Ⅰ升高不显著,但处理Ⅱ明显降低,处理Ⅲ明显升高,在鼓粒期处理Ⅰ和处理Ⅲ升高不显著,但处理Ⅱ明显降低。唐山红小豆在3个生育阶段的处理Ⅰ和处理Ⅲ与对照相比都升高,但差异不显著,处理Ⅱ降低,差异不明显。
2.2.3 短日照诱导对小豆叶片中ZR含量的影响短日照诱导使白红2号在开花期的处理Ⅰ和处理Ⅱ都显著低于对照,处理Ⅲ升高,差异不显著。在结荚期的处理Ⅰ和处理Ⅲ明显升高,处理Ⅱ升高不明显。在鼓粒期都有一定程度的升高,但差异不显著。唐山红小豆在开花期升高不显著。在结荚期和鼓粒期处理Ⅲ都显著升高,处理Ⅰ和处理Ⅱ都升高,但差异不明显(图3)。
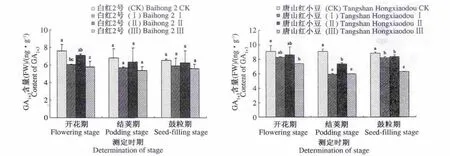
图1 短日照诱导对小豆叶片中GA1+3含量的影响Fig.1 Effects of short-day photoperiod inducement on GA1+3content of adzuki bean in tested cultivars
2.2.4 不同生育时期短日照对小豆叶片IAA含量的影响 短日照诱导使2个品种叶片中的IAA含量从开花至鼓粒期呈下降趋势,与对照相比,处理Ⅲ降低最多,处理Ⅰ次之,处理Ⅱ降低最少。与GA1+3含量类似,白红2号在开花期处理Ⅰ和处理Ⅲ与对照相比,显著降低,处理Ⅱ降低不明显,在结荚期处理Ⅲ显著降低,处理Ⅰ和处理Ⅱ降低不明显,在鼓粒期都下降,但差异不显著。唐山红小豆在开花期和结荚期的处理Ⅲ与对照相比,明显降低,处理Ⅰ和处理Ⅱ降低不明显,在鼓粒期处理Ⅰ和处理Ⅲ降低显著,处理Ⅱ降低不显著(图4)。

图2 短日照诱导对小豆叶片中ABA含量的影响Fig.2 Effects of short-day photoperiod inducement on ABA content of adzuki bean in tested cultivars
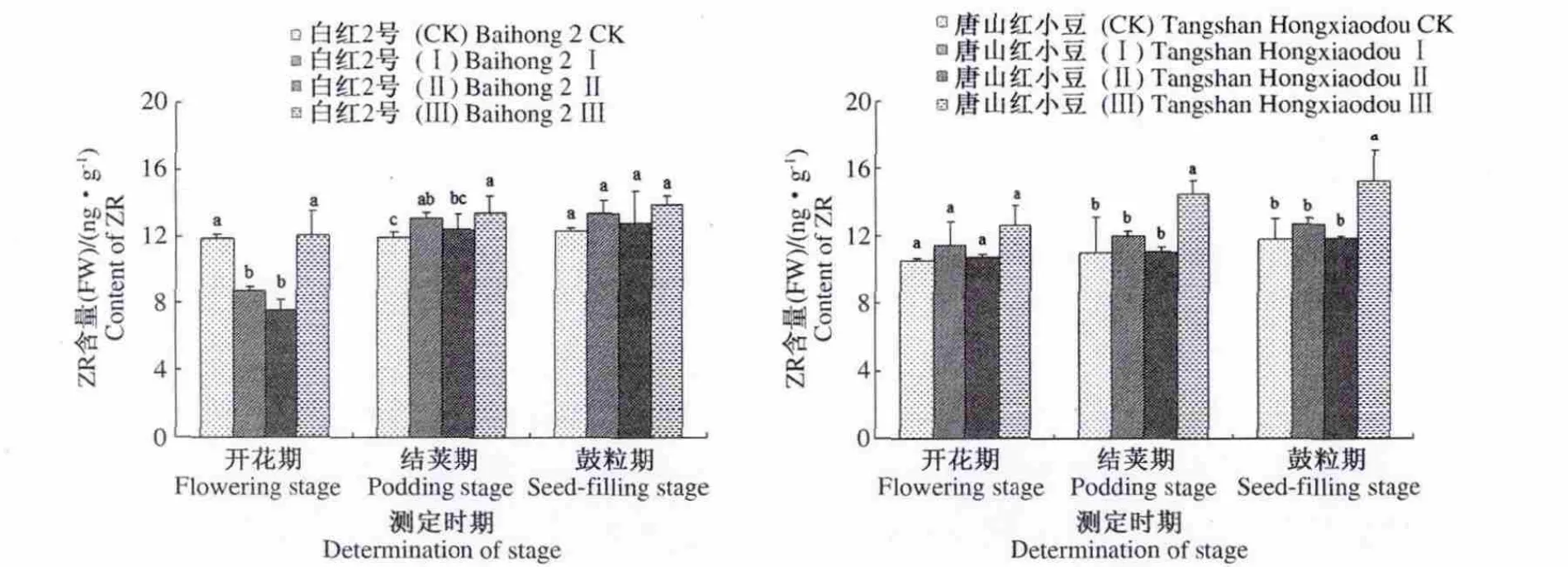
图3 短日照诱导对小豆叶片中ZR含量的影响Fig.3 Effects of short-day photoperiod inducement on ZR content of adzuki bean in tested cultivars

图4 短日照诱导对小豆叶片中IAA含量的影响Fig.4 Effects of short-day photoperiod inducement on IAA content of adzuki bean in tested cultivars
2.3 短日照诱导对小豆叶片中GA1+3/ABA,ZR/ABA,IAA/ABA和(ZR+GA1+3)/ABA的影响
2.3.1 短日照诱导对小豆叶片中GA1+3/ABA的影响 短日照诱导使2个品种的GA1+3/ABA在3个生育阶段都降低,其中处理Ⅲ降低最多,处理Ⅰ次之,处理Ⅱ降低最少。白红2号在开花期的处理Ⅰ和处理Ⅲ与对照相比,明显下降,处理Ⅱ降低不明显,在结荚期和鼓粒期各个处理与对照相比都降低,但差异不显著。唐山红小豆在开花期和鼓粒期的处理Ⅲ显著降低,其余处理降低不显著,结荚期的3个处理与对照相比都显著降低(表2)。
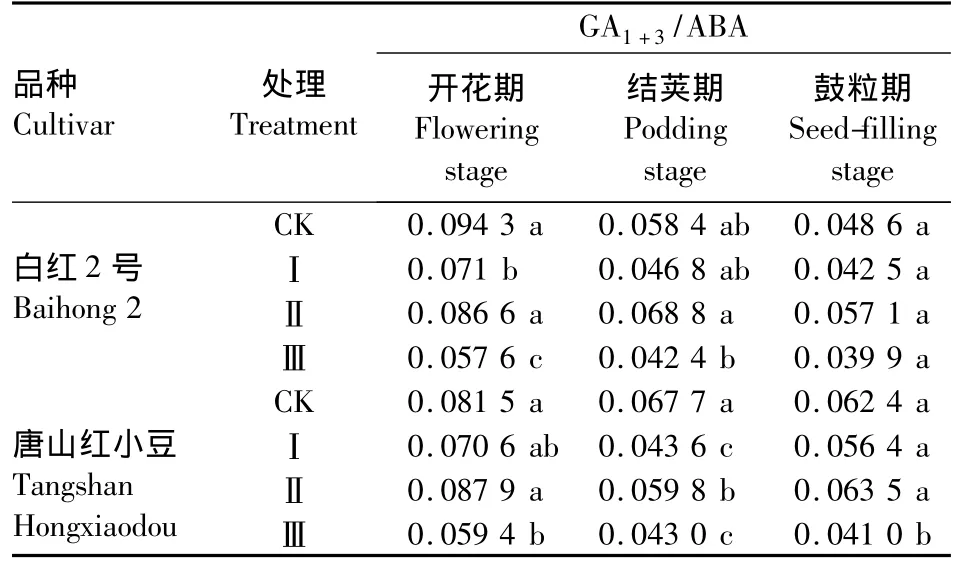
表2 短日照诱导对小豆叶片中GA1+3/ABA的影响Table 2 Effects of short-day photoperiod inducement on GA1+3/ABA of adzuki bean in tested cultivars
2.3.2 短日照诱导对小豆叶片中ZR/ABA的影响 由表3可知,白红2号在开花期的3个处理与对照相比都明显降低,在结荚期和鼓粒期都升高,处理Ⅱ差异明显,处理Ⅰ和处理Ⅲ差异不明显。唐山红小豆的3个处理在3个生育阶段与对照相比都升高,在开花期处理Ⅱ显著升高,其余处理差异不显著,在结荚期和鼓粒期处理Ⅲ差异显著,其余差异不明显。

表3 短日照诱导对小豆叶片中ZR/ABA的影响Table 3 Effects of short-day photoperiod inducement on ZR/ABA of adzuki bean in tested cultivars
2.3.3 短日照诱导对小豆叶片中IAA/ABA的影响 由表4可知,短日照诱导使小豆叶片的IAA/ABA总体呈现降低趋势。白红2号在开花期的处理Ⅰ和处理Ⅲ显著降低,处理Ⅱ降低不明显,在结荚期处理Ⅱ稍有升高,处理Ⅲ显著降低,处理Ⅰ降低不明显,在鼓粒期,处理Ⅱ升高,其余处理降低,差异都不显著。唐山红小豆在开花期和结荚期的处理Ⅱ与对照相比升高,其余处理均降低,在开花期差异显著,结荚期差异不显著,在鼓粒期除处理Ⅲ明显降低外,其余处理降低均不明显。
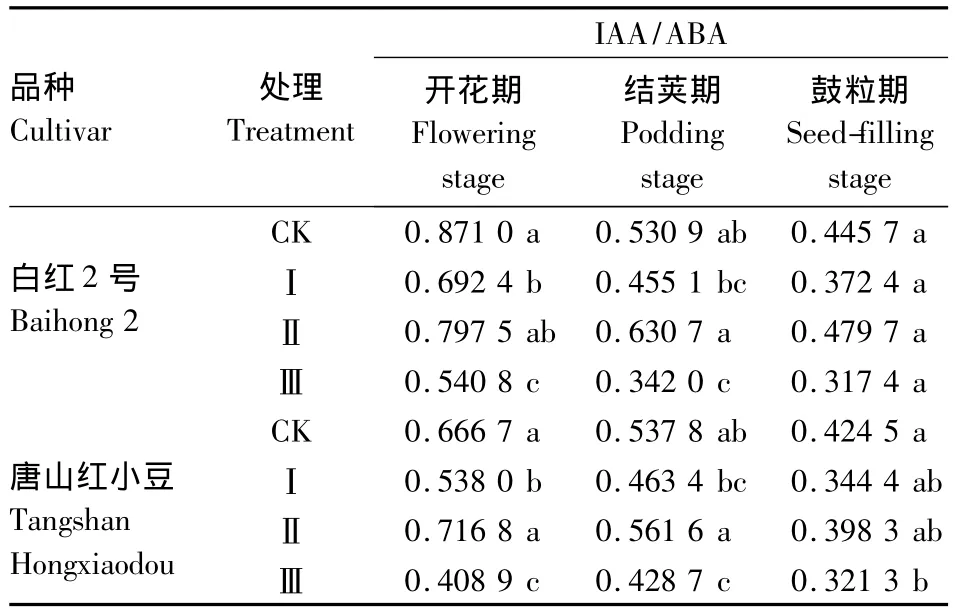
表4 短日照诱导对小豆叶片中IAA/ABA的影响Table 4 Effects of short-day photoperiod inducement on IAA/ABA of adzuki bean in tested cultivars
2.3.4 短日照诱导对小豆叶片中(ZR+GA1+3)/ABA的影响 与GA1+3/ABA和IAA/ABA类似,短日照诱导使小豆叶片的(ZR+GA1+3)/ABA也呈现降低趋势。与对照相比,白红2号在开花期的处理Ⅰ和处理Ⅲ明显降低,处理Ⅱ降低不明显,结荚期和鼓粒期的处理Ⅱ升高,差异不显著,其余处理降低,结荚期差异显著,鼓粒期差异不显著。唐山红小豆在开花期和结荚期的处理Ⅱ升高,差异不明显,其余处理降低,处理Ⅰ差异不显著,处理Ⅲ差异显著,在鼓粒期的处理Ⅲ显著降低,其余处理降低不明显(表5)。
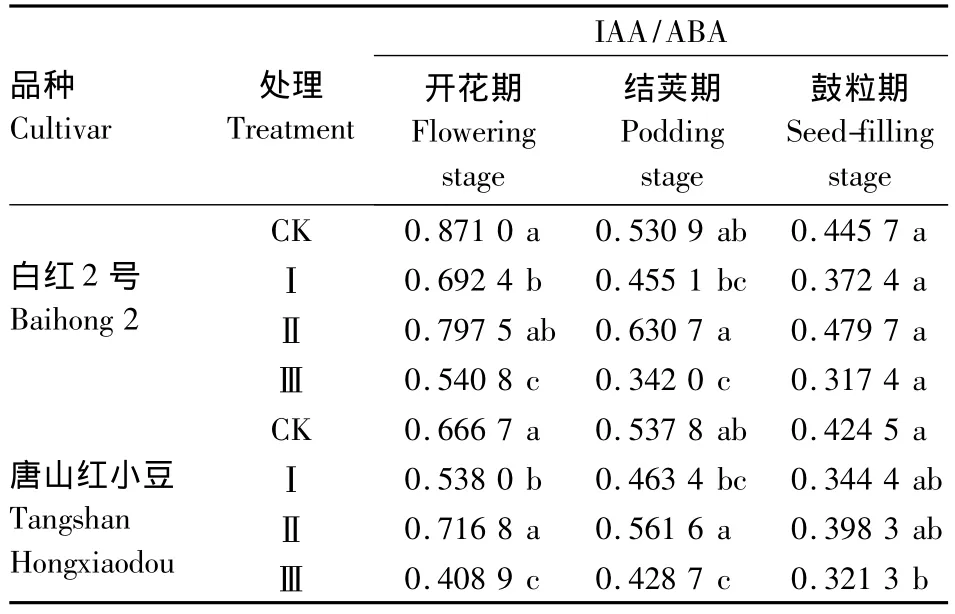
表5 短日照诱导对小豆叶片中(ZR+GA1+3)/ABA含量的影响Table 5 Effects of short-day photoperiod inducement on(ZR+GA1+3)/ABA of adzuki bean in tested cultivars
3 讨论与结论
短日照可以改变植物体内激素含量以及激素之间的动态平衡,如短日照可大幅度提高扁豆植株体内的 GA含量并提高 GA/ABA的比例[12]。GROCHOWSKA等[13]研究表明,苹果各短枝内CTK/GA比值越大,花芽分化数越多,而促花措施又可提高CTK/GA比值。韩天富等[14]的研究表明,短日照诱导使脱落酸(ABA)含量显著上升,赤霉素(GA1+3)含量及GA/ABA比例明显下降。另外,水稻颖花开放不受光照诱导,相反由光处转入暗处或自然开放前的遮光能促进颖花开放[15]。本研究发现,短日照诱导使GA1+3和IAA含量降低,ABA和ZR含量升高,同时也改变了植物激素的比例,短日照诱导使 ZR/ABA的比例提高,GA1+3/ABA,IAA/ABA和(ZR+GA1+3)/ABA的比例降低。这些结果说明,生长促进和抑制的激素之间,可能是通过此消彼长的变化保持总量的相对稳定,当它们比例的变化达到一定程度时,将会影响小豆的发育进程,其中,GA1+3和ABA可能起着很重要的作用。这与前人研究略有不同,推测原因可能是不同作物对光周期的感受不同,也可能是遮光的时期和和遮光的时间不同所导致的,其机制有待于进一步研究。不同品种对光周期的反应也不一样,晚熟品种对光周期的敏感程度大于早熟品种,但内源激素的变化趋势大致相同,晚熟品种唐山红小豆的GA1+3/ABA在开花期和鼓粒期都高于早熟品种白红2号,这能够反映出晚熟品种在受到短日照诱导后可提前开花和成熟,激素含量的变化可能涉及植株体内的某些生理生化变化而导致发育速度的改变。这些内在变化机制需深入研究。
花荚脱落是影响小豆产量的制约因素。目前,育种工作中的花期不遇以及生产上正常成熟前的自然灾害也给小豆的产量造成巨大损失,这就涉及到小豆的花期和成熟期,小豆属于一种典型的短日照杂粮作物[16],因此,利用人工控制光周期来调控小豆的花期和成熟期具有重要实践意义。现在,在某些作物上已经应用化学调控来控制开花期,如上午以0.4 ~ 4.0 mmol·L-1的茉莉酸甲酯(MeJA)和茉莉酸(JA)处理离体稻穗后,可在30 min内诱导水稻颖花大量开放[17],同时茉莉酸甲酯(MeJA)对高粱、苏丹草[18],黑麦草[19],小麦、黑麦、高羊茅草[20],谷子[21]等多种禾本科植物的颖花开放表现出普遍的诱导效应。因此,在研究了不同生育阶段小豆叶片内源激素变化的基础上,在不同的发育阶段化学调控小豆的开花期和成熟期具有重要意义。
综上所述,短日照诱导可以改变小豆叶片的激素含量和动态平衡,小豆在子叶破土就可以感受光周期,只是在不同的时期感受光周期的敏感程度不同,所以,在不同生育阶段短日照诱导使小豆叶片的激素含量有不同程度的变化,促进植物生长的激素GA1+3和IAA含量降低,加速植物成熟和衰老的激素ABA和ZR含量升高,同时短日照诱导也改变了小豆叶片激素的比例,ZR/ABA呈升高趋势,GA1+3/ABA,IAA/ABA和(ZR+GA1+3)/ABA呈降低趋势。由此可见,激素含量的变化可使小豆的开花期和成熟期提前。这些结论对于开花期和成熟期的人工调控以及避免自然灾害具有重要指导意义。
[1] 尹宝重,陶 晡,张月辰.短日照对不同叶龄红小豆幼苗的诱导效应[J].作物学报,2011,7(8):1475-1484.
[2] RICHARDS D E,KING K E,AITALI T,et al.How gibberellin regulates plant growth and development:a molecular genetic analysis of gibberellin signaling[J].Annu Rev Plant Physiol Plant Mol Biol,2001,52:67 -88.
[3] 童 哲,赵玉锦,王 台,等.植物的光受体和光控发育研究[J].植物学报,2000,42(2):111 -115.
[4] 吴鹏举.光周期对不同秋眠类型紫花苜蓿phyA,phyB mRNA和植物激素含量的影响[D].郑州:河南农业大学,2011:1-2.
[5] 韩天富,盖钧镒.大豆几种光周期处理效应的植物激素解析[J].作物学报,1999,25(3):349-355.
[6] 王成章,韩锦峰,胡喜峰,等.光周期对不同秋眠性苜蓿品种 ABA 含量的影响[J].作物学报,2005,31(10):1370-1372.
[7] 林贵玉,郑成淑,孙宪芝,等.光周期对菊花花芽分化和内源激素的影响[J].山东农业科学,2008(1):35-39.
[8] WOOLEY D J,WAREING P F.The interaction between growth promoters in apical dominance[J].New Phytol,1972,71(6):781 -793.
[9] 李娅丽.不同光周期对山茶花成花影响的研究[D].雅安:四川农业大学,2005:3-4.
[10]李秀菊,孟繁静.大豆成花的光周期诱导研究:Ⅱ.顶芽内植物激素及同化物的变化[J].中国农业大学学报,1997,2(1):51 -55.
[11]何钟佩.农作物化学控制实验指导[M].北京:北京农业大学出版社,1992.
[12]袁 娟,武天龙,陈 典.光周期对扁豆真叶内源激素及游离氨基酸含量的影响[J].上海交通大学学报:农业科学版,2004,22(3):215 -226.
[13] GROCHOWSKAM J,KARASZEWSKA A,JANKOOWSKA B.The pattern of hormones of intactapple shoots and its changes after spraying with growth regulators[J].Acta Hortic,1984,149:25 -38.
[14]韩天富,马凤鸣,王金陵,等.光周期对大豆叶片内源激素含量及其平衡的影响[J].作物学报,1996,22(6):661-666.
[15]顾蕴洁,王 忠,高煜珠.环境因素对水稻颖花开闭影响的机理[J].植物生理学报,1993,19(4):345-352.
[16]蒋陵秋,金文林.小豆生长发育规律的研究 Ⅷ 小豆短日处理的效应[J].北京农学院学报,1991,6(1):22-28.
[17] ZENG X C,ZHOU X,ZHANG W,et al.Opening of rice floret in rapid response to methyl jasmonate[J].Journal of Plant Growth Regulation,1999,18(4):153 -158.
[18]高夕全,曾晓春,王树才,等.茉莉酸甲酯与水杨酸在诱导高粱和苏丹草颖花开放中的效应[J].中国农学通报,2000,16(3):7 -9.
[19]甘立军,曾晓春,夏 凯,等.茉莉酸甲酯与水杨酸在诱导黑麦草颖花开放中的拮抗效应[J].植物生理学通讯,2001,37(1):9 -11.
[20]闫芝芬,周 燮,马春红,等.冠毒素和茉莉酸甲酯对诱导小麦、黑麦和高羊茅草颖花开放的效应[J].中国农业科学,2001,34(3):334 -337.
[21]李会霞,王玉文,田 岗,等.茉莉酸甲酯对谷子颖花开放的诱导效应[J].中国农学通报,2006,22(7):298-301.

