颈静脉灌注精氨酸对泌乳奶牛养分消化和氮利用的影响
徐巧云 丁洛阳 王梦芝 周 刚 张 鑫 冀德君
(扬州大学动物科学与技术学院,扬州225009)
颈静脉灌注精氨酸对泌乳奶牛养分消化和氮利用的影响
徐巧云 丁洛阳*王梦芝**周 刚 张 鑫 冀德君
(扬州大学动物科学与技术学院,扬州225009)
本文主要研究颈静脉灌注精氨酸对泌乳奶牛养分消化和氮利用的影响。采用3×3拉丁方试验设计,6头体重、胎次、泌乳期、泌乳量、体况基本一致的荷斯坦奶牛随机分为3组(每组2头):酪蛋白模式组(颈静脉灌注酪蛋白模式的氨基酸混合物,对照组)、精氨酸组(颈静脉灌注精氨酸)、丙氨酸组(颈静脉灌注与精氨酸组等氮的丙氨酸);每试验期22 d,包括7 d的灌注期和15 d的间隔期。测定其尿、血清、乳中尿素氮浓度及养分表观消化率指标。结果表明:尿、血清中尿素氮浓度在组间无显著差异(P>0.05),精氨酸组乳中尿素氮浓度显著低于对照组和丙氨酸组(P<0.05);精氨酸组干物质、有机物、粗蛋白质、中性洗涤纤维的表观消化率皆显著高于丙氨酸组(P<0.05);乳蛋白氮产量以精氨酸组最高,显著高于其他2组(P<0.05);乳蛋白氮占摄入氮比例也以精氨酸组最高。综上,灌注精氨酸对泌乳中期奶牛氮的消化、利用有一定的促进作用,可提高乳蛋白氮产量及其占摄入氮比例。
灌注精氨酸;氮利用;养分消化;奶牛
反刍动物的尿素氮再循环对维持氮平衡有着重要的意义[1],其中,在肝脏中合成的尿素有40%~80%会进入到消化道内[2]。徐红蕊等[3]曾报道,反刍动物肝脏中产生的尿素33%随尿液排出,67%进入消化道,后者又有10%随粪便排出。随粪尿排出的氮一方面表明氮不能被充分地利用;另一方面也成为威胁环境的隐患,而且将随饲养规模扩大而加剧。为此,提高反刍动物对氮的利用效率及降低其粪尿中氮的排出则显得越来越迫切。精氨酸(Arg)是目前发现的功能较多的氨基酸之一,同时也是在构成生物体组织蛋白质的20种基本氨基酸中最高的氮携带者。在哺乳动物中,尿素循环中的鸟氨酸可转变为Arg;反之,经精氨酸酶催化的Arg可转变为尿素和鸟氨酸,进而参与氮代谢循环[4]。在饲粮中添加Arg可促进体内氮的沉积,且能提高猪的日增重和饲料的转化率[5]。饲喂缺乏Arg的饲粮,大鼠则表现为失重并出现氮负平衡的现象[6]。另外,Arg及其代谢产物一氧化氮(NO)的途径具有促进乳腺及乳腺内血管的生长、提高营养物质的摄取量、改善奶牛的乳腺组织发育从而提高泌乳性能的作用[7]。早在1982年Pau等[8]就研究证实,给孕期大鼠饲喂缺乏Arg的饲粮降低了大鼠乳腺DNA和RNA的含量,并认为Arg是乳腺正常分化所必需的。Alkareem等[9]采用Arg和NO抑制剂处理孕期大鼠,结果表明Arg处理促进了大鼠乳腺组织乳导管树和腺泡的发育。本课题组前期采用奶牛乳腺上皮细胞的研究也发现了类似的结果,即:Arg可促进奶牛乳腺上皮细胞的增殖和其酪蛋白的合成,该研究同时阐明了Arg可通过哺乳动物雷帕霉素(mTOR)途经机制来促进乳中酪蛋白的表达[10]。但是,对于Arg促进乳腺酪蛋白合成的同时,是否促进奶牛体内氮的消化和吸收代谢尚不明了。本试验通过颈静脉灌注不同氨基酸来改变泌乳中期奶牛Arg供给量,观察奶牛泌乳性能、氮平衡、养分消化的变化,以研究Arg是否通过提高氮利用来影响其泌乳性能。
1 材料与方法
1.1 试验动物与饲粮
本试验试验动物来自扬州大学实验农牧场。选择6头体重、胎次(4胎)、泌乳期[(80±2) d]、泌乳量[(21.0±1.0) kg/d]、体况(评分3.0)等均基本一致的荷斯坦奶牛作为试验动物。参照NRC(2001)奶牛饲养标准配制试验用基础饲粮。基础饲粮的组成及营养水平见表1。其中,饲粮中的羊草单独喂给,其他饲料为采用全混合的形式饲喂。试验奶牛单圈饲养,饲养管理一致,每天早晚2次等量饲喂(羊草先饲、混合料后饲),挤奶3次,自由饮水。
1.2 试验设计
采用3×3拉丁方试验设计,试验牛随机分为3组,分别为酪蛋白模式组(颈静脉灌注酪蛋白模式的氨基酸混合物,对照组)、Arg组[在体外细胞试验结果的基础上,选择促进酪蛋白表达最优的Arg 2倍浓度进行灌注,灌注量为37.66 g/(L·d)]、丙氨酸组[与Arg组等氮,灌注量为77.24 g/(L·d)];每期试验22 d,包括灌注期7 d,间隔期15 d。氨基酸灌注液由江苏南京剑桥生物科技有限公司配制,每组每天经由颈静脉滞留针匀速灌注8 h,灌注总量皆为4 L。
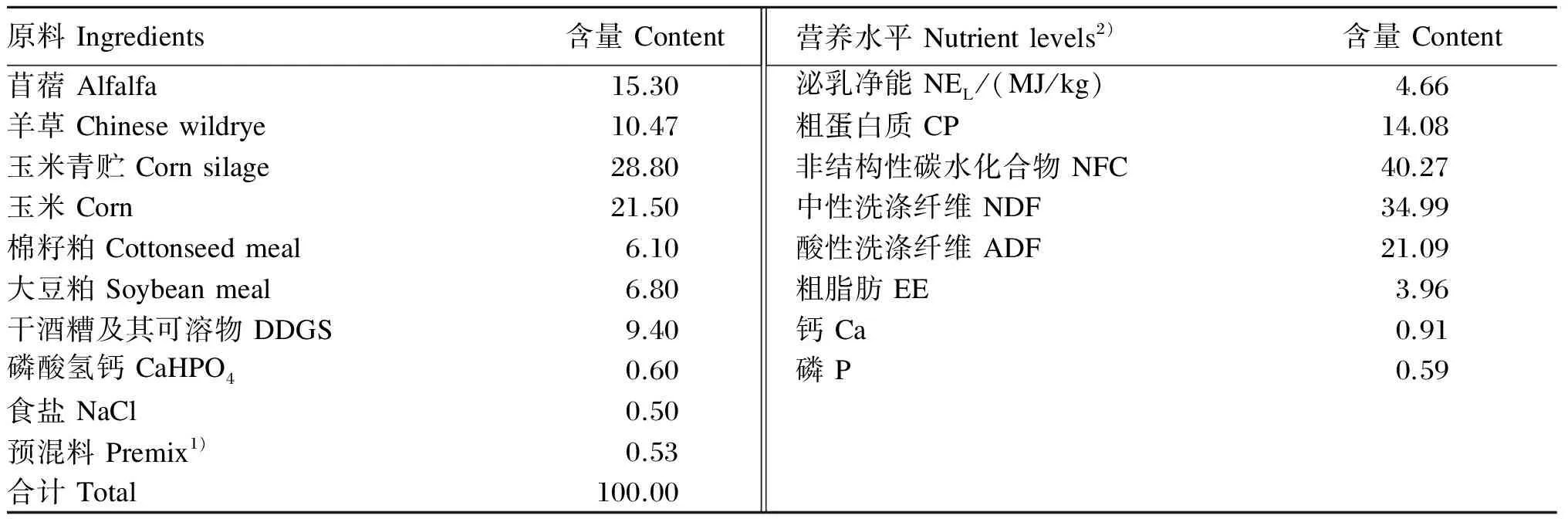
表1 基础饲粮的组成及营养水平(干物质基础)
1)预混料为每千克饲粮提供 The premix provided following per kg of diet:CuSO425 mg,FeSO4·H2O 75 mg,ZnSO4·H2O 105 mg,Co 0.002 4 mg,Na2SeO30.016 mg,VA 12 000 IU,VD310 000 IU,VE 25 mg,烟酸 nicotinic acid 36 mg,胆碱 choline 1 000 mg。
2)泌乳净能为计算值,其他营养水平为实测值。NELwas a calculated value, while the other nutrient levels were measured values.
1.3 样品采集与测定
1.3.1 干物质采食量
试验期间试验牛皆饲喂基础饲粮,预试期15 d以使试验牛以适应和排空,并观察采食量;7 d灌注期间每天对试验牛的采食量和余料进行称量,测定干物质含量并计算平均每头牛每天的干物质采食量。
1.3.2 血清采集及测定
灌注期的最后2 d晨饲前,于尾动脉采集血液并置于促凝管中。而后将血液于4 ℃、447.2×g离心20 min,并取血清用于尿素氮浓度测定。
1.3.3 尿样采集及测定
灌注期的最后2 d尽量无损地采集奶牛的尿液,按每100 mL尿液中加入2 mL 2%硫酸和甲苯4滴。全天轮流值班在试验牛排尿时及时用比较深的桶收集,桶中预放的硫酸量是按预试期获得的排尿量信息估计添加的。每次采集称重后取样100 mL,全天的尿样混匀后用于尿素氮浓度测定。
1.3.4 乳样采集及测定
灌注期最后2 d,每天记录每头牛早、中、晚产奶量,计算平均值,并在各时间点采1管乳样充分混匀,用于尿素氮浓度测定。采用扬大康源乳业丹麦福斯120乳品检测仪(红外线)检测乳蛋白氮产量。
采用尿素氮测试盒(C013-1,南京建成生物工程研究所)测定上述血清、乳、尿中含尿素氮浓度,具体测定步骤参见试剂盒说明书。
1.3.5 粪样采集及测定
灌注期最后2 d部分收集各头牛的粪样,按照100 g粪便加2%硫酸 20 mL的量固氮,粪样于65 ℃烘干粉碎后制成分析样品,用于测定有机物、粗蛋白质、中性洗涤纤维、酸性洗涤纤维的含量,采用张丽英[11]的方法。
1.3.6 饲粮样采集及测定
灌注期每天采集等量所饲喂饲粮并充分混匀后,用于测定有机物、粗蛋白质、中性洗涤纤维、酸性洗涤纤维的含量,采用张丽英[11]的方法。
1.3.7 表观消化率的计算
采用酸不溶灰分(AIA)作为内源指示剂进行养分表观消化率的计算,公式为:
某养分的表观消化率(%)=1-bc/ad[12]。
式中:a为饲粮中某养分的含量;b为粪样中某养分的含量;c为饲粮中AIA的含量;d为粪样中AIA的含量。
1.3.8 氮利用指标的计算
依据以下公式计算氮利用指标:
粪氮占干物质采食量比例(%)=
粪氮/干物质采食量;
乳蛋白氮占摄入氮比例(%)=
乳蛋白氮/摄入氮;
代谢氮占摄入氮比例(%)=
(摄入氮-粪氮-尿氮)/摄入氮;
氮平衡=摄入氮-粪氮-尿氮-乳蛋白氮。
1.4 统计分析
用Excel 2013对试验数据进行整理,采用SPSS 16.0软件进行方差分析和Duncan氏多重比较。P<0.05为显著差异水平。
2 结果与分析
2.1 尿、血清、乳中的尿素氮浓度
图1表明,血清和尿中尿素氮浓度在组间无显著差异(P>0.05),但Arg组的血清中尿素氮浓度数值上低于酪蛋白模式组和丙氨酸组。Arg组的乳中尿素氮浓度显著低于酪蛋白模式组和丙氨酸组(P<0.05),但酪蛋白模式组与丙氨酸组差异不显著(P>0.05)。

数据肩标不同字母表示差异显著(P<0.05)。下图同。
Values with different letter superscripts mean significantly difference (P<0.05). The same as below.
图1 灌注精氨酸对泌乳奶牛尿、血清、乳中尿素氮浓度的影响
Fig.1 Effects of Arg infusion on the urea-N concentration in urine, serum and milk of lactating cows
2.2 养分表观消化率
图2表明,干物质采食量在组间的差异不显著(P>0.05)。干物质和有机物的表观消化率在组间则有显著差异(P<0.05),其中,酪蛋白模式组、Arg组间干物质和有机物的表观消化率基本一致,皆显著高于丙氨酸组(P<0.05)。

图2 灌注精氨酸对泌乳奶牛有机物和干物质表观消化率的影响
图3表明,酪蛋白模式组和Arg组粗蛋白质、中性洗涤纤维的表观消化率没有显著差异(P>0.05),Arg组显著高于丙氨酸组(P<0.05);酸性洗涤纤维表观消化率在3组间没有显著的差异(P>0.05),但Arg组在数值上也略高于酪蛋白模式组和丙氨酸组。
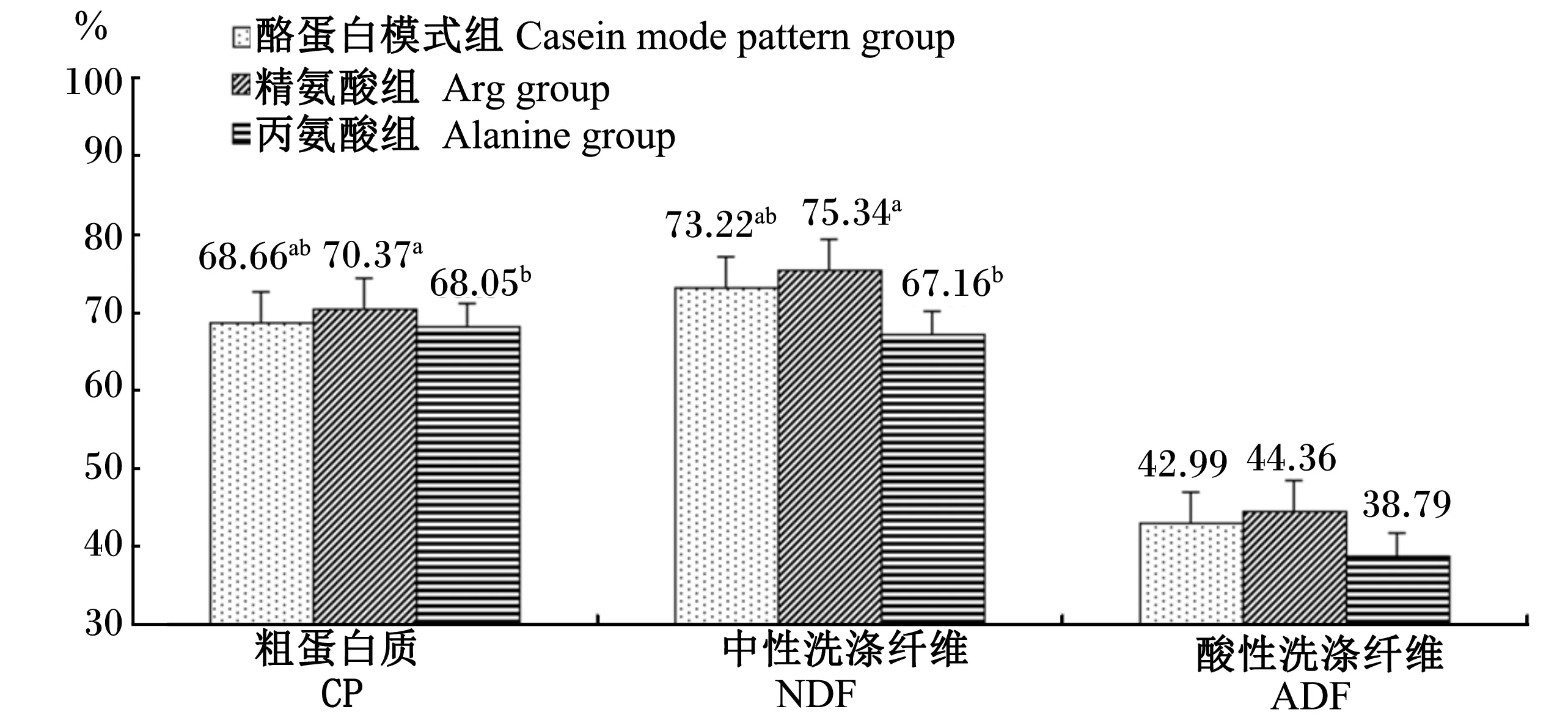
图3 灌注精氨酸对泌乳奶牛粗蛋白质和纤维物质表观消化率的影响
2.3 氮平衡
表2表明,摄入氮和粪氮排出量在组间的差异不显著(P>0.05)。Arg组粪氮占干物质采食量比例显著低于丙氨酸组(P<0.05),与酪蛋白模式组差异不显著(P>0.05)。尿氮排出量在组间的差异显著(P<0.05),丙氨酸组显著高于酪蛋白模式组和Arg组(P<0.05),酪蛋白模式组也显著高于Arg组(P<0.05)。乳蛋白氮产量在3组之间的差异显著(P<0.05),以Arg组最高,丙氨酸组次之,酪蛋白模式组最低。乳蛋白氮占摄入氮比例也以Arg组最高,后依次为丙氨酸组、酪蛋白模式组,组间差异不显著(P>0.05)。代谢氮占摄入氮比例为Arg组>酪蛋白模式组>丙氨酸组。酪蛋白模式组、Arg组、丙氨酸组的氮平衡分别为121.19、108.50、83.65 g/d,以丙氨酸组较低。
3 讨 论
3.1 灌注精氨酸对乳中尿素氮浓度与乳蛋白氮产量的影响
反刍动物瘤胃中的微生物可以通过脲酶将尿素水解为二氧化碳(CO2)和氨,再氨化酮酸形成氨基酸用于合成微生物蛋白(MCP),而MCP经小肠内蛋白酶的作用酶解成各种氨基酸,最后被吸收利用[13]。Bloomfield等[14]通过使用15N标记尿素的方法以及Land等[15]通过使用15N标记铵盐的方法研究发现,标记的氮可以转移到用于合成体蛋白质和乳蛋白的氨基酸上;尿素同时也是反刍动物体内氨和氨基酸代谢的主要终产物[13]。因此,血清尿素氮浓度可以比较准确地反映动物体内氨基酸和蛋白质代谢情况[16]。由于尿素氮可在细胞膜上自由、快速扩散,乳尿素氮近年来被用于替代血清尿素氮以监测饲粮蛋白质水平以及预测向环境中排放的氮量。李红宇等[17]即曾报道可以用乳中尿素氮浓度监测饲粮蛋白质的代谢情况。邹彩霞等[18]进一步研究表明,乳中尿素氮浓度与乳蛋白率呈负直线相关,可作为衡量氮利用率以及奶牛蛋白质营养供应状况的指征。本试验结果表明,Arg组显著降低了乳中的尿素氮浓度;而且,该组血清尿素氮浓度也在数值上低于酪蛋白模式组;同时,该组的乳蛋白氮产量以及乳蛋白氮占摄入氮比例也高于其他组。以上结果表明Arg灌注可能通过提高氮利用率来提高乳蛋白的合成。
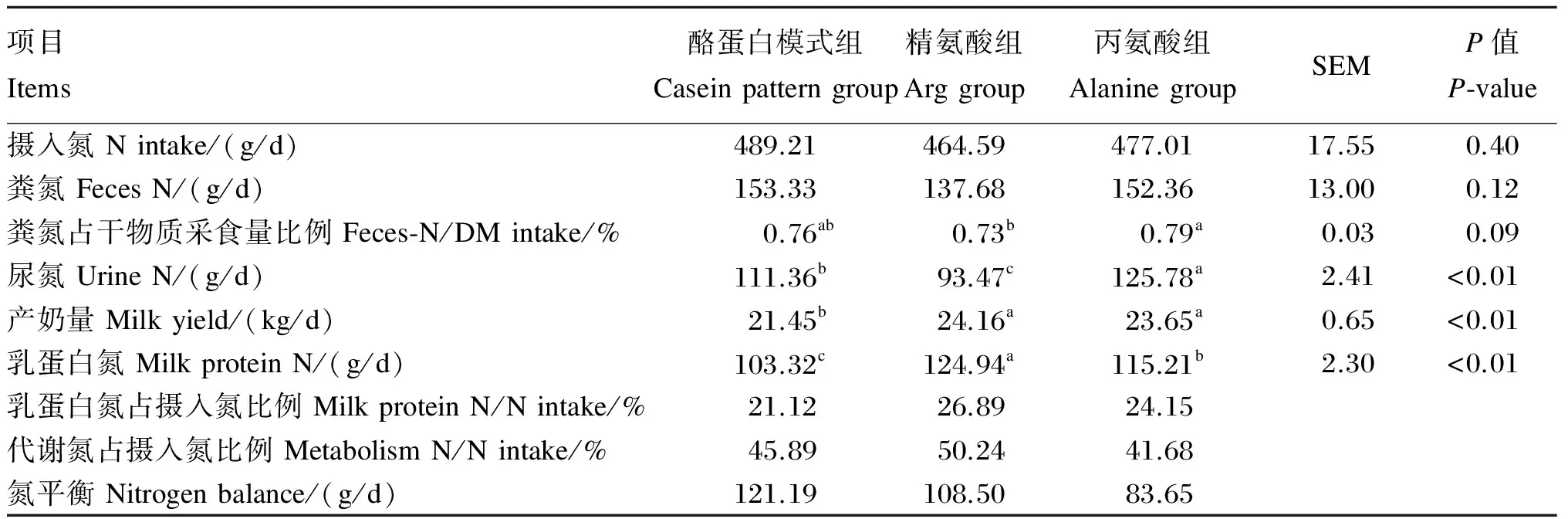
表2 灌注精氨酸对泌乳奶牛氮利用的影响
同行数据肩标字母不同表示差异显著(P<0.05)。
Values in the same row with different letter superscripts differ significantly (P<0.05).
3.2 灌注精氨酸对氮利用的影响
反刍动物氮的代谢包括饲粮氮的摄入、蛋白质在瘤胃以及后消化道的消化和降解、蛋白质在胃肠道的吸收、外周组织对氨基酸的利用等主要途径[19]。粪氮和尿氮是食入氮的2个损失部分,粪氮是经过消化道而没有被吸收的部分,这部分的氮受饲粮蛋白质水平的影响较大,尿氮是被吸收的氨基酸参加组织代谢,没有被利用合成体蛋白质而脱氨后随尿排出的部分,这部分的氮受到饲粮氨基酸平衡的影响较大[20]。因此,饲粮粗蛋白质水平的高低或者氨基酸的平衡性都会影响饲粮氮的利用。有试验表明,随饲粮蛋白质水平的增加,摄入氮也会随之增加,且粪氮的排出量也有增加的趋势。当饲粮粗蛋白质水平高于11.0%时,沉积氮显著降低[21]。而当用非必需氨基酸来提供大鼠日耗30%~45%的氮时,氮沉积和氨基酸的利用率可以达到最佳的状态[22]。在本试验中,丙氨酸组的粗蛋白质表观消化率显著低于Arg组,低于酪蛋白模式组;尿氮的排出量也显著高于其他2组。分析其原因可能是由于粗蛋白质水平过高以及氨基酸不平衡性所致。Arg组或丙氨酸组是在酪蛋白模式组基础上的灌注,丙氨酸组额外添加的丙氨酸导致了其粗蛋白质含量的增加和氨基酸的不平衡,进而影响了其饲粮氮的消化和利用。
奶牛饲养满足需要并且饲养相对稳定时,粪氮排出量与干物质采食量存在相对稳定的比例,其比例约为0.60%[23]。本试验中,各组粪氮占干物质采食量比例在0.73%~0.79%,都略高于0.60%。这可能是由于本试验中氮的供给量略高于体重550 kg、泌乳21 kg/d(乳脂率为4%)时荷斯坦奶牛的氮需要量(代谢蛋白质需要量为1 720.98 g/d,折算氮需要量为275.34 g/d,估算摄入氮约为447.71 g/d)所致[24]。组间比较来看,Arg组粪氮占干物质采食量比例显著低于丙氨酸组。在总氮供给量没有显著差异时(464.59 g/d vs. 477.01 g/d),粪氮占干物质采食量比例减少的主要原因之一即是氮消化利用率升高。这与该组的乳中尿素氮浓度较低、尿氮排出量较低等相互佐证,一致地表明Arg灌注可通过促进氮消化、吸收而提高乳蛋白的合成量。Arg组和酪蛋白模式组比较,虽然粗蛋白质的表观消化率和粪氮占干物质采食量比例在该2组间皆没有显著的差异,但Arg组却提高了乳蛋白氮产量和乳蛋白氮占摄入氮比例,而且总摄入氮也在数值上略有下降。这可能是由于Arg可通过促进乳腺组织发育[9]和乳腺腺泡发育及促进酪蛋白表达[25]来促进乳蛋白的合成。
但值得注意的是,本试验中各组的氮平衡值都相对较高。估计其原因可能是:1)乳蛋白的测定是采用FOSS仪器(MilkoScan FT120)通过红外线测定肽键即所测值为蛋白氮,而不是采用凯氏定氮法测定的粗蛋白质氮,乳中尿素氮也会有一定的氮流失;2)本试验用牛是4胎牛,泌乳80 d的产奶量只有21 kg/d左右,可能趋于体重的增加;3)也可能与饲养水平超过营养需求量而导致的奶牛增重和泌乳减产有关。张巧娥等[26]的研究结果表明,泌乳初期、中期、末期奶牛的氮平衡值分别为215.76、144.24、100.58 kg/d,也相对较高。具体的原因还有待于进一步的验证。
3.3 灌注精氨酸对中性洗涤纤维表观消化率的影响
另外,本试验中Arg组还提高了饲粮中性洗涤纤维的表观消化率。作为结构性碳水化合物,中性洗涤纤维在瘤胃中降解为挥发性脂肪酸(VFA)和酮酸,为瘤胃微生物和和宿主的生产提供能量[27]。其中,瘤胃中生成的VFA约有75%被瘤胃上皮细胞所吸收,其余的在下消化道中被吸收[28]。反刍动物还可以从盲肠吸收VFA。Warner等[29]和Davis[30]利用皱胃灌注纯木浆纤维素的方法测得绵羊的后肠道纤维素最大消化量是44.5 g/d,阉牛为143 g/d。Arg可以促进肠黏膜损伤的修复[31]。Kwasniewski等[32]研究发现Arg可以缓解过敏、内毒素等原因引起的肠道损失。此外,Arg作为NO的前体物质,通过提高NO的量清除部分氧自由基,减轻肠黏膜脂质过氧化伤害[33]。且Sukhotnik等[34]研究发现Arg能够影响小肠的吸收功能。综合以上研究分析,Arg组可能通过促进肠段的吸收功能从而促进其对中性洗涤纤维代谢产物的吸收,而最终提高了试验牛对中性洗涤纤维的消化性能;综合该结果和该组粗蛋白质表观消化率较高、乳和血清中尿素氮浓度较低等结果,可以看出Arg灌注可使机体的能量和氮供应都得到一定的提高[35]。
4 结 论
本试验的结果表明,颈静脉灌注Arg组降低了乳中尿素氮浓度,提高了粗蛋白质的消化率;同时还提高了乳蛋白氮量及其占摄入氮比例,表明了Arg可通过提高奶牛对氮的消化与利用来提高其乳蛋白的合成量。
[1] MARINI J C,VAN AMBURGH M E.Nitrogen metabolism and recycling in Holstein heifers[J].Journal of Animal Science,2003,81(2):545-552.
[2] HARMEYER J,MARTENS H.Aspects of urea metabolism in ruminants with reference to the goat[J].Journal of Dairy Science,1980,63(10):1707-1728.
[3] 徐红蕊,时建青,赵国琦.反刍动物体内尿素氮代谢研究进展[J].畜牧兽医杂志,2006,25(1):23-24,27.
[4] 侯玉洁,徐俊,赵国琦,等.精氨酸的生理学功能及其在畜禽生产中的应用[J].中国饲料,2013(5):32-37.
[5] KIM S W,WU G,et al.Dietary arginine supplementation enhances the growth of milk-fed young pigs[J].The Journal of Nutrition,2004,134(3):625-630.
[6] WAKABAYASHI Y,YAMADA E,YOSHIDA T,et al.Arginine becomes an essential amino acid after massive resection of rat small intestine[J].Journal of Biology and Chemistery,1994,269(51):32667-32671.
[7] KIM S W,WU G Y.Regulatory role for amino acids in mammary gland growth and milk synthesis[J].Amino Acids,2009,37(1):89-95.
[8] PAU M Y,MILNER J A.Effect of arginine deficiency on mammary gland development in the rat[J].The Journal of Nutrition,1982,112(10):1827-1833.
[9] ALKAREEM M A,ALBAYATI M A,WAELKHAMAS.The effect ofL-arginine and antagonist L-NAME on the mammary gland of pregnant mice[J/OL].Journal of Physics:Conference Series,2013,6:26-37.http://www.arpapress.com/Volumes/JPCS/Vol6/JPCS_6_04.pdf.
[10] WANG M Z,XU B L,WANG H G,et al.Effects of arginine concentration on theinvitroexpression of casein and mTOR pathway related genes in mammary epithelial cells from dairy cattle[J].PLoS One,2014,9(5):e95985.
[11] 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007.
[12] 张立涛,李艳玲,王金文,等.不同中性洗涤纤维水平饲粮对肉羊生长性能和营养成分表观消化率的影响[J].动物营养学报,2013,25(2):433-440.
[13] 徐红蕊.日粮蛋白水平对山羊内源尿素氮代谢转化影响研究[D].硕士学位论文.扬州:扬州大学,2006:5-6.
[14] BLOOMFIELD R A,MUHRER,M E,GARBER G B.Relation of composition of energy source to urea utilization by rumen microorganisms[J].Journal Animal Science,1958,17:1189.
[15] LAND H,VIRTANEN A I.Ammonium salts as nitrogen source in the synthesis of protein by the ruminant[J].Acta Chemica Scandinavica,1959,13:489-496.
[16] MALMOLF K.Amino acid in farm animal nutrition metabolism,partition and consequences of imbalance[J].Journal of Agriculture Research,1988,18(4):191-193.
[17] 李红宇,苗树君,程延彬,等.日粮蛋白质水平对北方寒区中国荷斯坦牛泌乳性能及体内尿素氮的影响[J].中国畜牧杂志,2010,46(7):36-39.
[18] 邹彩霞,唐庆凤,韦升菊,等.泌乳水牛乳蛋白、乳中尿素氮和尿中尿素氮含量的关系[J].中国畜牧杂志,2011,47(11):38-41.
[19] 樊艳华.日粮和瘤胃调控对绒山羊氮代谢、尿素氮循环及微生物蛋白合成的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2014.
[20] 麻名文.日粮精氨酸对生长肉兔生长性能、免疫、血液生化指标、激素水平及IGF-Ⅰ mRNA表达量的影响[D].硕士学位论文.济南:山东农业大学,2009.
[21] 贾青,康红,徐红蕊,等.结合15N示踪法研究日粮蛋白水平对山羊氮代谢的影响[J].饲料工业,2007,28(23):48-51.
[22] HEGER J,FRYDRYCH Z,FRONEK P.The effect of non-esential nitrogen on the utilization of dietary protein in the growing rat[J].Journal of Animal Physiology and Animal Nutrition,1987,57(1/2/3/4/5):130-139.
[23] VAN SOEST P J.Nutritional ecology of the ruminant.[M].2nd ed.Ithaca:Cornell University Press,1994.
[24] NRC.Nutritional requirements of poultry[S].9th ed.Washington,D.C.:National Academy Press,1994.
[25] 胡良宇,吴佳诚,王梦芝,等.饲粮添加精氨酸对娩后Wistar大鼠乳腺组织发育及酪蛋白合成的影响[J].动物营养学报,2015,27(4):1326-1332.
[26] 张巧娥,杨晓莉,史春林.不同蛋白质水平日粮对奶牛氮利用和氮平衡的影响[J].畜牧与兽医,2012,44(5):30-33.
[27] 郭冬生,彭小兰,夏维福.反刍动物碳水化合物和含氮化合物的消化代谢规律刍议[J].草食家畜,2007(2):36-38.
[28] BERGMAN E N.Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J].Physiological Reviews,1990,70(2):567-590.
[29] WARNER R L,MITCHELL G E,LITTLE C O.Post-ruminal digestion of cellulose in wethers and steers[J].Journal of Animal Science,1972,34:161-165.
[30] DAVIS R E.Postruminal fiber digestibility[J].Journal Animal Science,1965,24:826-829.
[31] 郑永波,吴承堂,黄祥成.L-精氨酸对严重腹腔感染大鼠肠屏障功能的影响[J].中华急诊医学杂志,2004,13(10):655-657.
[32] KWASNIEWSKI F H,LANDGRAF R G,JANCAR S.Small bowel injury associated to allergy is triggered by platelet-activating factor,mast cells,neutrophils and protected by nitric oxide[J].International Immunopharmacology,2008,8(2):371-378.
[33] 黄晶晶,刘玉兰,朱惠玲,等.L-精氨酸对脂多糖刺激的断奶仔猪肠道损伤的缓解作用[J].畜牧兽医学报,2007,38(12):1323-1328.
[34] SUKHOTNIK I,LERNER A,SABO E,et al.Effects of enteral arginine supplementation on the structural intestinal adaptation in a rat model of short bowel syndrome[J].Digestive Diseases and Sciences,2003,48(7):1346-1351.
[35] 刘海斌.蛋白水平对舍饲辽宁绒山羊生产性能及消化代谢的影响[D].硕士学位论文.长春:吉林农业大学,2008.
*Contributed equally
**Corresponding author, associate professor, E-mail: mengzhiwangyz@126.com
(责任编辑 王智航)
Arginine Infusion through Jugular Vein Affects Nutrient Digestion and Nitrogen Utilization of Lactating Cows
XU Qiaoyun DING Luoyang*WANG Mengzhi**ZHOU Gang ZHANG Xin JI Dejun
(CollegeofAnimalScienceandTechnology,YangzhouUniversity,Yangzhou225009,China)
This study was conducted to investigate the effects of arginine infusion through jugular vein on nutrient digestion and nitrogen utilization of lactating cows. Six healthy lactating cows at similar lactation stages with similar body weight, body condition, milk yield and parities were used in a 3×3 Latin square trail. Cows were divided into 3 groups (2 cows for each group), including casein pattern group (casein pattern amino acid mixture infusion through jugular vein, control group), arginine group (arginine infusion through jugular vein) and alanine group [alanine infusion (iso-nitrogen with arginine infusion) through jugular vein]. Each trial period was 22 d containing a 7-day infusion period and a 15-day interval period. The urea nitrogen concentration in serum, milk and urine, and the nutrient apparent digestibility were determined. The results showed as follows: no significant difference was found in serum and urine concentrations of ureaamong groups (P>0.05), and milk urea nitrogen concentration in arginine group was significantly lower than that in control group and alanine group (P<0.05). The apparent digestibility of dry matter, crude protein, neutral detergent fiber and organic matter in arginine group was significantly higher than that in alanine group (P<0.05). Milk protein nitrogen yield in arginine group was significantly higher than that in the other 2 groups (P<0.05); the arginine group also had the highest ratio of milk protein nitrogen to nitrogen intake. In conclusion, arginine infusion promotes the digestion and utilization of feed nitrogen of cows in mid-lactation, and results in the increases of the milk protein nitrogen yield and the ratio of milk protein nitrogen to total nitrogen intake.[ChineseJournalofAnimalNutrition, 2015, 27(12):3736-3743]
arginine infusion; nitrogen utilization; nutrient digestion; dairy cow
10.3969/j.issn.1006-267x.2015.12.012
2015-07-08
江苏省自然科学基金基础研究项目(BK20141270,BK20151312);江苏省优势学科(PAPD)
徐巧云(1992—),女,江苏扬州人,硕士研究生,动物营养与饲料科学专业。E-mail: 1172270605@qq.com
S823
A
1006-267X(2015)12-3736-08
*同等贡献作者
**通信作者:王梦芝,副教授,硕士生导师,E-mail: mengzhiwangyz@126.com

