饲粮粗蛋白质水平对断奶仔猪胃肠分泌及血清激素水平的影响
崔志杰 王利剑 吴 飞 蒋 谦 谢冬梅
何流琴1,2 黎育颖1,2 周 浩4 李铁军1*
(1.中国科学院亚热带农业生态过程重点实验室,中国科学院亚热带农业生态研究所,湖南省畜禽健康养殖工程技术研究中心,农业部中南动物营养与饲料科学观测试验站,长沙410125;2.中国科学院大学,北京100039;3.四川农业大学动物营养研究所,雅安625047;4.湖南帝亿生物科技有限公司,长沙410148)
饲粮粗蛋白质水平对断奶仔猪胃肠分泌及血清激素水平的影响
崔志杰1,2王利剑1,2吴 飞1,2蒋 谦1,2谢冬梅3
何流琴1,2黎育颖1,2周 浩4李铁军1*
(1.中国科学院亚热带农业生态过程重点实验室,中国科学院亚热带农业生态研究所,湖南省畜禽健康养殖工程技术研究中心,农业部中南动物营养与饲料科学观测试验站,长沙410125;2.中国科学院大学,北京100039;3.四川农业大学动物营养研究所,雅安625047;4.湖南帝亿生物科技有限公司,长沙410148)
本文旨在研究饲喂不同粗蛋白质(CP)水平饲粮对断奶仔猪胃肠内环境变化及血清激素水平的影响。选取28头35日龄平均体重为(10.0±1.0) kg的“杜×长×大”断奶阉公仔猪,随机分为4个组,每个组7个重复,每个重复1头猪。各组分别饲喂无氮、低(14% CP)、中(17% CP)、高(20% CP)4种不同CP水平饲粮。每头试验猪同时安装胃“T型”瘘管和颈动脉血管插管,术后恢复5 d。于正式试验第6~8天,每天餐前(0 min),自采食起30、60、120、180和300 min连续采取颈动脉血,并在第13~17天,胃食糜样每日每头猪采集1次(0和300 min在同1 d进行),采样时间以随机顺序分别自采食起0、30、60、120、180和300 min不同时间点对试验猪进行胃食糜样采集,每头猪每天采集1个时间点,收集胃糜,分别检测血清激素指标、胃糜上清液pH和胃蛋白酶活性。断奶仔猪为限制饲喂,每天450 g,自由饮水(收集胃糜期间除外),收集胃糜期间水料比为2∶1。结果表明:高、中、低3个CP水平饲粮对断奶仔猪平均日增重无显著影响(P>0.05),无氮饲粮组体重则呈负增长,且与其他组显著差异(P<0.05)。随着CP水平的降低,小肠长度减少(P>0.05),胃肠排空比率增加(P>0.05)。血清中胆囊收缩素、饥饿素、胃泌素、胃抑素、胃蛋白酶原Ⅰ和胃蛋白酶原Ⅱ水平不受CP水平和胃消化时间的显著影响(P>0.05)。本研究结果表明,在限制饲喂的情况下,与常规饲粮(粗蛋白质水平为20%)相比,断奶仔猪饲粮CP水平降低6%,不影响其胃pH、胃蛋白酶活性和血清激素水平。
粗蛋白质水平;断奶仔猪;胃酸;血清激素
近年来,随着国内养猪总量和规模化饲养不断上升,饲粮蛋白质原料供给和环境压力也日益突出[1]。一方面,以豆粕为代表的蛋白质饲料原料价格不断升高,国内豆粕长期依赖进口,使养殖成本上升。另一方面,动物粪尿排泄物中的含氮化合物和挥发性脂肪酸是主要的污染源,空气中的氨气、粪尿中的尿素能够导致土壤和地表水的酸化和富营养化以及空气产生刺激性气味,对猪场周围环境及一线工作人员的健康具有不良影响[2-3]。长期超过自然环境的消纳能力,可能造成环境不可恢复性损伤。降低饲粮粗蛋白质(CP)水平,并补充合成氨基酸,应用“理想蛋白质模式”配合饲粮,采用替代性蛋白质饲料来源等方法不断被研究,成为降低养殖生产成本、缓解环境压力的重要手段。大量研究表明,饲粮CP水平降低2%~5%,补充并平衡饲粮赖氨酸、蛋氨酸、苏氨酸和色氨酸含量对猪生产性能没有显著影响[4-6]。但是不同CP水平对猪胃肠激素水平及其胃内生理活动的动态变化鲜见报道。因此,本试验通过无氮、14%(低)、17%(中)、20%(高)4种不同CP水平饲粮对断奶仔猪生产性能、血清激素水平,胃肠排空及其胃内pH、胃蛋白酶(pepsin)活性的影响研究,以期更深入探讨饲粮CP水平对胃肠道影响机制以及猪胃肠健康的影响。
1 材料与方法
1.1 试验设计
选取35日龄的“杜×长×大”杂交断奶阉公仔猪28头(购自湖南新五丰永安分公司),随机分为4个组,每个组7头猪,每头猪为1个重复。NFP组饲喂无氮饲粮,LP、MP、HP组分别饲喂CP水平为14%、17%、20%的饲粮。以NRC(2012)[7]推荐的断奶仔猪营养需要量为标准,能量水平基本保持一致,配制试验饲粮。饲粮蛋白质来源一致,LP和MP组添加合成赖氨酸、蛋氨酸、苏氨酸和色氨酸,且与HP组该类氨基酸水平保持一致。试验饲粮组成及营养水平见表1;试验饲粮CP和氨基酸水平见表2。
1.2 试验材料与仪器
“T型”瘘管(购自中国农业大学肉牛中心)、酸度计(GK2401C,radio meter,丹麦),352型酶标仪(labsystems multiskan MS,芬兰)、AC8洗板机(thermo labsystems,芬兰)、TG16W微量高速离心机(国产)、GNP-9080型隔水式恒温培养箱(国产)。
1.3 饲养管理和样品采集
试验前仔猪在猪场统一注射疫苗2次。仔猪购进后先饲养于漏风地板、保温(23 ℃)、通风良好的猪舍内,单栏(0.4 m×1.2 m)饲喂。第1天饲喂温度为30~45 ℃葡萄糖电解多维水,以缓解运输过程中的应激,并禁食。自第2天起,每天饲喂断奶仔猪商品饲料,自由采食、饮水。饲喂5 d后,于第6天空腹(禁食12 h)称重[试验猪体重为(10.0±1.0) kg]后分组,按组别对每头试验猪同时实施颈动脉血血管插管和胃“T型”瘘管手术。
手术过程:手术前禁食1 d。术前15 min注射阿托品(0.05 mg/kg;浙江制药股份有限公司新昌制药厂),然后耳缘静脉注射舒泰50(7 mg/kg;法国维克)。手术详细过程参照Morris等[8]和黄瑞林等[9]的方法进行。手术后仔猪单栏饲喂于代谢笼(1.5 m×2.0 m)中,温度控制在23 ℃,禁食1 d,但饲喂葡萄糖温水。
每头猪术后饲喂相应组别的试验饲粮,恢复5 d,恢复和采血期间每天早、中、晚3次用肝素钠溶液疏通血管插管。然后进行正式试验,正式试验为限制饲喂,每天450 g,自由饮水(收集胃糜期间除外),收集胃糜期间,水料比为2∶1,混匀饲喂。
正式试验第6~8天,仔猪于每天采食前(0 min),自采食起30、60、120、180和300 min连续采集血样,每次采血10 mL,3 000 r/min离心10 min,取血清-80 ℃保存用于血清指标测定。于正式试验第13~17天,胃食糜样每日每头猪采集1次(除了0和300 min外),采样时间以随机顺序分别自采食起0、30、60、120、180和300 min采集胃食糜样。采集0和300 min胃食糜样在同1 d进行。每头猪每天采集1个时间点,共6个时间点(0、30、60、120、180和300 min),共采集5 d,每次采集胃食糜50 mL。采集后立即离心胃糜(3 000 r/min,5 min),取上清液分为2份,一份2 mL,测量pH,另一份2 mL,-80 ℃保存用于检测胃蛋白酶活性。
第19天正式试验结束后,随即进行屠宰,并在屠宰前30 min通过胃瘘管灌注阿拉伯胶-碳末混合剂(质量浓度5%活性炭末、质量浓度10%阿拉伯树胶,灌注剂量为10 mL/kg)[10]。
1.4 测定指标与分析方法
1.4.1 胃内pH的测定
取胃食糜上清液后立即用酸度计测定pH。
1.4.2 血清激素水平测定
用352型酶标仪测定血清中的胆囊收缩素(cholecystokinin,CCK)、饥饿素(ghrelin)、胃泌素(gastrin)、胃抑素(gastric inhibitory polypeptide,GIP)、胃蛋白酶原Ⅰ(pepsinogen Ⅰ,PGⅠ)和胃蛋白酶原Ⅱ(pepsinogen Ⅱ,PGⅡ)水平以及胃糜上清液胃蛋白酶活性,所有激素指标酶联免疫吸附测定(ELISA)试剂盒均购自北京鑫方程生物技术有限公司。具体分析方法严格按ELISA试剂盒所提供的操作说明进行。
1.4.3 仔猪生产性能和胃肠排空比率
计算平均日增重(ADG),开膛后量取小肠长度及碳末在肠道推进长度,计算胃肠排空比率。
胃肠排空比率(%)=(碳末长度/
小肠总长度)×100。

表1 试验饲粮组成及营养成分水平(饲喂基础)
1)预混料为每千克饲粮提供Premix provides the following per kg of diets:Cu 10 mg,Fe 100 mg,Na 0.30 mg,Zn 100 mg,Mn 10 mg,VD3386 IU,VA 3 086 IU,VE 15.4 IU,VK32.3 mg,VB23.9 mg,D-泛钙酸D-pantothenic acid 15.4 mg,烟酸 niacin 23 mg,胆碱 cholinc 77 mg,VB1215.4 μg。
2)营养水平为计算值。Nutrient levels are calculated values.
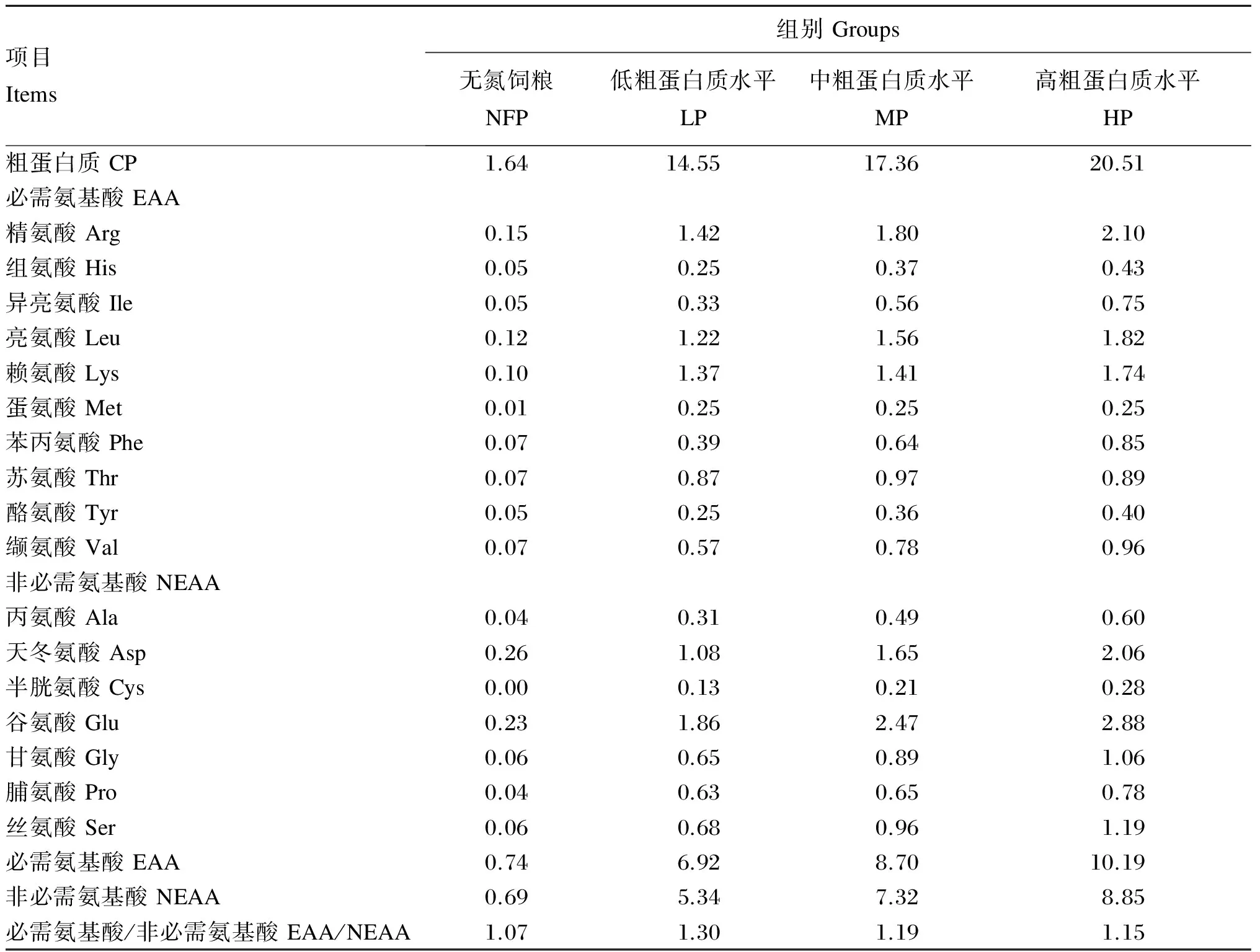
表2 试验饲粮CP和氨基酸水平
营养水平为实测值。Nutrient levels are measured values.
2 结 果
2.1 饲粮CP水平对断奶仔猪生产性能的影响
饲粮CP水平对断奶仔猪生产性能的影响见表3。各组初始体重相近,CP水平从0(无氮饲粮)变化到20%,在限制采食的情况下,LP、MP、HP组间末重和平均日增重无显著差异(P>0.05),均显著高于NFP组(P<0.05),且NFP组体重呈现负增长变化。
2.2 饲粮CP水平对断奶仔猪小肠长度和胃肠排空比率的影响
如表4所示,LP、MP、HP组间小肠长度无显著差异(P>0.05),均高于NFP组,且随着饲粮CP水平的降低,小肠长度减少。饲粮CP水平对断奶仔猪胃肠排空比率影响不显著(P>0.05),随着CP水平的降低胃肠排空比率加快。从结果来看,LP、MP、HP组间,LP组具有最快的胃肠排空速度,HP组的小肠长度最大。
2.3 饲粮CP水平对断奶仔猪血清胃肠激素指标的影响
饲粮CP水平与血清CCK水平在采食后300 min内的剂量关系如图1-A所示。时间和CP水平之间存在交互效应。采食后120 min内,CCK水平在各组间不存在显著差异(P>0.05)。LP组CCK水平比其他3组高,且不随时间改变。300 min时,LP组CCK水平(217.15 ng/L)显著高于MP组(164.38 ng/L)(P<0.05),其余时间点各组间无显著差异(P>0.05);与HP组(198.54 ng/L)比较,LP组CCK水平增加了9.60%,MP组CCK水平降低了17.17%。
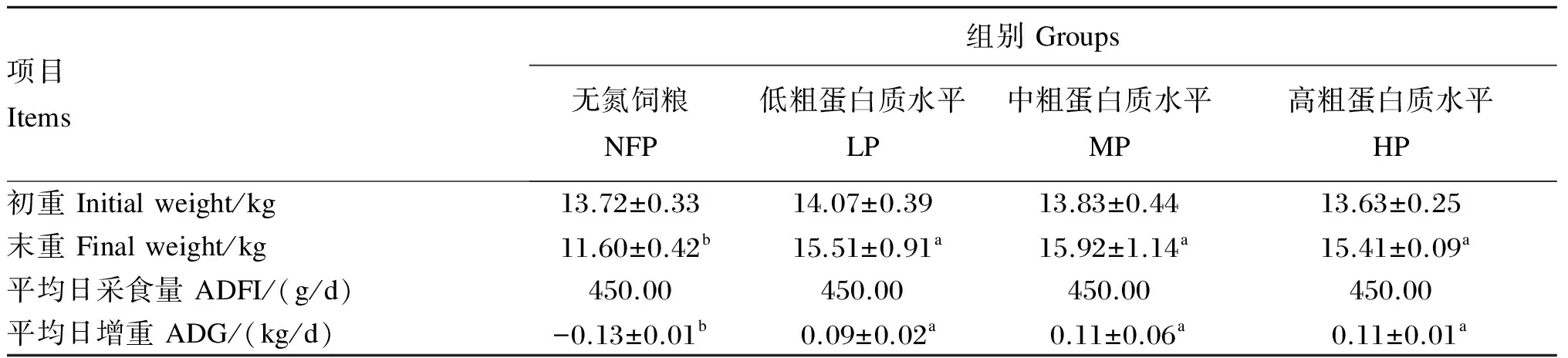
表3 饲粮CP水平对断奶仔猪生产性能的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference(P<0.05). The same as below.
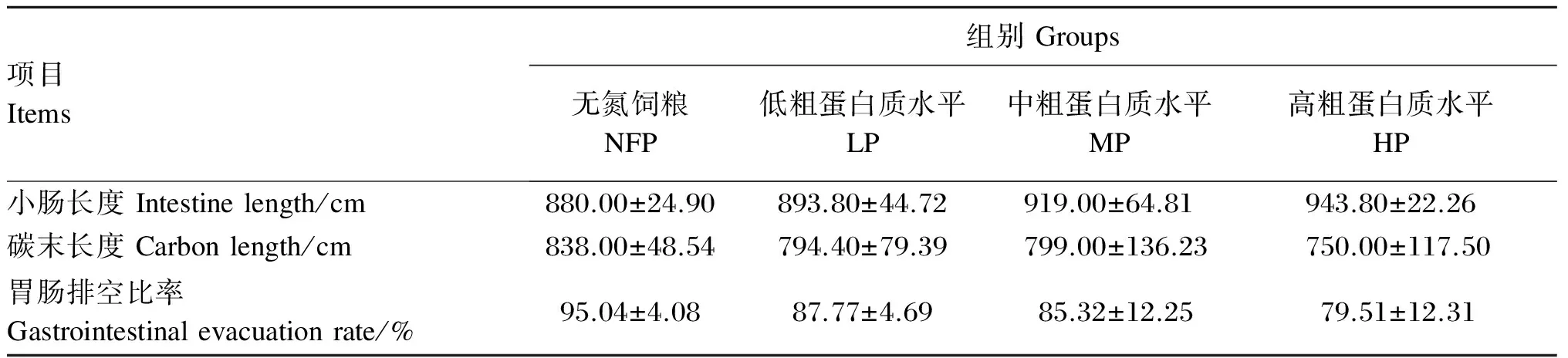
表4 饲粮CP水平对断奶仔猪小肠长度和胃肠排空比率的影响
饲粮CP水平与血清gastrin水平在采食后300 min内的剂量关系如图1-B所示。时间和CP水平之间存在交互效应。采食后300 min内,gastrin水平在各组间均无显著差异(P>0.05)。300 min时,LP、MP、HP组间,gastrin水平呈现随CP水平增加而增加的趋势,NFP组最高(138.05 ng/L)。
饲粮CP水平与血清ghrelin水平在采食后300 min内的剂量关系如图1-C所示。时间和CP水平之间存在交互效应。采食后300 min内,各组ghrelin水平无显著差异(P>0.05)。MP组,ghrelin水平先升高后降低,于120 min最高(3 579.97 ng/L)。LP组ghrelin水平先降低,后趋于平稳。NFP和HP组ghrelin水平随时间变化不大。
饲粮CP水平与血清GIP水平在采食后300 min内的剂量关系如图1-D所示。时间和处CP水平之间存在交互效应。不同CP水平在各个采食后300 min内均无显著差异(P>0.05)。与LP、MP、HP组相比,NFP组GIP水平始终处于较低水平。
2.4 饲粮CP水平对断奶仔猪血清PGⅡ和PGⅠ水平的影响
如图2所示,不同CP水平饲粮对血清各时间点PGⅡ水平无显著差异(P>0.05)。在0 min,HP组PGⅠ水平(34.00 μg/L)显著高于MP组(23.38 μg/L)(P<0.05),其余各组在各个时间点均无显著差异(P>0.05)。
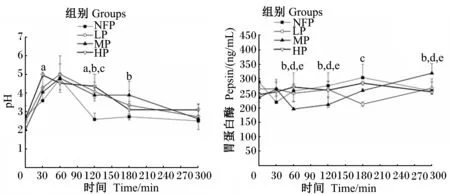
2.5 饲粮CP水平对断奶仔猪胃液pH和胃蛋白酶活性的影响
如图3所示,通过一般线性模型多因素分析,各组间胃蛋白酶活性和pH存在显著差异(P<0.05)。不同CP水平和时间对胃蛋白酶活性存在交互效应(P<0.001),对pH不存在交互效应(P>0.05)。采食后30 min时,HP组pH首先达到峰值(4.97),显著高于NFP组(3.59)(P<0.05),与LP(4.29)、MP组(4.05)无显著差异(P>0.05)。60 min时,NFP(4.77)、LP(5.02)和MP组pH(4.80)达到峰值。120 min时,NFP组pH(2.59)显著低于其他3组(P<0.05)。在0和300 min时,各组pH均无显著差异(P>0.05)。在60和120 min时,MP组胃液胃蛋白酶活性(195.23、210.29 ng/mL)显著低于其他3组(P<0.05)。而180 min时,NFP组胃蛋白酶活性(303.89 ng/mL)显著高于LP组(212.01 ng/mL)(P<0.05)。300 min时,MP组胃蛋白酶活性(319.14 ng/mL)显著高于其他3组(P<0.05),而其他各组间差异不显著(P>0.05)。
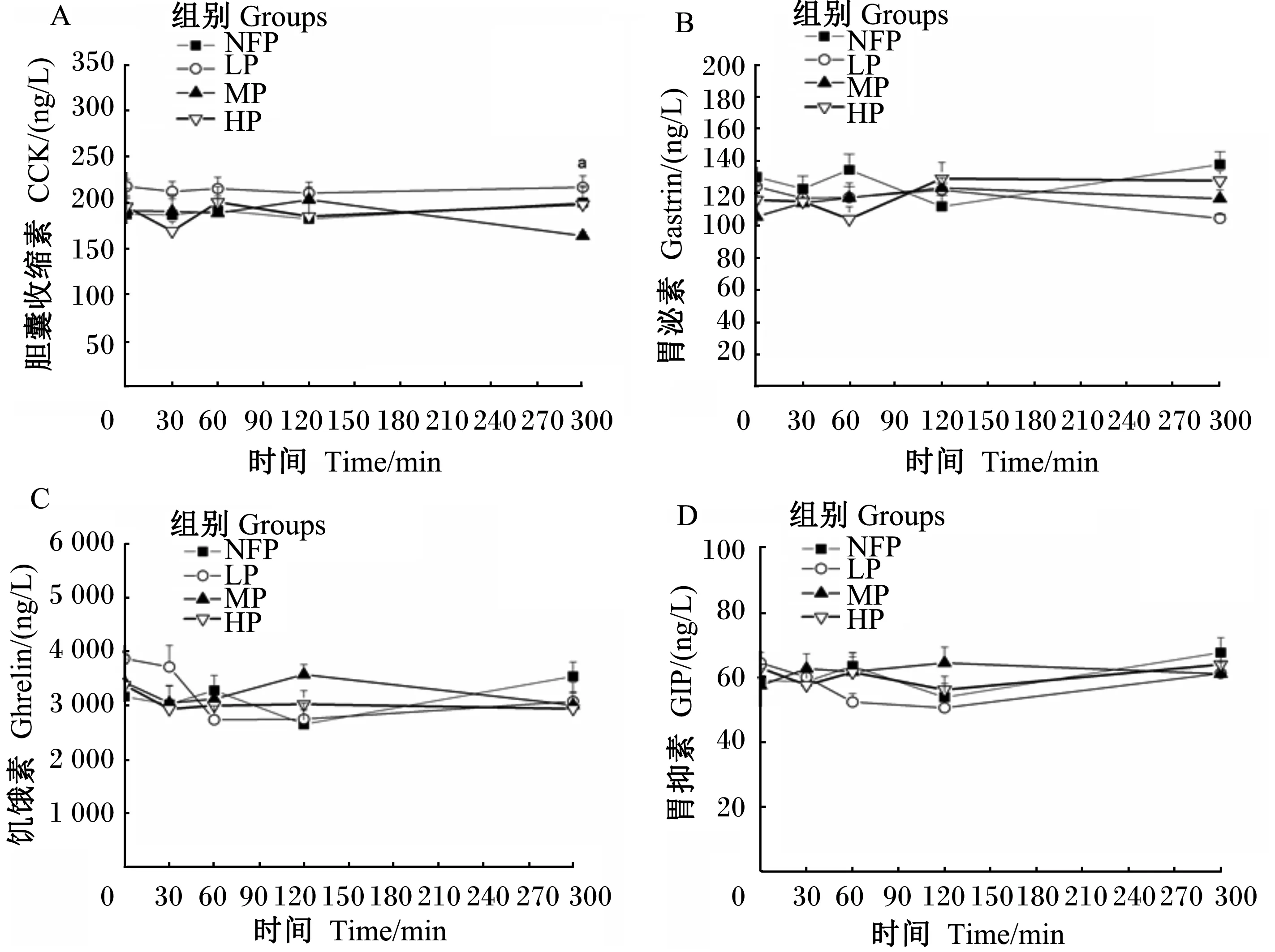
时间与CP水平之间,若不存在交互效应,其折线处于平行状态;若时间与CP水平存在交互效应,其折线表现为明显相交或者严重不平衡。下图同。
If there is no interaction effect between time and CP level, the broken line would be in the parallel condition; while if there is no interaction effect between time and CP level, the line would be in significant intersection or serious imbalance. The same as below.
图1 饲粮CP水平对断奶仔猪血清CCK、gastrin、ghrelin和GIP水平的影响
Fig.1 Effects of dietary CP level on serum levels of CCK, gastrin, ghrelin and GIP of weaning piglets (n=7)
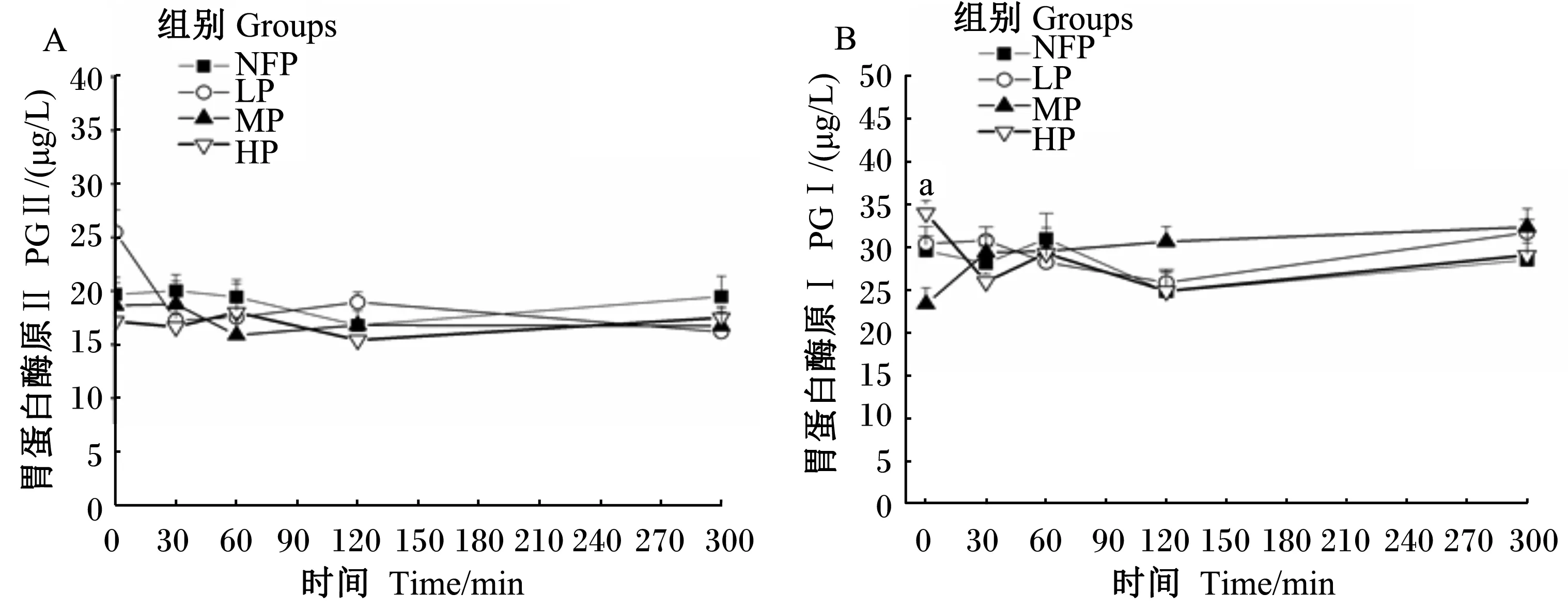
字母a代表MP和HP组差异显著(P<0.05)。
Letter a means significant difference between MP and HP groups (P<0.05).
图2 饲粮CP水平对断奶仔猪血清PGⅠ和PGⅡ水平的影响
Fig.2 Effects of dietary CP level on serum PG Ⅰ and PG Ⅱ levels of weaning piglets (n=7)
字母a代表NFP和HP组差异显著(P<0.05);b代表NFP和MP组差异显著(P<0.05);c代表NFP和LP组差异显著(P<0.05);d代表MP和HP组差异显著(P<0.05);e代表LP和MP组差异显著(P<0.05)。
Letter a means significant difference between NFP and HP groups (P<0.05); b means significant difference between NFP and MP groups (P<0.05); c means significant difference between NFP and LP groups (P<0.05); d means significant difference between MP and HP groups (P<0.05); while e means significant difference between LP and MP groups (P<0.05).
图3 饲粮CP水平对断奶仔猪胃内pH及胃蛋白酶活性的影响
Fig.3 Effects of dietary CP level on pH and pepsin activity of stomach of weaning piglets (n=7)
3 讨 论
3.1 饲粮CP水平对断奶仔猪生产性能的影响
降低饲粮CP水平3%~5%,添加赖氨酸、蛋氨酸、色氨酸和苏氨酸不影响猪的生产性能[1,4,11-12]。但也有研究表明,降低CP水平(23.1%降低到17.2%)补充该4种必需氨基酸可显著降低断奶2周内仔猪日增重[2]。在4种必需氨基酸(赖氨酸、含硫氨基酸、苏氨酸和色氨酸)水平相同的条件下,不同CP水平对生长猪采食量、日增重和料重比有一定影响,但各组间差异未达到显著水平[13]。我们之前的研究结果表明,低CP饲粮(14% CP)补充赖氨酸、蛋氨酸、色氨酸、苏氨酸4种氨基酸,14%和17%CP水平饲粮使仔猪日增重和采食量低于20%CP水平饲粮。本试验中术后断奶仔猪在饲喂2周后,与20%CP水平相比,仔猪饲喂17%CP水平饲粮生产性能没有显著变化,表明在应激限饲情况下,17%CP饲粮不影响断奶仔猪日增重。生产性能试验结果的不同可能与饲粮仔猪选取、饲养环境、人工管理、饲粮组成、断奶时间、氨基酸补充水平等因素有关。
3.2 饲粮CP水平对断奶仔猪小肠发育和胃肠排空比率的影响
4种饲粮组断奶仔猪的小肠长度无显著差异,但呈现明显的剂量效应关系。从低(14%)CP到高(20%)CP饲粮,CP水平每增加3%,小肠长度增加3%左右。该结果表明,高CP饲粮对小肠发育有积极影响,而补充必需氨基酸在一定程度上无法弥补。但育肥猪饲喂高和低CP水平对小肠长度影响不大(240日龄,22%和11%CP水平相比)[14],这可能是由于蛋白质对仔猪肠道发育的影响较育肥猪大。本研究结果显示低CP水平饲粮具有较高的胃肠排空速率,这可能是由于在胃蛋白酶活性相同情况下,CP水平降低,蛋白质降解为小肽和氨基酸速率加快。无氮饲粮溶解于水中更接近于半流质状态,对促进胃肠排空也有重要影响。
3.3 饲粮CP水平对断奶仔猪血清胃肠激素水平的影响
蛋白质通过影响味觉调控激素比碳水化合物更能够刺激饱腹感,进而影响食欲[15-16]。本试验猪采食量较正常仔猪较低,一般认为手术后2周内,与调节食欲有关的胃肠激素发生急剧变化,降低饥饿感[17]。研究发现,胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)、胰多肽(pancreatic polypeptide,PPY)和胰高血糖素在人体中随着CP水平的变化存在剂量效应关系,随着CP水平的增加而增加,因此高CP水平饲粮在一定程度上能够增加人饱腹感[18]。但也有研究表明,许多胃肠激素在高、低CP水平间没有差异[19-20]。这些试验都以人体为试验对象,未发现对仔猪胃肠激素采食不同CP水平饲粮后进行的系统研究。本试验通过安装颈动脉血管插管,实现了仔猪采食不同CP水平后味觉调控类激素受CP水平和采食时间变化的影响研究。血清胃肠激素水平受CP水平影响较小,且受采食时间变化较小。结果表明,降低CP水平,从与味觉相关激素水平的角度来看,不影响机体正常生理活动。
3.4 饲粮CP水平对断奶仔猪胃内pH和胃蛋白酶活性的影响
乳猪采食母乳时,胃内pH不会有较大变化,当仔猪采食固体饲料后,胃内pH会大幅度上升,并将分泌大量盐酸来促进胃内pH下降。仔猪采食前胃糜胃内酸度较低,采食后,由于高碱值饲粮的稀释缓冲使胃内pH上升,且随着时间变化[21]。本试验结果表明,断奶仔猪采食后,胃内pH在30~60 min达到峰值,随后逐渐降低,受CP水平影响,仔猪采食高CP水平饲粮后pH峰值出现较早,采食中、低CP水平饲粮升高较慢,且无氮饲粮可能由于胃排空过快而造成胃酸较快恢复到空腹状态水平。在胃肠排空速率基本一致的前提下,与20%CP水平饲粮相比,饲喂17%CP水平饲粮在60~180 min范围内,胃中胃蛋白酶活性较低,表明饲粮CP水平对胃蛋白酶活性具有一定的刺激作用,以满足蛋白质的降解。有研究表明断奶仔猪胃中食糜酸度可能与胃蛋白酶分泌有重要联系,饲料中添加消化酶促进蛋白质降解对胃蛋白酶分泌影响不大[22-23]。本试验中,胃中胃蛋白酶活性随时间变化不大,但由于饲粮和水入胃的稀释作用,胃内胃蛋白酶活性随着采食的进行有先上升后下降的趋势,采食后120 min,随着pH降低,胃蛋白酶活性有略微上升的趋势,pH降低有助于胃蛋白酶的激活。断奶仔猪胃蛋白酶分泌与胃内环境pH的详细关系有待进一步研究。
4 结 论
低CP水平饲粮可加快胃肠排空速率,小肠长度随着CP水平降低表现下降趋势。血清中CCK、ghrelin、gastrin、PIG、PGⅠ和PGⅡ水平不受CP水平和胃消化时间的影响。胃内pH受采食影响呈现先升高后降低的规律性变化与胃肠排空速率相关,胃蛋白酶活性受饲粮CP水平及采食影响较小。在限制饲喂的情况下,且保持水料比一定,与常规饲粮粗蛋白质水平(20%)相比,断奶仔猪饲粮CP水平降低6%(添加赖氨酸、蛋氨酸、色氨酸、苏氨酸4种必需氨基酸),不影响其胃pH、胃蛋白酶活性和血清激素水平。
[1] O’CONNELL J M,CALLAN J J,O'DOHERTY J V.The effect of dietary crude protein level,cereal type and exogenous enzyme supplementation on nutrient digestibility,nitrogen excretion,faecal volatile fatty acid concentration and ammonia emissions from pigs[J].Animal Feed Science and Technology,2006,127(1/2):73-88.
[2] HAYES E T,LEEK A B G,CURRAN T P,et al.The influence of diet crude protein level on odour and ammonia emissions from finishing pig houses[J].Bioresource Technology,2004,91(3):309-315.
[3] STANOGIAS G,PEARCE G R.The digestion of fibre by pigs.1.The effects of amount and type of fibre on apparent digestibility,nitrogen balance and rate of passage[J].British Journal of Nutrition,1985,53(3):513-530.
[4] BRUDEVOLD A B,SOUTHERN L L.Low-protein,crystalline amino acid-supplemented,sorghum-soybean meal diets for the 10- to 20-kilogram pig[J].Journal of Animal Science,1994,72(3):638-647.
[5] PORTEJOIE S,DOURMAD J Y,MARTINEZ J,et al.Effect of lowering dietary crude protein on nitrogen excretion,manure composition and ammonia emission from fattening pigs[J].Livestock Production Science,2004,91(1/2):45-55.
[6] LORDELO M M,GASPAR A M,LE BELLEGO L,et al.Isoleucine and valine supplementation of a low-protein corn-wheat-soybean meal-based diet for piglets:growth performance and nitrogen balance[J].Journal of Animal Science,2008,86(11):2936-2941.
[7] NRC.Nutrient requirements of swine[S].Washington,D.C.:National Academies Press,2012.
[8] MORRIS D,LADIZINSKY D,ABOULJOUD M.Successful internalization of a chronic biliary cutaneous fistula after liver transplantation:deepithelializing the fistula tract[J].Journal of Gastrointestinal Surgery,2007,11(4):538-541.
[9] 黄瑞林,印遇龙,李铁军,等.用于营养物质代谢的动静脉插管技术——Ⅰ.插管及血流量计安装手术[J].中国兽医杂志,2003,39(6):19-20.
[10] 马珍珍,曹飞,郝少君.健脾消胀片对阿托品致肠蠕动降低模型小鼠肠蠕动的影响[J].中医学报,2012,27(4):446-447.
[11] 邓敦,李铁军,孔祥峰,等.日粮蛋白水平对生长猪生产性能和氮平衡的影响[J].广西农业生物科学,2007,26(2):137-143.
[12] 刘志强,谭碧娥,汤文杰,等.日粮不同蛋白质水平对三元肥育猪生产性能和胴体品质的影响[J].动物营养学报,2008,20(6):611-616.
[13] 梁福广.生长猪低蛋白日粮可消化赖、蛋+胱、苏、色氨酸平衡模式的研究[D].博士学位论文.北京:中国农业大学,2005.
[14] 刘宏伟,王康宁.日粮碳水化合物/蛋白质水平对240日龄不同品种猪肌内脂肪含量和胃肠道重量、长度及消化酶活性的影响[J].动物营养学报,2009,21(4):447-453.
[15] BLOM W A M,LLUCH A,STAFLEU A,et al.Effect of a high-protein breakfast on the postprandial ghrelin response[J].American Journal of Clinical Nutrition,2006,83(2):211-220.
[16] BERTENSHAW E J,LLUCH A,YEOMANS M R.Dose-dependent effects of beverage protein content upon short-term intake[J].Appetite,2009,52(3):580-587.
[17] JACOBSEN S H,OLESEN S C,DIRKSEN C,et al.Changes in gastrointestinal hormone responses,insulin sensitivity,and beta-cell function within 2 weeks after gastric bypass in non-diabetic subjects[J].Obesity Surgery,2012,22(7):1084-1096.
[18] BELZA A,RITZ C,SORENSEN M Q,et al.Contribution of gastroenteropancreatic appetite hormones to protein-induced satiety[J].American Journal of Clinical Nutrition,2013,97(5):980-989.
[19] VELDHORST M A B,NIEUWENHUIZEN A G,HOCHSTENBACH-WAELEN A,et al.Comparison of the effects of a high- and normal-casein breakfast on satiety,‘satiety’ hormones,plasma amino acids and subsequent energy intake[J].British Journal of Nutrition,2009,101(2):295-303.
[20] RATLIFF J,LEITE J O,DE OGBURN R,et al.Consuming eggs for breakfast influences plasma glucose and ghrelin,while reducing energy intake during the next 24 hours in adult men[J].Nutrition Research,2010,30(2):96-103.
[21] LAWRENCE T L J.Some effects of including differently processed barley in the diet of the growing pig:2.Invivogastric pH changes[J].Animal Production,1970,12(1):151-163.
[22] 杨琳,张宏福,李长忠,等.不同断奶日龄仔猪消化道酸度和胃蛋白酶活性的动态变化[J].畜牧兽医学报,2001,32(4):299-305.
[23] FAN C L,HAN X Y,XU Z R,et al.Effects of β-glucanase and xylanase supplementation on gastrointestinal digestive enzyme activities of weaned piglets fed a barley-based diet[J].Journal of Animal Physiology and Animal Nutrition,2009,93(2):271-276.
*Corresponding author, professor, E-mail: tjli@isa.ac.cn
(责任编辑 陈 燕)
Effects of Dietary Crude Protein Level on Gastrointestinal Secretion and Serum Hormone levels of Weaning Piglets
CUI Zhijie1,2WANG Lijian1,2WU Fei1,2JIANG Qian1,2XIE Dongmei3HE Liuqin1,2LI Yuying1,2ZHOU Hao4LI Tiejun1*
(1.KeyLaboratoryofAgro-EcologicalProcessesinSubtropicalRegion,InstituteofSubtropicalAgriculture,ChineseAcademyofSciences,HunanProvincialEngineeringResearchCenterofHealthyLivestock,ScientifcObservingandExperimentalStationofAnimalNutritionandFeedScienceinSouth-Central,MinistryofAgriculture,Changsha410125,China; 2.UniversityofChineseAcademyofSciences,Bejing100039,China; 3.InstituteofAnimalNutrition,SichuanAgriculturalUniversity,Ya’an625047,China; 4.HunanDiyiBiotechnologyCo.,Ltd.,Changsha410148,China)
The study was conducted to evaluate the effects of different dietary crude protein levels on gastrointestinal internal environment change, gastrointestinal hormone levels of weaning piglets. Twenty-eight weaning piglets (Duroc×Large White×Landrace) with an initial body weight of (10.0±1.0) kg were randomly divided into four groups. Four diets containing 0 (NFP), 14% (LP), 17% (MP), and 20% (HP) crude protein were fed, 7 replicates per treatment, 1 pig per replicate. Each piglet was placemented gastric fistula and carotid artery through surgical operation. And each pig was taken care for 5 d after surgery. Collecting arterial serum according to the time point before the meal (0 min), and 30, 60, 120, 180, and 300 min after fed from 6th to 8th days. And gastric chime was collected according to the same time point with serum from 13th to 17th days. Every pig was collected 1 time point every day except 0 and 300 min. Serum hormone levels, liquid supernatant of gastric chime, and pepsin activity were determined. All piglets were limited to feed, 450 g per day and were free to water except the time when collecting gastric chime. And the ratio of feed to water is 2 to 1 when collecting gastric chime. The results showed that the average daily gain (ADG) had no significant difference among HP, MP, and LP groups (P>0.05), piglets fed with NFP diet had a negative growth in ADG, and had significant difference with the other groups (P<0.05) in the case of restricted feeding. With the decrease of crude protein level, the length of small intestine was declined (P>0.05) and the gastrointestinal evacuation rate was accelerated (P>0.05). Serum levels of cholecystokinin (CCK), ghrelin, gastrin, gastric inhibitory polypeptide (GIP), pepsinogen Ⅰ (PG Ⅰ), and pepsinogen Ⅱ (PG Ⅱ) were not or little influenced by crude protein level and intake time (P>0.05). These results indicate that the 6% decrease of dietary crude protein level do not influence the pH, pepsin activity and serum hormone levels of weaning piglets compared with common diet (crude protein is 20%) in the case of restricted feeding.[ChineseJournalofAnimalNutrition, 2015, 27(12):3689-3698]
crude protein level; weaning piglets; gastric acid; serum hormones
10.3969/j.issn.1006-267x.2015.12.007
2015-06-19
国家973课题(2013CB127301);国家科技支撑计划课题(2013BAD21B04);农业科技成果转化资金项目(2014GB2D200216);长沙绿叶生物科技有限公司院士专家工作站资金
崔志杰(1989—),男,河南商丘人,硕士研究生,研究方向为动物营养与饲料科学。E-mail: czhijie2013@163.com
*通信作者:李铁军,研究员,硕士生导师,E-mail: tjli@isa.ac.cn
S828
A
1006-267X(2015)12-3689-10

