二硝基氯苯抑制硫氧还蛋白还原酶活性诱导的细胞氧化损伤模型的建立
弓 剑 闫素梅 史彬林 郭晓宇 金 鹿 郭咏梅
(1.内蒙古农业大学动物科学学院,呼和浩特010018;2.内蒙古师范大学生命科学与技术学院,呼和浩特010022)
二硝基氯苯抑制硫氧还蛋白还原酶活性诱导的细胞氧化损伤模型的建立
弓 剑1,2闫素梅1*史彬林1郭晓宇1金 鹿1郭咏梅1
(1.内蒙古农业大学动物科学学院,呼和浩特010018;2.内蒙古师范大学生命科学与技术学院,呼和浩特010022)
本试验旨在利用硫氧还蛋白还原酶(thioredoxin reductase,TrxR)的抑制剂二硝基氯苯(dinitrochlorobenzene,DNCB)作为刺激源,以细胞增殖率、TrxR活性和抗氧化指标作为判断依据,建立奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMEC)的氧化损伤模型。试验分2部分进行。试验1采用单因子完全随机试验设计,将第3代的BMEC随机分为35组,每组8个重复。培养液中分别添加0(对照)、10、30、50、100、300和500 μmol/L的DNCB,使之分别作用细胞2、4、6、8和12 h,通过检测细胞增殖率,初步确定适宜的作用时间;试验2在试验1得出适宜DNCB作用时间的基础上,采用单因子随机试验设计,将BMEC随机分为7组,每组6个重复,培养液中分别添加0(对照)、10、30、50、100、300和500 μmol/L的DNCB,通过检测细胞TrxR活性以及抗氧化指标,筛选出适宜的DNCB处理浓度。结果表明,与对照组相比,300 μmol/L DNCB作用2 h对BMEC产生了明显的氧化应激,细胞增殖率降到73.31%,TrxR活性降至56.23%,谷胱甘肽过氧化物酶、超氧化物歧化酶和过氧化氢酶活性也显著降低(P<0.05),丙二醛含量显著提高(P<0.05)。结果提示,300 μmol/L的DNCB作用浓度和2 h的作用时间可作为建立细胞氧化损伤模型的适宜剂量与作用时间。
奶牛乳腺上皮细胞;二硝基氯苯;氧化损伤模型
奶牛由于泌乳期间乳腺有氧代谢活动加强以及大量乳的合成和分泌,往往会产生大量活性氧(reactive oxygen species,ROS),导致乳腺产生氧化应激,对于高产奶牛表现尤为明显[1]。奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMEC)作为乳腺组织的主要构成细胞,极易受到ROS的攻击而产生氧化应激,导致细胞抗氧化功能降低,进而引起细胞增殖降低,乳产量下降[2]。因此,BMEC是建立奶牛乳腺氧化应激模型的理想细胞,而建立一个可靠的BMEC氧化应激模型,对于揭示其氧化应激机制,研究有效的抗氧化措施,提高其抗氧化功能,进而提高奶牛的产奶性能具有重要的意义。
目前多以过氧化氢(hydrogen peroxide,H2O2)作为应激源构建细胞的氧化应激模型。二硝基氯苯(dinitrochlorobenzene,DNCB)是一种亲电子化合物,对硫氧还蛋白还原酶(thioredoxin reductase,TrxR)活性具有很强的抑制作用,主要通过使TrxR活性中心的硒代半胱氨酸残基及其邻近的半胱氨酸残基烷基化,进而导致TrxR活性降低或灭活[3-4]。在癌症防治领域,主要是将DNCB作为一种药物或氧化剂研究其对癌细胞的杀伤效果[5]。关于以DNCB作为应激源建立细胞氧化损伤模型的研究甚少。通过DNCB抑制TrxR活性建立细胞氧化损伤模型的关键取决于DNCB的作用时间和浓度。Eriksson等[6]用20 μmol/L的DNCB作用人A549肺癌细胞24 h后发现,TrxR活性显著降低。Ade等[7]以12.5~50.0 μmol/L的DNCB作用人树突细胞24 h后发现,12.5 μmol/L的DNCB不影响细胞增殖率,25.0 μmol/L的DNCB导致细胞增殖率降到75%,而当浓度提高到50.0 μmol/L时,细胞增殖率降低到47%。可见,目前以DNCB诱导细胞氧化应激的研究多集中于医学领域,而针对BMEC在该领域的研究未见有资料报道。因此,本试验通过探讨DNCB浓度和作用时间对BMEC增殖率、TrxR活性以及其他抗氧化指标的影响,建立DNCB通过抑制TrxR活性诱导BMEC产生氧化应激的细胞损伤模型,确定其适宜的作用时间和浓度,为进一步深入探讨BMEC的氧化应激机制和抗氧化措施奠定基础。
1 材料与方法
1.1 试验材料
BMEC(胶原酶消化法培养制备);DMEM/F12培养基、胎牛血清(FBS)、胶原酶Ⅱ、胰蛋白酶/乙二胺四乙酸(EDTA)、胰岛素转铁蛋白溶液和双抗(美国Gibco公司);DNCB、氢化可的松、两性霉素B和催乳素和表皮生长因子(美国Sigma公司);3-(4,5-二甲基-2-噻唑)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-tetrazoliumbromide,MTT]和二甲基亚砜(dimethyl sulfoxide,DMSO)(美国Amresco公司);TrxR、谷胱甘肽过氧化物酶(glutathion peroxidase,GPX)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物工程研究所);蛋白质浓度测定试剂盒(北京碧云天公司)。
1.2 试剂配制
不同浓度DNCB贮备液的配制:准确称取2.025 6 g DNCB溶于10 mL DMSO溶液中,配制成1 000 mmol/L的DNCB原液,按试验要求配制成不同浓度的DNCB储备液(0、10、30、50、100、300、500 mmol/L)。
不同DNCB浓度细胞培养液的配制:取20 μL不同梯度浓度的DNCB贮备液加入到19.98 mL的DMEM/F12基础培养液中,使培养液中DNCB的浓度分别为0、10、30、50、100、300和500 μmol/L。将上述培养液经0.22 μm的过滤器过滤,现用现配。
1.3 奶牛乳腺上皮细胞的培养
原代培养:于屠宰场挑选健康奶牛的乳腺组织,置于冰上,迅速带回实验室,用消毒手术剪剪去乳腺的外层组织,取深层组织块放入含3×双抗的磷酸盐缓冲液(PBS)的储液瓶中,转入超净工作台依次经3×双抗的PBS清洗3遍、75%乙醇溶液清洗30 s、1×双抗的PBS清洗3遍。将清洗后的乳腺组织块转入培养皿中,用手术剪剪去表面组织,在深层腺泡多的地方剪取约米粒大小的乳腺组织块,放入5 mL离心管中,将离心管中的乳腺组织块进一步充分剪碎后加入0.5%的胶原酶Ⅱ,于CO2恒温培养箱中消化1 h,期间每隔20 min摇晃混合1次。消化液经80目细胞滤网过滤,滤液在400×g条件下离心5 min,将离心所得沉淀用PBS悬浮,相同条件下继续离心3 min,离心所得沉淀经PBS重新悬浮,细胞计数仪计数后接种于25 cm2培养瓶中,置于CO2恒温培养箱中于37 ℃、5% CO2条件下培养,期间每隔24 h更换1次培养基。
传代培养:待原代培养细胞的贴壁率达80%~90%时,弃去培养基,加入1 mL 0.05%的胰蛋白酶/EDTA,于CO2恒温培养箱中消化30 s,立即加入1 mL终止培养基终止消化,弃去培养基,用适量PBS清洗后再加入1 mL胰蛋白酶/EDTA,于CO2恒温培养箱中消化10 min,立即加入1 mL终止培养基,反复吹打后全部转入离心管,在400×g条件下离心5 min,所得细胞沉淀加入DMEM/F12培养基,用吸管反复吹打成单细胞悬液,细胞计数仪计数后再次接种于25 cm2培养瓶中,置于CO2恒温培养箱中于37 ℃、5% CO2条件下培养,期间每隔24 h更换1次培养基。待细胞贴壁率达80%~90%时,重复以上操作,如此传代培养2次得到的乳腺上皮细胞,-80 ℃冻存备用。
接种培养:将分离纯化后的第3代BMEC分别以1×104和3×105个/mL的细胞浓度接种于96孔培养板(每孔200 μL)和60 mm培养皿(每皿3.5 mL)中,置于5% CO2培养箱中于37 ℃条件下培养,当细胞贴壁率达到80%~90%时进行后续试验。
1.4 试验设计
本试验分2部分进行。试验1采用单因子完全随机试验设计,将上述接种于96孔培养板中的细胞随机分为35组,每组8个重复。培养液中分别添加0、10、30、50、100、300和500 μmol/L的DNCB,使之分别作用2、4、6、8和12 h,通过检测细胞增殖率,初步确定适宜的作用时间。其中,0 μmol/L剂量组为对照组。
试验2在试验1得出适宜DNCB作用时间的基础上,采用单因子随机试验设计,将上述接种于60 mm培养皿中的细胞随机分为7组,每组6个重复,培养液中分别添加0、10、30、50、100、300和500 μmol/L的DNCB,通过检测细胞中硒蛋白TrxR活性以及抗氧化指标(GPX、SOD、CAT活性和MDA含量),筛选出适宜的DNCB处理浓度。其中,0 μmol/L剂量组为对照组。
1.5 样品采集与处理
细胞培养液:将60 mm培养皿中的细胞培养液以处理和重复为单位分别收集于1.5 mL Eppendorf离心管中,于4 ℃、10 000×g条件下离心5 min,收集上清液用于SOD和CAT活性检测。
细胞样品:将收集细胞培养液后的60 mm培养皿置于冰上,用细胞刮板将细胞刮起,加入1 mL动物细胞裂解液裂解30 min后于4 ℃、10 000×g条件下离心10 min,收集上清液用于细胞中TrxR和GPX活性以及MDA含量的测定。
1.6 测定项目及方法
1.6.1 细胞增殖率
采用MTT法检测[8]。将在96孔板中的BMEC按照试验1的设计培养相应时间后,每孔加入浓度为0.5 mg/mL的MTT溶液20 μL继续培养4 h,弃去培养基,每孔加入100 μL DMSO,使用全自动酶标仪振荡10 min后在波长490 nm处读取溶液的吸光度值(OD)。各组的细胞增殖率用相对于对照组OD的百分比表示。对照组的细胞增殖率表示为100%。
细胞增殖率(%)=100×OD试验组/OD对照组。
1.6.2 抗氧化指标
TrxR和GPX活性采用二硫代二硝基苯甲酸还原法测定,SOD活性采用黄嘌呤氧化法测定,CAT活性采用钼酸铵显色法测定,MDA含量采用硫代巴比妥酸法测定。具体测定过程按照试剂盒说明书进行。
1.7 数据统计分析
试验数据用Excel 2007进行初步整理,采用SAS 9.0统计软件中的ANOVA程序进行单因素方差分析,应用Duncan氏法进行多重比较;P<0.05表示差异显著,0.05≤P<0.10表示差异趋于显著。
2 结 果
2.1 DNCB浓度与作用时间对细胞增殖的影响
由表1可知,DNCB的添加浓度显著影响了BMEC的增殖(P<0.05),在所有作用时间下,随着DNCB浓度的提高,细胞增殖率呈不同程度的降低趋势。当作用时间为2 h、DNCB浓度提高到300 μmol/L时,细胞增值率显著降低(P<0.05),较对照组降低了26.69%;进一步提高DNCB浓度到500 μmol/L时,细胞增值率较对照组也显著降低(P<0.05),但与300 μmol/L相比无显著差异(P>0.05)。与对照组相比,当作用时间为4 h、DNCB浓度提高到50~500 μmol/L时,细胞增殖率显著降低(P<0.05),分别较对照组降低了18.50%、33.15%、61.92%和63.98%,其中100、300和500 μmol/L剂量组显著低于50 μmol/L剂量组(P<0.05),300和500 μmol/L剂量组显著低于100 μmol/L剂量组(P<0.05)。当作用时间延长至6、8、12 h时,30 μmol/L剂量组的细胞增殖率显著低于对照组(P<0.05),较对照组分别降低了23.53%、48.56%和71.93%,进一步提高DNCB的浓度,细胞增殖率显著降低(P<0.05),当DNCB浓度达到50 μmol/L及以上时,细胞增殖率均降到55%以下。
DNCB作用时间也显著影响了BMEC的增殖(P<0.05),在10~500 μmol/L浓度范围内,随着DNCB作用时间的增加,细胞相对增殖率呈不同程度的降低趋势。当DNCB添加浓度为10 μmol/L时,2~8 h的作用时间对细胞增殖率无显著影响(P>0.05),当作用时间增加到12 h时,细胞增殖率显著降低(P<0.05),仅为31.79%。当DNCB添加浓度为30 μmol/L时,2~4 h的作用时间对细胞增殖率无显著影响(P>0.05),当作用时间增加到6~12 h时,随时间增加,各时间点细胞增殖率依次显著降低(P<0.05),以作用12 h时的细胞增殖率最低。当DNCB浓度提高到50~500 μmol/L时,作用时间为4 h即可导致细胞增殖率显著降低(P<0.05),且当作用时间增加到6~12 h时,随时间增加,各时间点细胞增殖率依次显著降低(P<0.05)。
其中,细胞增殖率在70%~80%范围内,DNCB的浓度与作用时间分别为300 μmol/L作用2 h、500 μmol/L作用2 h和30 μmol/L作用6 h,对应的细胞增殖率分别为73.31%、72.88%和76.47%。
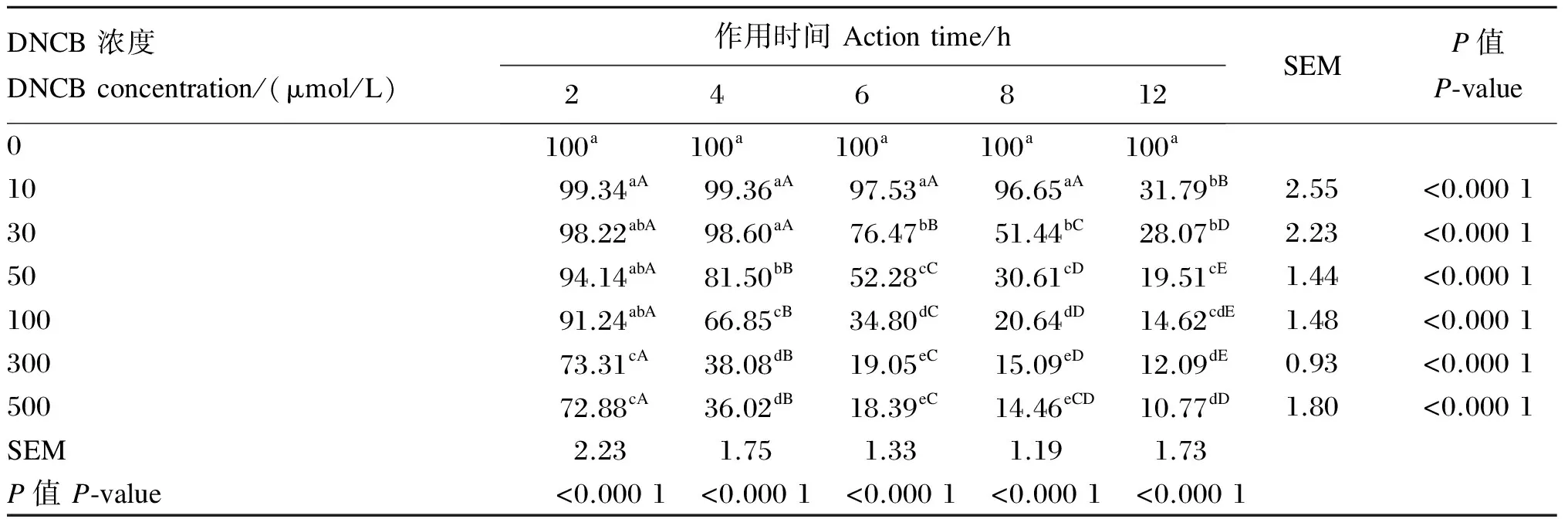
表1 DNCB浓度和作用时间对BMEC增殖率的影响
同列数据肩标不同小写字母表示差异显著(P<0.05),同行数据肩标不同大写字母表示差异显著(P<0.05)。
Values in the same column with different small letter superscripts mean significant difference (P<0.05), and those in the same row with different capital letter superscripts mean significant difference (P<0.05).
2.2 DNCB浓度对细胞抗氧化指标的影响
由表2可知,随着DNCB处理浓度的提高,细胞TrxR活性呈不同程度的降低趋势。与对照组相比,10、30 μmol/L的DNCB处理对细胞TrxR活性无显著影响(P>0.05);当DNCB处理浓度增加到50~100 μmol/L时,细胞TrxR活性显著降低(P<0.05),50和100 μmol/L剂量组之间无显著差异(P>0.05);当处理浓度进一步提高到300、500 μmol/L,细胞TrxR活性显著低于其他各组(P<0.05),300和500 μmol/L剂量组之间无显著差异(P>0.05)。
此外,随着DNCB处理浓度的提高,GPX、CAT和SOD活性呈先增后降的趋势。相对于对照组,10和30 μmol/L剂量组GPX、CAT和SOD活性在数值上有所提高,但组间差异不显著(P>0.05)。对于50 μmol/L的DNCB剂量组,除CAT活性显著低于10和30 μmol/L剂量组外,其他指标均与10和30 μmol/L剂量组间无显著差异(P>0.05)。100 μmol/L剂量组GPX、CAT和SOD活性与对照组无显著差异(P>0.05),但显著低于10和30 μmol/L剂量组(P<0.05);当DNCB处理浓度进一步提高到300、500 μmol/L时,GPX、CAT和SOD的活性显著低于其他各组(P<0.05),但300和500 μmol/L剂量组之间无显著差异(P>0.05)。
随着DNCB处理浓度的提高,细胞MDA含量呈先降后增的趋势。10 μmol/L剂量组与对照相比MDA含量有所降低,但无显著差异(P>0.05),当作用浓度提高到30~100 μmol/L时,细胞MDA含量开始提高,但与对照组相比无显著差异(P>0.05),而当作用浓度进一步提高到300、500 μmol/L时,MDA含量显著高于对照组以及10和30 μmol/L剂量组(P<0.05)。
3 讨 论
3.1 DNCB浓度和作用时间对细胞增殖的影响
齐晓龙等[9]的研究认为,细胞增殖率过高或过低均不利于研究一些抗氧化剂对细胞氧化损伤的保护作用,增殖率过高说明没有对细胞造成明显的氧化损伤,过低说明对细胞造成不可恢复的损伤。一些用H2O2诱导细胞氧化损伤的模型研究认为,细胞增殖率以不低于70%、不高于80%为宜[10-11]。Andoh等[12]以5、10和50 μmol/L的DNCB作用人SH-SY5Y细胞24 h后发现,细胞增殖率分别降低到30%、50%和75%。Ade等[7]研究发现,25和50 μmol/L DNCB作用24 h后人神经树突细胞的增殖率显著降低,分别降低到75%和47%,认为在该试验条件下细胞增殖率为75%适宜于后续试验的开展。本试验结果表明,300、500 μmol/L的DNCB作用2 h导致细胞增殖率降低到73.31%左右,50、100 μmol/L的DNCB作用4 h导致细胞增殖率分别降低到约81.50%和66.85%,30 μmol/L的DNCB作用6 h导致细胞增殖率降低到76.67%,而引起细胞增殖率显著降低的其余各组合均导致细胞增殖率降低到55%以下。由此可见,以细胞增殖率在70%~80%范围作为判断标准,可选择30 μmol/L作用6 h或300、500 μmol/L作用2 h作为适宜的浓度和作用时间。考虑到500与300 μmol/L剂量组间差异不显著,本试验根据细胞增殖结果初步得出,以DNCB为应激源建立细胞氧化损伤模型时,30 μmol/L作用6 h和300 μmol/L作用2 h均可作为细胞氧化损伤的适宜刺激浓度与作用时间。
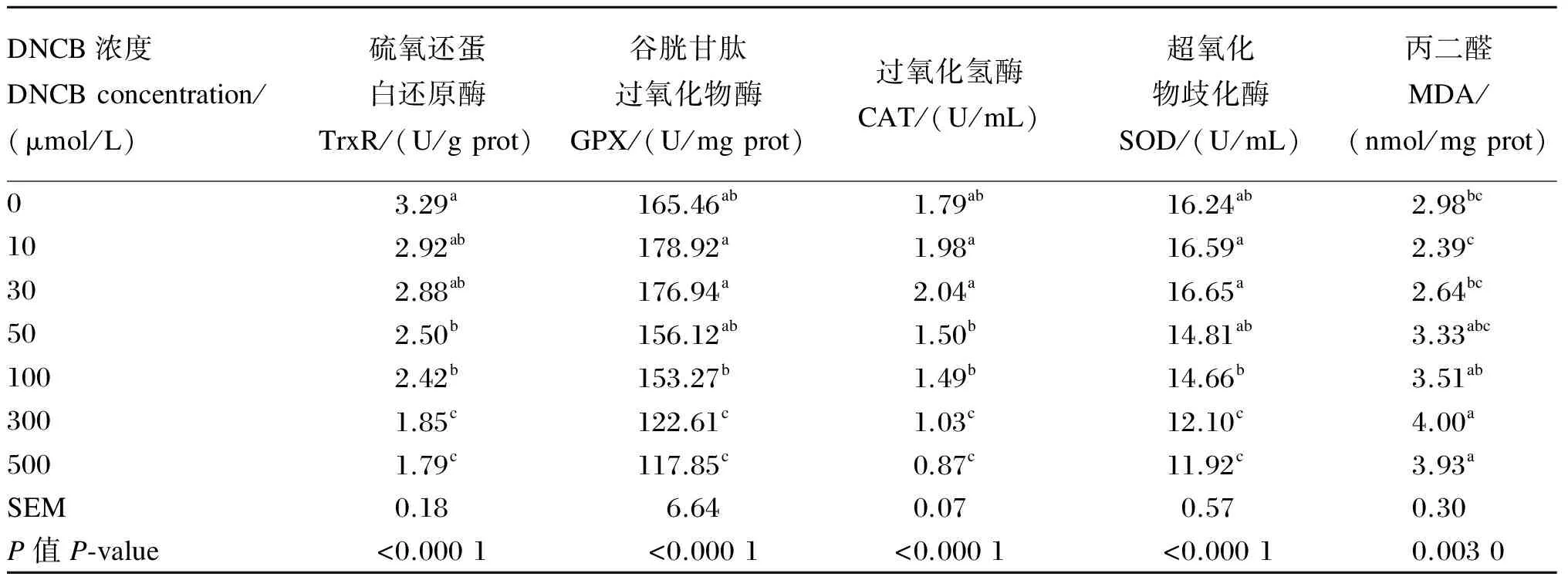
表2 DNCB浓度对BMEC抗氧化指标的影响
同列数据肩标不同小写字母表示差异显著(P<0.05)。
Values in the same column with different small letter superscripts mean significant difference (P<0.05).
3.2 DNCB作用浓度对细胞TrxR活性的抑制作用
DNCB作为一种亲电子化合物对TrxR的活性具有很强的抑制作用,主要通过使TrxR活性中心的硒代半胱氨酸残基及其邻近的半胱氨酸残基烷基化导致其活性降低或灭活[13]。当TrxR活性降低或被抑制时,可激活细胞凋亡信号激酶,从而诱导细胞的凋亡[14]。因此,TrxR活性被抑制的程度与细胞凋亡密切相关,可作为反映细胞是否发生氧化应激的重要判定指标。DNCB对TrxR活性的抑制作用与其浓度存在剂量依赖关系。用不同浓度(0~10 μmol/L)DNCB处理小鼠心脏线粒体的研究表明,随着DNCB处理浓度的提高,TrxR活性逐渐降低,当DNCB浓度为10 μmol/L时,TrxR活性降到70%[15]。然而关于TrxR的降低程度达到多少适宜于氧化建模没有具体的评价标准。本试验以BMEC为对象的研究结果表明,与对照组相比,DNCB 10、30 μmol/L剂量组对TrxR活性无显著的抑制作用,但50、100 μmol/L剂量组细胞TrxR活性显著降低,分别为对照组的75.99%和73.56%;当DNCB浓度增加到300、500 μmol/L时,TrxR活性进一步降低,分别降低到56.23%和54.41%。如果以细胞增殖率为70%~80%作为初步的判断标准,当DNCB的浓度为300 μmol/L、作用时间为2 h时,细胞增殖率降低到73.31%,此时TrxR活性降低到原来的56.23%。由此初步得出,DNCB对细胞TrxR活性的抑制程度达到43%以上时,可能会引起BMEC的氧化损伤,细胞增殖显著下降。
3.3 DNCB作用浓度对细胞抗氧化指标的影响
如前所述,本试验以细胞增殖率初步筛选得出,DNCB的浓度为300 μmol/L、作用时间为2 h时,细胞增殖率降低到73.31%,此时TrxR活性降低到56.23%,但细胞是否发生了显著的氧化损伤尚不清楚。GPX、SOD、CAT活性以及MDA含量是反映细胞是否发生氧化应激的重要判定指标。目前,关于DNCB对细胞上述抗氧化指标的影响未见有资料报道。用其他TrxR抑制剂(环磷酰胺)的研究发现,TrxR活性显著降低的同时,SOD、GPX和CAT的活性也显著降低[16]。本研究结果表明,300、500 μmol/L的DNCB作用于细胞2 h,可引起GPX、SOD和CAT活性的显著降低,MDA含量的显著提高,但300和500 μmol/L剂量组之间差异不显著。由此可见,300 μmol/L DNCB作用于细胞2 h即可对BMEC产生明显的氧化应激,可以作为建立氧化损伤模型时的处理浓度与处理时间,此时对TrxR活性的抑制程度达到43%以上;处理浓度再继续增加,相关指标的组间无显著差异,即细胞的氧化损伤程度不再继续增加。
4 结 论
当DNCB作用浓度为300 μmol/L、作用时间为2 h时,细胞增殖率显著降低,TrxR活性受到显著抑制,引起细胞产生明显的氧化应激,可作为建立细胞氧化损伤模型的适宜剂量和作用时间。
[1] VALKO M,LEIBFRITZ D,MONCOL J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].International Journal of Biochemistry & Cell Biology,2007,39(1):44-54.
[3] NORDBERG J,ZHONG L,HOLMGREN A,et al.Mammalian thioredoxin reductase is irreversibly inhibited by dinitrohalobenzenes by alkylation of both the redox active selenocysteine and its neighboring cysteine residue[J].Journal of Biological Chemistry,1998,273(18):10835-10842.
[4] CAI W Q,ZHANG L W,SONG Y L,et al.Small molecule inhibitors of mammalian thioredoxin reductase[J].Free Radical Biology and Medicine,2012,52(2):257-265.
[5] ISHIKAWA A,KUBOTA Y,MURAYAMA T,et al.Cell death by 1-chloro-2,4-dinitrobenzene,an inhibitor of thioredoxin reductase and its dual regulation by nitric oxide in rats[J].Neuroscience Letters,1999,277(2):99-102.
[6] ERIKSSON S E,PRAST-NIELSEN S,FLABERY E,et al.High levels of thioredoxin reductase 1 modulate drug-specific cytotoxic efficacy[J].Free Radical Biology and Medicine,2009,47(11):1661-1671.
[7] ADE N,ANTONIOS D,KERDINE-ROMER S,et al.NF-κB plays a major role in the maturation of human dendritic cells induced by NiSO4but not by DNCB[J].Toxicological Sciences,2007,99(2):488-501.
[8] 金鹿,闫素梅,史彬林,等.过氧化氢诱导的奶牛乳腺上皮细胞氧化损伤模型的建立[J].动物营养学报,2014,26(12):3651-3658.
[9] 齐晓龙,赵芹,张亚男,等.过氧化氢诱导产蛋鸡原代肝细胞氧化应激模型的建立[J].中国畜牧杂志,2013,49(11):49-52.
[10] 周丽娜.野木瓜注射液及野木瓜提取物对H2O2氧化损伤神经元的保护作用[D].硕士学位论文.上海:上海师范大学,2011:26-47.
[11] 孙婧陶,李兆华,张宝修,等.过氧化氢诱导延边奶山羊乳腺上皮细胞氧化损伤模型的建立[J].江苏农业科学,2013,41(10):149-152.
[12] ANDOH T,CHOCK P B,CHIUEH C C.The roles of thioredoxin in protection against oxidative stress-induced apoptosis in SH-SY5Y cells[J].Journal of Biological Chemistry,2002,277:9655-9660.
[13] RANDALL M J,SPIESS P C,HRISTOVA M,et al.Acrolein-induced activation of mitogen-activated protein kinase signaling is mediated by alkylation of thioredoxin reductase and thioredoxin 1[J].Redox Biology,2013,1(1):265-275.
[14] SOGA M,MATSUZAWA A,IGCHIJO H.Oxidative stress-induced diseases via the ASK1 signaling pathway[J].International Journal of Cell Biology,2012,2012:439587.
[15] STANLEY B A,SIVAKUMARAN V,SHI S,et al.Thioredoxin reductase-2 is essential for keeping low levels of H2O2emission from isolated heart mitochondria[J].Journal of Biological Chemistry,2011,286(38):33669-33677.
[16] WANG X F,ZHANG J S,XU T W.Cyclophosphamide as a potent inhibitor of tumor thioredoxin reductaseinvivo[J].Toxicology and Applied Pharmacology,2007,218(1):88-95.
*Corresponding author, professor, E-mail: yansmimau@163.com
(责任编辑 王智航)
Establishment of Oxidative Damage Model of Bovine Mammary Epithelial Cells Induced by Dinitrochlorobenzene Inhibiting Thioredoxin Reductase Activity
GONG Jian1,2YAN Sumei1*SHI Binlin1GUO Xiaoyu1JIN Lu1GUO Yongmei1
(1.CollegeofAnimalScience,InnerMongoliaAgriculturalUniversity,Hohhot010018,China; 2.CollegeofLifeScienceandTechnology,InnerMongoliaNormalUniversity,Hohhot010022,China)
Dinitrochlorobenzene (DNCB) was selected as the inhibitor of thioredoxin reductase (TrxR) activity to induce oxidative damage of bovine mammary epithelial cells (BMECs), and oxidative damage model was established by detecting cell proliferation rate, TrxR activity and antioxidant parameters in BMECs. The experiment was divided into two parts. The experiment 1 was conducted as a single factor randomized arrangement, and the 3th passage BMECs were divided into 35 groups with 8 replicates in each group. Cells were incubated with culture medium containing different concentrations of DNCB [0 (control), 10, 30, 50, 100, 300 and 500 μmol/L] for 2, 4, 6, 8 and 12 h to determine the appropriate action time of DNCB by detecting the cell proliferation rate. Based on the results in experiment 1, the experiment 2 was conducted as a single factor randomized arrangement, and the cells were divided into 7 groups with 6 replicates in each group. Cells were incubated with culture medium containing different concentrations of DNCB [0 (control), 100, 200, 400, 600, 800 and 1 000 μmol/L] for 2 h to select the appropriate concentration of DNCB by measuring TrxR activity and antioxidant parameters. The results showed that compared with control group, the group of 300 μmol/L DNCB for 2 h resulted in significant oxidative damage of BMECs, and cell proliferation rate reduced to 73.31%, TrxR activity decreased to 56.23%, the activities of glutathione peroxidase, superoxide dismutase and catalase also significantly decreased (P<0.05), and malondialdehyde content significantly increased (P<0.05). The results indicate that DNCB concentration of 300 μmol/L and the time of 2 h can be selected as the appropriate action concentration and time to establish the oxidative damage model of BMECs.[ChineseJournalofAnimalNutrition, 2015, 27(12):3984-3990]
bovine mammary epithelial cells; dinitrochlorobenzene; oxidative damage model
10.3969/j.issn.1006-267x.2015.12.041
2015-07-02
国家自然科学基金资助项目(31160466);“十二五”农村领域国家科技计划课题(2012BAD12B09-03)
弓 剑(1975—),男,内蒙古凉城人,讲师,博士,主要从事动物矿物质与维生素营养研究。E-mail: gongjian3021@sina.com
*通信作者:闫素梅,教授,博士生导师,E-mail: yansmimau@163.com
S826
A
1006-267X(2015)12-3984-07

