肉鸡源多重耐药空肠、结肠弯曲菌的耐药分子特征
胡欣洁,韩新锋,朱冬梅,赖海梅,罗佩文,曾 杭,周 康,邹立扣,刘书亮
肉鸡源多重耐药空肠、结肠弯曲菌的耐药分子特征
胡欣洁1,2,韩新锋1,2,朱冬梅1,赖海梅1,罗佩文1,曾 杭1,周 康1,2,邹立扣3,刘书亮1,2
目的 了解肉鸡源空肠和结肠弯曲菌的耐药谱特征,检测多重耐药菌株Ⅰ类整合子/基因盒、gyrA基因突变位点、tetO基因、23S rRNA突变位点的分子特征。方法 利用PCR检测弯曲菌Ⅰ类整合子/基因盒的存在情况;利用MAMA PCR技术检测弯曲菌gyrA基因第257位碱基的突变情况;针对弯曲菌23S rRNA的V区2075突变位点检测突变菌株。结果 多重耐药菌株占分离株的94.5%。146株多重耐药空肠和结肠弯曲菌中Ⅰ类整合子检出率为98.6%,有78株菌株检出3种基因盒,1 000 bp+750 bp+500 bp+250 bp为主要谱型,所占比例为92.3%;有131株在gyrA喹诺酮类耐药决定区发生突变,突变率为92.9%。127株四环素耐药弯曲菌tetO基因的检出率为95.3%。81株红霉素耐药菌株中,23S rRNA的V区2075处突变发生率为96.3%。结论 空肠和结肠弯曲菌分离株携带aadA2耐药基因盒,与氨基糖苷类药物的耐药性相关;gyrA基因突变、tetO基因的携带以及23S rRNA突变,与弯曲菌对喹诺酮、四环素和大环内酯类耐药密切相关。
肉鸡;空肠弯曲菌;结肠弯曲菌;耐药基因;整合子;基因盒
弯曲菌(Campylobacterspp.),尤其是空肠弯曲菌(Campylobacterjejuni,C.jejuni)和结肠弯曲菌(Campylobactercoli,C.coli)是引起弯曲菌病最主要的两个种,可导致人急性胃肠炎,并有可能进一步引发格林-巴利综合征、急性神经肌肉瘫痪及反应性关节炎等其他疾病。由空肠弯曲菌引起的弯曲菌病占所有病例的80%~90%,由结肠弯曲菌引起的病例仅占5%~10%。广泛存在于各种温血动物的体内,以家禽、家畜和野禽中的带菌量最多,鸡是带菌率最高的动物,构成弯曲菌的体外储存宿主,鸡肉中空肠弯曲菌的分离率最高可达100%[1]。人可通过食用受到污染的食品及其制品和水源而患病,其感染率已经超过了沙门氏菌、志贺氏菌和大肠杆菌O157∶H7[2]。
随着抗菌药物在动物养殖过程中的大量使用,在药物的选择压力下,弯曲菌能通过细菌之间的基因水平传播从环境中获得耐药基因,还可通过耐药质粒、整合子、转座子等可动遗传元件的DNA水平转移而产生耐药基因,使得常规的抗菌药物和常规剂量的抗菌药物使用无效,且其耐药性可通过食物链传播到人群,加重了临床治疗的难度和疾病负担。同时,多重耐药的现象更为弯曲菌感染的治疗和疾病的控制提出了考验。
本研究在对肉鸡源空肠弯曲菌分离菌株抗菌药物耐药表型的基础上,应用PCR技术对多重耐药菌株进行相关耐药基因的检测,分析各类耐药基因与弯曲菌耐药表型之间的关系,为空肠弯曲菌和结肠弯曲菌感染的有效防制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株 2012-2013年,从四川省某大型肉鸡屠宰场的不同环节(屠宰前鸡粪样—净膛环节肉鸡胴体表面—胴体分割后鸡肉表面)采集样本651份,按照GB/T 4789.9—2008的方法,分离弯曲菌疑似菌株,并以弯曲菌属的16S rRNA基因、结肠弯曲菌的ceuE基因和空肠弯曲菌的hipO基因为靶基因,对疑似菌株进行三重PCR鉴定。从样品中准确鉴定出空肠弯曲菌160株、结肠弯曲菌130株[3]。空肠弯曲菌质控菌株(ATCC33560)由四川农业大学食品微生物实验室保存。
1.1.2 培养基 Bolton肉汤、改良Skirrow氏琼脂基础、CCDA琼脂基础、哥伦比亚血琼脂基础、布氏肉汤、M-H培养基,购自青岛海博生物技术有限公司;新生级小牛血清、脱纤维绵羊血,购自成都康迪生物技术有限公司。
1.1.3 试剂 DL1000 DNA Marker、DL2000 DNA Marker、DL5000 DNA Marker、2× long Taq PCR MasterMix购自宝生物有限公司;GoldviewTM核酸染料、琼脂糖凝胶DNA回收试剂盒均购自北京天根生化有限公司。
1.1.4 PCR引物 检测Ⅰ类整合子/基因盒的2对引物和耐药基因的4对引物见表1。

表1 检测空肠弯曲菌Ⅰ类整合子和耐药基因的PCR引物[4-8]
1.2 方法
1.2.1 抗生素耐药表型的测定 采用琼脂稀释法对空肠和结肠弯曲菌分离株进行药物敏感性试验[9]。受试的8种药物分别为红霉素(EM)、环丙沙星(CIP)、左氧氟沙星(LEV)、庆大霉素(GEN)、氟苯尼考(FLO)、链霉素(STR)、林可霉素(CLI)、四环素(TET),均为原粉,购买于浙江新华制药有限公司。以空肠弯曲菌(ATCC33560)为质控菌株,根据美国临床实验室标准委员会(CLSI)标准[9]和文献[10-11]进行试验和结果判定。耐3种或3种以上药物的菌株判定为多重耐药菌株。
1.2.2 PCR模板的制备 采用热裂解法提取弯曲菌DNA。将在哥伦比亚平板上纯化培养后的菌种接种于布氏肉汤中,42 ℃微需氧培养48 h,12 000 r/min,离心1 min,收集菌体,用灭菌超纯水洗涤两次后,沉淀用80 μL TE(pH8.0)溶解,沸水浴10 min后冰浴5 min,12 000 r/min离心2 min,上清液即为DNA模板[5]。
1.2.3 PCR反应 选取146株多重耐药弯曲菌菌株,检测其Ⅰ类整合子携带情况,对整合子阳性的菌株扩增其基因盒携带情况;选取141株喹诺酮类表型耐药菌,利用MAMA PCR检测其gyrA基因第257位碱基的突变情况。针对127株四环素表型耐药菌株,检测其tetO基因携带情况;针对81株红霉素表型耐药菌株,检测其23S rRNA基因V区突变情况。优化后的PCR体系为:2×PCR Mix 12.5 μL,模板1.0 μL,10 μmol/L的上下游引物各1.0 μL,补灭菌双蒸水至最终体积25 μL。MAMA PCR检测菌株耐喹诺酮类药物决定区(QRDR)突变情况时,引物浓度比例为P1∶P2∶P3=5∶4∶1。以上PCR体系扩增条件为:95 ℃预变性10 min;之后95 ℃变性40 s,49~60 ℃退火40 s,72 ℃延伸50 s,30个循环;最后72 ℃延伸7 min,4 ℃保存。PCR产物采用琼脂糖凝胶(1.5%)进行电泳检测,并用凝胶成像系统观察、照相。
PCR扩增出预期目标条带的菌株视为Ⅰ类整合子阳性菌株。阳性率=整合子阳性菌株数/菌株总数×100%。通过相关基因盒的扩增,确定整合子阳性菌株所携带的基因盒谱,统计不同菌株的PCR产物条带,得到整合子基因盒的分布情况;并对其大小不一的片段,胶回收并送宝生物(大连)有限公司测序,将测序结果在GenBank中用 BLAST进行序列搜索和比对分析,获得整合子编码的耐药基因。随机选取弯曲菌PCR扩增阳性菌株的PCR产物送宝生物(大连)有限公司测序。
2 结 果
2.1 弯曲菌分离株耐药谱的测定 290株弯曲菌分离株共产生了52种耐药谱,耐3种或3种以上药物的多重耐药菌株占94.5%(274/290),对8种药物都具有耐药性的占2.1%。耐药谱CIP LEV GEN TET CLI EM优势明显,占所有分离株的35.2%;耐药谱CIP LEV GEN STR TET CLI EM 和CIP LEV TET CLI,均占7.6%;耐药谱CIP LEV TET占6.9%(表2)。
2.2 Ⅰ类整合子的携带情况 选取的146株多重耐药菌株中,有144株扩增出目的条带,为Ⅰ类整合子阳性菌株,检出率为98.6%(144/146)。其中,空肠弯曲菌Ⅰ类整合子阳性率为98.7%(77/78),结肠弯曲菌Ⅰ类整合子阳性率为98.5%(67/68),两者差异不明显。
2.2 整合子/基因盒扩增情况 对144株Ⅰ型整合子阳性弯曲菌进行基因盒的扩增,有78株检测到250~1 000 bp大小的基因盒,基因盒检出率为54.2%。其中,空肠弯曲菌基因盒检测率为16.9%(13/77),结肠弯曲菌基因盒检出率为97.0%(65/68)。基因盒组合包括3种类型,分别为1 000 bp、1 000 bp+750 bp和1 000 bp+750 bp+500 bp+250 bp,其中1000 bp+750 bp+500 bp+250 bp为主要基因盒组合类型,占92.3%(72/78),1 000 bp和1 000 bp+750 bp均占3.8%(3/78)。1 000 bp、1 000 bp+750 bp和1000 bp+750 bp+500 bp+250 bp基因盒组合类型均在空肠弯曲菌中检出,分别占3.9%(3/77)、3.9%(3/77)和9.1%(7/77),结肠弯曲菌仅检出1 000 bp+750 bp+500 bp+250 bp基因盒组合类型,占97.0%(图1)。测序结果表明,片段大小为1 000 bp、750 bp左右的整合子序列和GenBank登录号为AF530636.1和AF530637.1的核酸序列同源性达到99%,为aadA2基因盒,属氨基糖苷类抗生素的耐药基因。
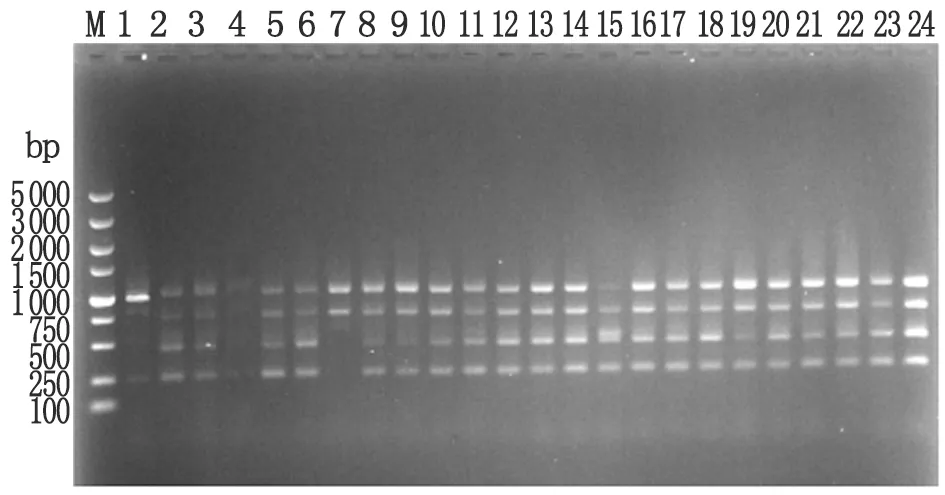
M: DL5000 DNA Marker;Lane 1-24: Examples for detection of gene cassettes in relation to classⅠ integron ofCampylobacterspp.
图1 部分整合子阳性弯曲菌菌株基因盒PCR检测结果
Fig.1 Gene cassettes patterns of integronⅠpositiveC.jejuniandC.coliusing PCR
2.3 MAMA PCR检测弯曲菌分离株gyrA基因点突变结果 在141株喹诺酮类耐药菌中,有131株在gyrA基因257位碱基处发生了突变,突变率为92.9%,空肠弯曲菌、结肠弯曲菌gyrA基因257位碱基的突变率分别为97.3%(71/73)、89.7%(61/68);对喹诺酮类药物敏感的菌株gyrA基因257位碱基没有发生突变(图2)。
对弯曲菌gyrA基因耐药决定区进行序列分析发现,耐喹诺酮类药物(环丙沙星和左氧氟沙星)的菌株在第257位碱基发生了C→T的突变,导致原来的苏氨酸突变为异亮氨酸;而喹诺酮类 (环丙沙星和左氧氟沙星)敏感菌株在257位均未发生C→T突变。1株菌株在243位发生了T→C的突变,4株测序菌株均在360位发生了T→C的突变,但由于该突变发生在密码子的第3位,为同义突变,其编码的氨基酸没有发生改变。

表2 肉鸡源弯曲菌耐药谱的分布情况
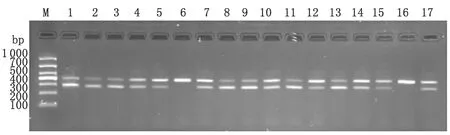
M: DL1000 DNA Marker; Lane 1-17: Examples for detection of point mutation in gyrA gene of Campylobacter spp.
2.4 四环素类耐药菌株tetO基因检测结果 127株四环素表型耐药的弯曲菌分离株中,有121株菌株检测出携带有tetO基因,检出率为95.3%,其中空肠弯曲菌、结肠弯曲菌的检出率分别为96.6%(57/59)、94.1%(64/68)。
2.5 大环内酯类耐药菌株23S rRNA基因检测结果 81株耐红霉素的菌株中,有78株菌株在23S rRNA的V区2 075碱基处发生突变,突变率为96.3%,其中空肠弯曲菌、结肠弯曲菌的突变率分别为95.0%(19/20)、96.7(59/61),红霉素敏感菌株没有检测出该类突变(图3)。测序结果显示,大环内酯类(红霉素)表型耐药菌株均在第2075位碱基发生了A→G的突变;而大环内酯类药物(红霉素)敏感菌株在2 075位碱基处均未发生该类突变。
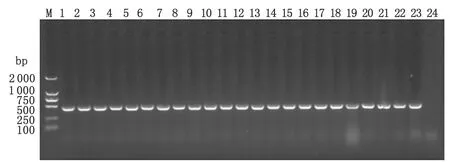
M: DL2000 DNA Marker; Lane 1-24: Examples for detection of mutation in 23S rRNA gene of Campylobacter spp.
3 讨 论
通常弯曲菌病导致的腹泻属于自限性疾病,但是对于免疫力低下以及症状较严重的患者,抗生素的使用是有效且必须的。由于空肠弯曲菌分离培养相对困难,加之其药敏试验过程复杂,目前国内有关空肠弯曲菌的耐药数据比较缺乏。本研究对肉鸡源空肠和结肠弯曲菌进行了8种抗生素的体外药敏试验,为弯曲菌的耐药性研究提供了一定的基础数据。结果显示,肉鸡源弯曲菌对喹诺酮类药物、林可霉素和四环素的耐药率较高,原因可能与近年来我国大量使用喹诺酮和四环素类等抗菌药物作为饲料添加剂或治疗家禽的腹泻等疾病有关,与国内外有关报道相近[12-13]。在受试的8种药物中,94.5%的菌株对3种或3种以上药物耐受,表明四川地区鸡源弯曲菌的耐药性已经相当普遍和严重。
细菌通过整合子系统,不断从环境捕获外来耐药基因,并进行基因水平转移,使细菌的耐药性得以广泛传播。本试验的146株多重耐药菌株中,Ⅰ类整合子检出率为98.6%,明显高于Ekkapobyotin(4.82%)[4]、Lee(21%)[14]的报道。推测原因是因为随着时间的推移和抗生素的大量使用细菌整合子携带率逐渐升高。对分离株的耐药基因盒进行检测并序列分析,得知所有菌株均含有aadA2耐药基因盒,是氨基糖苷类抗生素的耐药基因。
喹诺酮类药物在食源性动物中的大量使用,导致动物性食品链中弯曲菌对喹诺酮类药物的耐药性不断增强。对喹诺酮类的耐药机制主要为DNA旋转酶gyrA及拓扑酶Ⅳ的基因突变及细菌溢出泵和外膜孔道蛋白改变造成。空肠弯曲菌DNA旋转酶gyrA蛋白(Thr-86→Ile)的突变是导致喹诺酮耐药的主要机制。在该区域内的点突变,能够导致酶结构的改变,阻止药物进入药物作用区,导致细菌耐药[15-16]。本研究利用MAMA PCR技术,对耐喹诺酮类弯曲菌gyrA基因257位碱基的突变情况进行了检测,表明分离株喹诺酮类耐药决定区的突变率为92.9%。测序结果显示,gyrA基因257位发生点突变,造成Thr-86→Ile的改变,是导致弯曲菌对喹诺酮类耐药的主要原因。该基因内其余位点的突变,没有造成氨基酸序列变化,与Said[17]、Sonnevend[18]的结果一致。本试验中,有9株对环丙沙星或左氧氟沙星耐药的弯曲菌未检测到gyrA基因257位碱基发生点突变,原因可能是存在其他关键突变位点或细菌外排泵作用导致弯曲菌耐药[19]。
tetO基因是一种核糖体保护蛋白,广泛存在于革兰氏阴性菌中,能够使细菌的核糖体免受四环素的作用,从而增加细菌的耐药性。127株四环素耐药弯曲菌tetO基因的检出率为95.3%,其中空肠弯曲菌、结肠弯曲菌的检出率分别为96.6%、94.1%,与Ekkapobyotin[4](97.01%)、Gibreel[7](100.00%)、Qin[14](100.00%)等的结果相似。本试验对部分四环素耐药菌株未检测出该基因,可能是由于存在其它耐药机制,具体原因有待进一步研究。
针对弯曲菌23S rRNA的V区2075碱基位点进行检测,81株红霉素耐药菌株突变率为96.3%,其中空肠弯曲菌、结肠弯曲菌在2075处的突变率分别为95.0%和96.7%,与Qin[14](98.00%)的结果较为相近。测序结果显示,23S rRNA的V区2075位碱基A→G的突变,是导致弯曲菌对红霉素耐药的主要原因,与Payot S[20]的研究结果相符合。
本文对四川省肉鸡源空肠和结肠弯曲菌进行了耐药谱特征及耐药基因检测的研究,结果显示多重耐药弯曲菌普遍存在,使得感染的危险性和治疗困难程度增加。作为一种人兽共患病原菌,弯曲菌的耐药性应引起足够重视,加强对其耐药性监控和耐药机制研究,对于防控多重耐药菌的传播和流行具有重要的公共卫生意义。
[1]Barrios PR, Reiersen J, Lowman R, et al. Risk factors forCampylobacterspp. colonization in broiler flocks in Iceland[J]. Prev Vet Med, 2006, 74(4): 264-278. DOI:10.1016/j.prevetmed.2005.12.003
[2]Alfredson DA, Korolik V. Antibiotic resistance and resistance mechanisms inCampylobacterjejuniandCampylobactercoli[J]. FEMS Microbiol Lett, 2007, 277(2): 123-132. DOI:10.1111/j.1574-6968.2007.00935.x
[3]Zhu DM, Liu SL, Peng Z, et al. Isolation, multiple PCR identification and antimicrobial resistance analysis ofCampylobacterspp. from chicken[J]. Chin J Zoonoses, 2014, 30(4): 390-396. DOI:10.3969/cjz.j.issn.1002-2694.2014.04.010 (in Chinese) 朱冬梅, 刘书亮, 彭珍, 等. 肉鸡源弯曲菌的分离、多重PCR鉴定及其耐药性分析[J]. 中国人兽共患病学报, 2014, 30(4): 390-396.
[4]Ekkapobyotin C, Padungtod P, Chuanchuen R. Antimicrobial resistance ofCampylobactercoliisolates from swine[J]. Int J Food Microbio, 2008, 128(2): 325-328. DOI:10.1016/j.ijfoodmicro.2008.09.005
[5]Levesque C, Piche L, Larose C, et al. PCR mapping of integrons reveals several novel combinations of resistance genes[J]. Antimicrob Agents Chemothe, 1995, 39(1): 185-191. DOI:10.1128/AAC.39.1.185
[6]Zirnstein G, Li Y, Swaminathan B, et al. Ciprofloxacin resistance inCampylobacterjejuniisolates: detection ofgyrAresistance mutations by mismatch amplification mutation assay PCR and DNA sequence analysis[J]. J Clin Microbiol, 1999, 37(10): 3276-3280.
[7]Gibreel A, Tracz DM, Nonaka L, et al. Incidence of antibiotic resistance inCampylobacterjejuniisolated in Alberta, Canada, from 1999 to 2002, with special reference to tet(O)-mediated tetracycline resistance[J]. Antimicrob Agents Chemother, 2004, 48(9): 3442-3450. DOI:10.1128/AAC.48.9.3442-3450.2004
[8]Payot S, Avrain L, Magras C, et al. Relative contribution of target gene mutation and efflux to fluoroquinolone and erythromycin resistance, in French poultry and pig isolates ofCampylobactercoli[J]. Int J Antimicrob Agents, 2004, 23(5): 468-472. DOI:10.1016/j.ijantimicag.2003.12.008
[9]Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobiacaly; approved standard[S]. 8th Ed. CLSI document M07-A8. Clinical and Laboratory Standards Institute, Wayne, PA. 2009: 12-15.
[10]Chen X, Naren GW, Wu CM, et al. Prevalence and antimicrobial resistance ofCampylobacterisolates in broilers from China[J]. Vet Microbiol, 2010, 144(1/2): 133-139. DOI:10.1016/j.vetmic.2009.12.035
[11]Lehtopolku M, Nakari UM, Kotilainen P, et al. Antimicrobial susceptibilities of multidrug-resistantCampylobacterjejuniandC.colistrains: in vitro activities of 20 antimicrobial agents[J]. Antimicrob Agents Chemother, 2010, 54(3): 1232-1236. DOI:10.1128/AAC.00898-09
[12]Xu HY, Huang JL, Bao GY, et al. Prevalence and antimicrobial susceptibility ofCampylobacterspp. in diarrhea patients in Yangzhou[J]. Chin J Zoonoses, 2008, 24(1): 58-62. (in Chinese) 徐海燕, 黄金林, 包广宇, 等. 扬州市区腹泻人群空肠弯曲菌和结肠弯曲菌流行状况及耐药性分析[J]. 中国人兽共患病学报, 2008, 24(1): 58-62.
[13]Qin SS, Wu CM, Wang Y, et al. Antimicrobial resistance inCampylobactercoliisolated from pigs in two provinces of China[J]. Int J Food Microbiol, 2011, 146(1): 94-98. DOI:10.1016/j.ijfoodmicro.2011.01.035
[14]Lee MD, Sanchez S, Zimmer M, et al. Class 1 integron-associated tobramycin-gentamicin resistance inCampylobacterjejuniisolated from the broiler chicken house environment[J]. Antimicrob Agents Chemother, 2002, 46(11): 3660-3664. DOI:10.1128/AAC.46.11.3660-3664.2002
[15]Bebear CM, Renaudin H, Charron A, et al. Alterations in topoisomerase IV and DNA gyrase in quinolone-resistant mutants ofMycoplasmahominisobtainedinvitro[J]. Antimicrobial Agents Chemother, 1998, 42(9): 2304-2311.
[16]Jacobs-Reitsma WF, Kan CA, Bolder NM. The induction of quinolone resistance inCampylobacterbacteria in broilers by quinolone treatment[J]. Lett Appl Microbiol, 1994, 19(4): 228-231. DOI:10.1111/j.1472-765X.1994.tb00950.x
[17]Said MM, Mohamady H, Fawkia M, et al. Detection ofgyrAmutation among clinical isolates ofCampylobacterjejuniisolated in Egypt by MAMA-PCR[J]. J Infect Dev Ctries, 2010, 4(9): 546-554. DOI:10.3855/jidc.963
[18]Sonnevend A, Rotimi VO, Kolodziejek J, et al. High level of ciprofloxacin resistance and its molecular background amongCampylobacterjejunistrains isolated in the United Arab Emirates[J]. J Med Microbiol, 2006, 55(11): 1533-1538. DOI:10.1099/jmm.0.46744-0
[19]Iovine NM. Resistance mechanisms inCampylobacterjejuni[J]. Virulence, 2013, 4(3): 230-240. DOI:10.4161/viru.23753
[20]Payot S, Avrain L, Magras C, et al. Relative contribution of target gene mutation and efflux to fluoroquinolone and erythromycin resistance, in French poultry and pig isolates ofCampylobactercoli[J]. Int J Antimicrob Agents, 2004, 23(5): 468-472. DOI:10.1016/j.ijantimicag.2003.12.008
Molecular characteristics of multidrug resistantCampylobacterjejuniandCampylobactercoliisolated from broilers
HU Xin-jie1,2,HAN Xin-feng1,2,ZHU Dong-mei1,LAI Hai-mei1,LUO Pei-wen1,ZENG Hang1,ZHOU Kang1,2,ZOU Li-kou3,LIU Shu-liang1,2
(1.CollegeofFoodScience,SichuanAgriculturalUniversity,Ya’an625014,China;2.KeyLaboratoryofAgriculturalProductsProcessingandPreservationEngineeringofSichuanProvince,Ya’an625014,China;3.LaboratoryofMicrobiology,DujiangyanCampusofSichuanAgriculturalUniversity,Dujiangyan611830,China)
Two hundred and ninety broiler originated isolates ofCampylobacterjejuniandCampylobactercoliwere examined for antimicrobial resistance against eight kinds of antimicrobial agents. Results indicated that multidrug resistant (MDR) strains occupied 94.5% of the isolates. A total of 146 isolates of MDRC.jejuniandC.coliwere further researched for classⅠ integron and related cassettes, and the results indicated that 98.6% of the isolates harbored classⅠ integron; 78 isolates were positive for cassettes detection by PCR, 3 kinds of cassettes patterns were included and most (92.3%) of the isolates possessed 1 000 bp+750 bp+500 bp+250 bp cassettes, which was ascribed toaadA2 gene cassettes associated with resistance to aminoglycosides. The 92.9% of the quinolone resistant isolates had the Thr-86-Ile point mutation ingyrAat quinolone resistant determining region (QRDR), 95.3% of the tetracycline resistant isolates carriedtetOgene, 96.3% of the erythromycin resistant isolates were found the A-2075-G mutation in V region of 23S rRNA, respectively. This study provided antimicrobial resistance information for the control and prevention ofC.jejuniandC.coli, and also analyzed the underlying mechanism of resistances to quinolone, tetracycline and erythromycin.
broiler;Campylobacterjejuni;Campylobactercoli; antimicrobial resistance gene; integron; cassette
10.3969/cjz.j.issn.1002-2694.2015.08.002
国家自然科学基金项目(No.31400066)、 公益性行业(农业)科研专项子课题(No.200903055)联合资助
刘书亮,Email: lsliang999@163.com
1.四川农业大学食品学院,雅安 625014; 2.农产品加工及贮藏工程四川省重点实验室,雅安 625014; 3.四川农业大学都江堰校区微生物学实验室,都江堰 611830
Supported by the grants from the National Natural Science Foundation of China (No. 31400066) and the Special Scientific Research Fund of Agricultural Public Welfare Profession of China (No. 200903055) Corresponding author: Liu Shu-liang, Email: lsliang999@163.com
R378
A
1002-2694(2015)08-0694-06
2014-10-18;
2015-01-12

