GenoType MTBDRplus快速检测耐多药结核分枝杆菌复合群临床分离株效果评价
魏淑贞,林淑芳,林 建,赵 永,梁庆福,林勇明
GenoType MTBDRplus快速检测耐多药结核分枝杆菌复合群临床分离株效果评价
魏淑贞,林淑芳,林 建,赵 永,梁庆福,林勇明
目的 评价GenoType MTBDRplus快速检测耐多药结核分枝杆菌复合群(multi-drug resistantMycobacteriumtuberculosis Complex,MDR-MTBC)临床分离株的应用效能。方法 随机抽取福建省30个耐药监测点的129株MTBC包括全敏感菌株50株和79株MDR菌株,应用MTBDRplus 检测,同时扩增MDR菌株的rpoB,katG,inhA基因进行测序比对,并将检测结果与比例法药敏结果比较分析。结果 129株MTBC经MTBDRplus检测,Tub条带均阳性(100%),50株全敏感株的检测结果与比例法药敏结果完全一致。79株MDR菌株经MTBDRplus检出67株(84.81%)MDR,10株(12.66%)单耐RFP,2株(2.53%)单耐INH。经测序,77株MDR菌株的rpoB基因检测出突变,71株的katG和/或inhA检测出突变。以比例法药敏结果为金标准,MTBDRplus检测RFP、INH耐药性及MDR的敏感度分别为97.47%(77/79), 87.34%(69/79), 84.81%(67/79),MTBDRplus检测RFP、INH耐药性及MDR的特异度均为100%(50/50),一致率分别为98.45%(127/129),92.25%(119/129),90.70%(117/129)。结论 MTBDRplus是一种快速、准确、操作简便的技术,具有很好的应用前景,适用于耐多药结核分枝杆菌临床分离株的快速检测,但灵敏度有待进一步提高。
结核分枝杆菌;耐多药;线性探针;基因突变;快速诊断
耐药结核病,尤其是耐多药结核病(MDR-TB)是全球结核病控制的重大威胁。我国是全球27个耐多药结核病高负担国家之一[1]。据调查显示肺结核病人中耐多药率为8.32%,其中初治肺结核耐多药率为5.7%,估算我国每年大约新发11万例MDR-TB患者[2]。MDR-TB的快速诊断有助于减少MDR-TB流行传播。结核分枝杆菌不同药物的相关基因(rpoB,katG,inhA)突变位点与耐药性有一定相关性,因此可以通过检测各突变位点的DNA片段来判断结核分枝杆菌耐药情况。GenoType MTBDRplus(Hain Lifescience GmbH, Nehren, Germany)试验以探针试条为基础,基于多重PCR原理,将PCR、反向杂交、显色合为一体。对纯培养物或抗酸杆菌涂片阳性的痰标本进行检测,通过检测ropB基因突变判定对RFP的耐药性,检测katG基因判定对INH的高水平耐药,而检测inhA基因的启动子区域判定对INH的低水平耐药,因此可以快速检测MDR-TB。为了评价该试剂盒用于福建省临床分离的耐多药结核分枝杆菌的检测效能,对129株结核分枝杆菌复合群(Mycobacteriumtuberculosiscomplex,MTBC)包含79株MDR和50株全敏感菌株进行GenoType MTBDRplus检测。所有MDR菌株经rpoB,katG,inhA基因测序,并将检测结果与测序结果比对分析和评价。
1 材料与方法
1.1 菌株来源 本研究79株MDR和随机抽取的50株全敏感株均收集于2010年7月至2011年6月在福建省30个耐药监测点。分离的菌株均获得患者知情同意,并且已按照WHO推荐的比例法[1]完成药物敏感性试验(drug susceptibility test,DST)。结核分枝杆菌标准株H37Rv由国家结核病参比实验室提供。
1.2 提取DNA 取常规L-J培养基培养2-3周龄、生长良好的结核菌一菌环菌落溶于400 μLTE(PH8.0)中,在旋涡振荡器上震荡至块状固体菌落均匀溶于TE中,在95 ℃水浴15 min后,3 000 r/min离心5 min,取上清。
1.3 扩增rpoB,katG,inhA基因及测序检测 从http://www.ncbi.nlm.nih.gov的Genebank中获得结核分枝杆菌H37Rv的rpoB,katG,inhA基因序列。采用primer premier 5.0设计引物,引物序列见表1。PCR 反应体系为50 μL, 包括2ⅹTaq PCR Master Mix 25 μL、引物(10 μM)各2 μL, 模板5 μL,去离子水16 μL。PCR 扩增条件:94 ℃变性8 min;94 ℃ 30 s ,退火 30 s (退火温度依引物而定,如表1),72 ℃45 s,30个循环;再72 ℃延伸5 min。PCR产物经1.5%琼脂糖凝胶电泳验证为单一的扩增条带后,产物送上海生物工程公司测序。测序结果通过http://www.ncbi.nlm.nih.gov的BLAST与H37Rv 的相应基因序列进行比对分析。同时排除测序引起的误差判断测序结果。
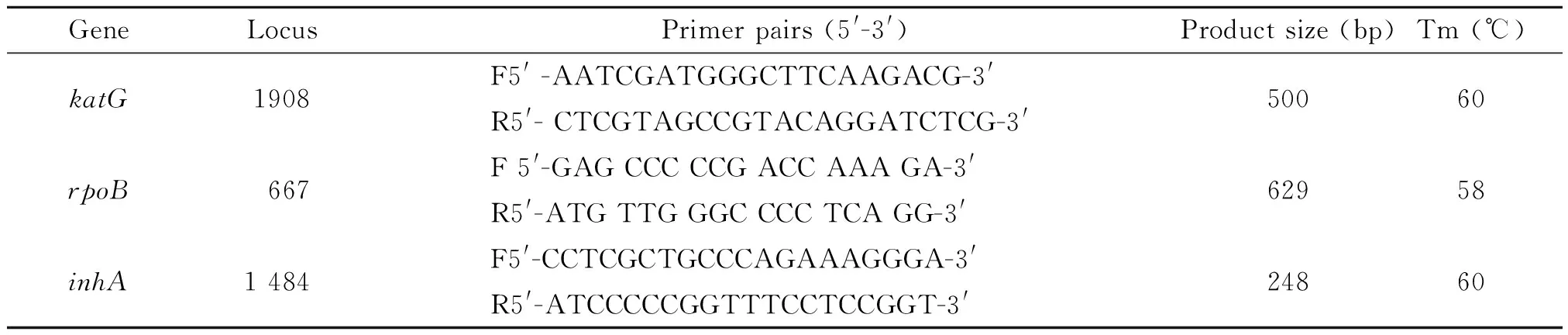
表1 耐药基因的扩增引物及产物长度
1.4 GenoType MTBDRplus 检测 根据GenoType MTBDRplus assay试剂盒说明书进行操作。杂交与检测是采用试剂盒的试剂,在一台带摇晃的半自动的TwinCubator(Hain Lifescience GmbH, Nehren, Germany)上根据厂家设定的步骤进行操作。先45 ℃杂交30 min,两次漂洗,然后显色,再清洗,最后将探针试条吸干粘贴在判读表上。每个探针试条共有27个反应条带:有5个质控带,CC带(标记物质控) 反映探针试条上标记物结合并与定位反应的有效性,AC带( 扩增质控) 用于确认PCR扩增反应是否成功,3个基因位点质控带(rpoB、katG和inhA)用于确认所检测的相应基因位点反应的最佳敏感度。Tub带用于确认结核分枝杆菌复合群,当Tub带未出现就不能用本系统判读结果。野生型探针的条带标记有WT,突变探针的条带标记有Mut。M 带是color marker。当某一基因区所有的WT探针染色均为阳性,表示该基因区没有发生可检测的突变,试验菌株对相应的药物敏感。如果某1个基因区至少有1个野生型探针WT缺失或突变型探针Mut染色阳性,则表示试验菌株对相应的药物耐药。rpoB野生型探针WT1 -WT8是针对热点核心区;rpoB突变型探针(Mut1, Mut2A, Mut2B, Mut3)是分别检测rpoB相应的密码子突变(D516V, H526Y, H526D, S531L)。katG315密码子野生型探针(WT);katG突变型探针(MUT1,MUT2)分别是检测AGC-315-ACC(S315T1)和AGC-315-ACA(S315T2)。inhA野生型探针WT1检测9-22,WT2检测_1-12;inhA突变型探针Mut1,Mut2,Mut3A,Mut3B分别检测_15C/T, _16A/G, _8T/C, and _8T/A。探针条带结果判读,如图1。

注:Neg:阴性对照,Rv:H37Rv,中间为实验菌株编号。
Note: Neg: Negative, Rv: H37Rv, others were tested strains
图1 结核分枝杆菌GenoType MTBDRplus检测结果
Fig.1 Detection patterns ofMycobacteriumtuberculosisby GenoType MTBDRplus
1.5 质量控制 每次GenoType MTBDRplus 检测均有阳性对照H37Rv和阴性对照(水)进行质控。PCR测序与GenoType MTBDRplus检测均在双盲下操作。
1.6 数据整理与统计学分析 实验数据用Excel进行整理,通过SPSS11.5进行统计学分析,运用χ2检验比较测序与MTBDRplus检测结果之间的差异,P<0.05差异有统计学意义。
2 结 果
129株MTBC包括50株全敏感株及79株MDR经GenoType MTBDRplus检测Tub条带均阳性(100%)。50株全敏感株所有野生型探针均阳性,即MTBDRplus检测结果与DST结果一致。79株MDR经MTBDRplus检测出67株(84.81%)为MDR,10株(12.66%)单耐RFP,2株(2.53%)单耐INH。79株MDR菌株经测序,77株菌株的rpoB基因均检测出突变,71株的katG和/或inhA检测出突变,有2株经测序发现katG基因突变位于315之外,故MTBDRplus检测显示为INH敏感。
2.1 MTBDRplus检测RFP耐药性 79株MDR经检测,rpoB基因区域出现至少1条野生型探针缺失或出现突变型探针的菌株有77株,占97.47%。有53株出现突变型探针(67.09%),如表2所示,其中D516V 6株(7.60%),H526Y 3株(1.27%),H526D 5株(6.33%),S531L 38株(48.10%)。有2株(2.53%)判定为RFP敏感,这两株经测序,rpoB基因区未发现突变。
2.2 MTBDRplus检测INH耐药性 79株MDR经检测,有69株(87.34%)能够正确判出INH耐药,如表3所示 ,这69株经测序发现katG315突变
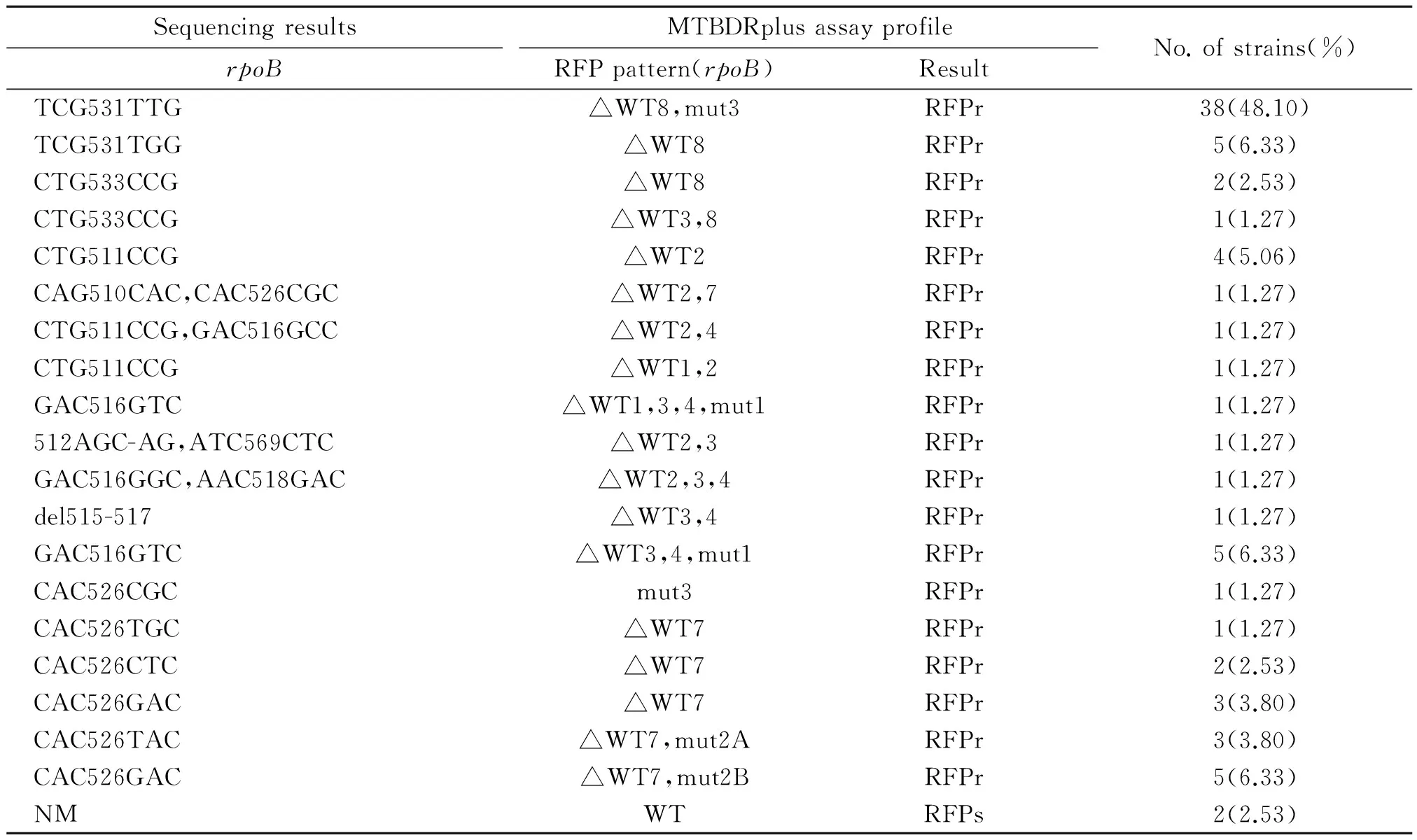
表2 MTBDRplus检测79株MDR菌株RFP耐药性的结果与测序结果的比较
注:WT,野生型探针; mut, 突变型探针;r,耐药;s,敏感; NM, 未突变; del, 缺失;△,缺失.
Note: WT, wild probe; mut, mutated probe; r, resistance;s, sensitive; NM, no mutation; del, deletion;△,dleltion.
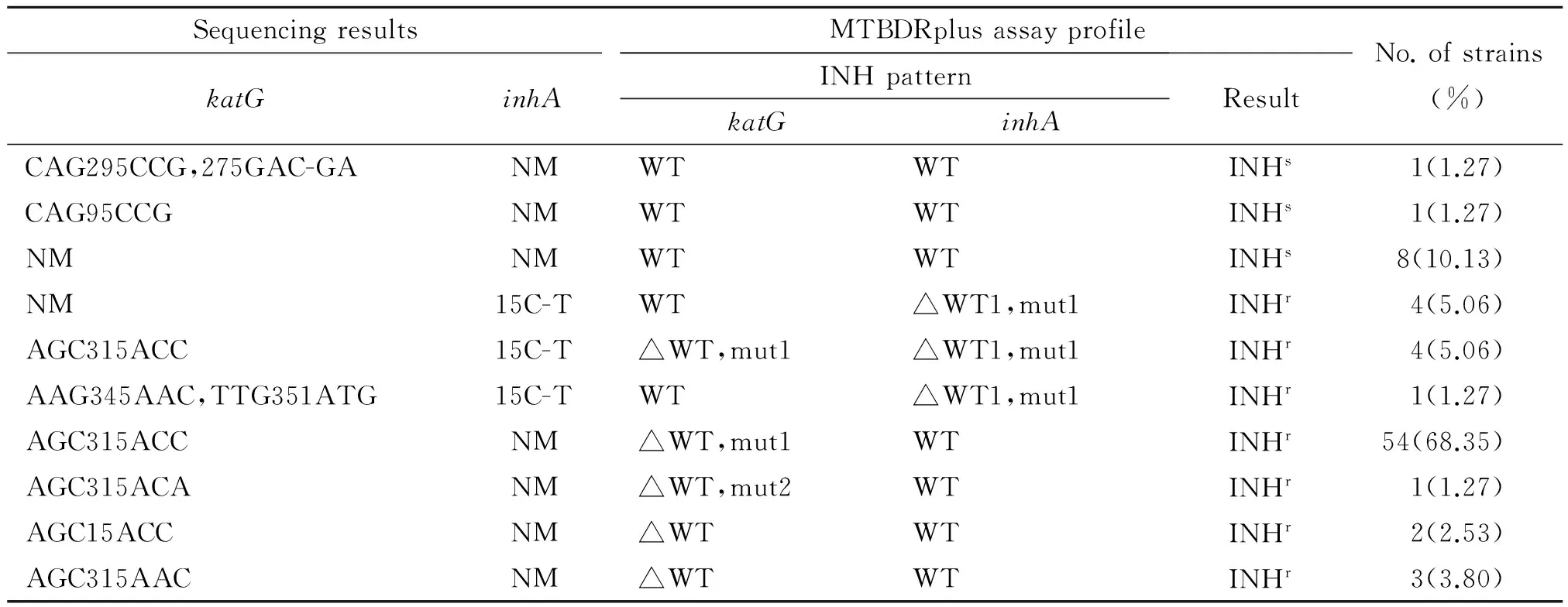
表3 MTBDRplus检测79株MDR菌株INH耐药性的结果与测序结果的比较
注:WT,野生型探针; mut, 突变型探针;r,耐药;s,敏感; NM, 未突变;△,缺失.
Note: WT, wild probe; mut, mutated probe;r, resistance;s, sensitive; NM, no mutation;△,dleltion.
或inhA基因突变,另有2株测序检测出katG315密码子之外的突变而MTBDRplus检测显示为阴性。64株katG基因区域出现315野生型探针缺失或出现突变型探针,即INH高水平耐药占81.01%,其中58株(占73.42%)S315T1和1株S315T2,这59株突变型探针阳性的菌株经测序均检测出315密码子氨基酸改变。另测序结果为S315N的3株菌株和S315T的2株显示为野生型探针缺失。有9株inhA基因区域出现野生型探针缺失或出现突变型探针,占11.39%。这9株inhA的突变均为C15T,其中4株在katG基因区域也出现突变型探针S315T1(AGC315ACC),与测序结果完全一致。
2.3 MTBDRplus的检测效能 若以传统DST为金标准,MTBDRplus检测RFP耐药性的敏感度为97.47%(77/79), 检测INH耐药性的敏感度为87.34%(69/79), 检测MDR的敏感度为84.81%(67/79),MTBDRplus检测RFP、INH耐药性及MDR的特异度均为100%(50/50),一致率分别为98.45%(127/129),92.25%(119/129)和90.70%(117/129)。MTBDRplu检测与测序方法检测MDR菌株突变特征之间的差异经χ2检验,χ2=63.93,P<0.05,差异有统计学意义。
3 讨 论
结果显示 MTBDRplus能够用于纯培养物MTBC的RFP和INH耐药性的快速检测,具有高的敏感度,且操作简便。MTBDRplus检测RFP耐药性的敏感度为97.47%,与国外报道[3]相一致,高于国内报道的88.48%[4],这与本文采用结核分枝杆菌纯培养物进行检测有关。77株(占97.47%)rpoB野生型探针缺失或出现突变型探针,其中出现突变型探针的特征与对福建省MDR菌株rpoB基因的突变特征报道相符[5]。且在测序中均被检测出。测序检测出的rpoB基因核心区频率低突变如L511P,L533P,S531W,H526C,H526L及联合突变如E510H+H526R,L511P+D516A,D516G+N518D及del516-517,在MTBDRplus检测时显示为相应密码子野生型缺失。本研究发现rpoB基因野生型探针WT8缺失的菌株发生突变为S531W或L533P,而关于rpoB基因533密码子突变与RFP耐药性的关系存在一定争议,有报道533密码子突变与RFP耐药相关[6],也有认为533密码子突变与RPF耐药无关[3],本研究结果经测序核实,认为533密码子突变与RFP耐药有一定关系。另2株MTBDRplus检测RFP敏感的菌株经测序未发现突变,经RFP耐药实时荧光定量核酸扩增技术(Xpert MTB/RIF)[7]检测,也为RFP敏感,这种“假敏感”现象可能由于这两株菌株rpoB基因突变发生在核心区之外,而测序和MTBDRplus及Xpert MTB/RIF只针对核心区域,故检测不出突变;或存在其他的耐药机制。
MTBDRplus检测INH耐药性的敏感度为87.34%,略高于国内报道的77.78%[5],略低于国外报道的92.0%[3]。本研究进一步表明MTBDRplus用于纯培养物的RFP和INH耐药性检测的敏感度高于对涂阳痰标本的检测。经MTBDRplus,本研究的79株MDR菌株katG主要以S315T(AGC315ACC )为主,占73.42%。另测序结果为S315N的3株菌株和S315T的2株显示为野生型探针缺失。inhA基因突变主要是C15T,未检出其他位置的突变。有4株在katG基因、inhA基因区域均出现突变型探针,经测序这4株菌株的这两个基因均存在突变,进一步表明inhA基因突变常伴随katG基因突变,对INH耐药具有协同作用,这与文献报道相仿[8-10]。MTBDRplus检测MDR的敏感度为84.81%,主要受限于该方法检测INH耐药性的敏感度,若能提高检测INH耐药性敏感度,则检测MDR敏感度也将进一步提高。MTBDRplus与测序方法检测MDR菌株突变特征之间的差异(χ2检验,P<0.05)具有统计学意义。表明测序方法检测MDR菌株的突变能力高于MTBDRplus,同时有些MDR菌株测序及MTBDRplus检测结果均为敏感,主要与测序和MTBDRplus检测探针只针对核心区域或突变率较高的位点有关。
MTBDRplus检测耐药性耗时比传统分离培养和DST耗时大大缩短,仅需5~6 h,可早期发现患者,能直接用于检测抗酸涂阳痰标本[4,11],使患者耐药性检测成本明显低于传统的DST[11]。本研究79株MDR-MTBC和50株全敏感菌株均来自福建省30个耐药监测点,样本代表性良好。据报道该快速诊断技术可以用于地市级MDR-TB检测[4],从本结果来看MTBDRplus检测技术非常适合用于MDR-TB快速检测。因MTBDRplus仅检测RFP和INH两种药物,故不能取代传统培养和DST。这是因为痰培养和一线药敏极其重要,它是进一步做其他药物药敏试验的基础;MTBDRplus检测RFP和INH耐药性仅针对于核心突变或突变率高的位点,有些被诊断为敏感的菌株仍然需要做RFP和INH耐药性核实确认;再者福建省非结核分枝杆菌(NTM)的检出率较高[12],标本可能为NTM或混合性感染。
[1]WHO. Global tuberculosis report 2014[J].Geneva: World Health Organization, 2014.
[2]Zhao YL, Xu SF, Wang LX, et al. National survey of drug resistant tuberculosis in China [J]. N Engl J Med, 2012, 366(23): 2161-2170. DOI: 10.1056/NEJMoa1108789
[3]Hillemann D, Rusch-Gerdes S, Rihter E, et al. Evaluation of the genotype MTBDR plus assay for rifampin and isoniazid susceptibility testing ofMycobacteriumtuberculosisstrains and clinical specimens[J]. J Clin Microbiol, 2007, 45(8): 2635-2640. DOI: 10.1128/JCM.00521-07
[4]Li Q, Ou XC, Xia H, et al. Evaluation on the performance of Genotype MTBDRplus in prefectural tuberculosis hospitals[J]. Chin Prev Med, 2013, 14(1): 35-38. (in Chinese) 李强,欧喜超,夏辉,等.Genotype MTBDR plus 快速耐药诊断方法在地市级结核病医院应用的评估研究[J].中国预防医学杂志,2013, 14(1):35-38.
[5]Wei SZ, Chen QY, Wang KL, et al. Characteristic of mutations inrpoBgene of 46 multi-drug resistantMycobacteriumtuberculosisisolates from Fujian Province[J]. Chin J Zoonoses, 2012, 28(9): 913-916. DOI: 969/cjz.j.issn.1002-2694.2012.09.011 (in Chinese) 魏淑贞,陈求扬,万康林,等.福建省46株耐多药结核分枝杆菌rpoB基因突变特征分析[J].中国人兽共患病学报,2012, 28(9):913-916.DOI:10.3969/cjz.j.issn.1002-2694.2012.09.011
[6]Yue J, Shi W, Xie J, et al. Mutations in therpoBgene of multidrug-resistantMycobacteriumtuberculosisisolates from China[J]. J Clin Microbiol, 2003, 41: 2209-2212. DOI: 10.1128/JCM.41.5.2209-2212.2003
[7]World Health Organization. Roadmap for rolling out Xpert Mtb/RIF for rapid diagonisis of TB and MDR-TB[M]. Geneva: World Health Organization, 2010.
[8]Cai J, Liu XX, Li ZD, et al. Study on characteristics of katG , inhA and ahpC gene mutations in isoniazid resistant isolates ofMycobacteriumtuberculosis[J]. Chin J Health Lab Technol, 2013, 23(6):1430-1432. (in Chinese) 蔡捷,刘小香,李召东,等.结核分枝杆菌临床菌株katG、inhA和aphC基因突变与异烟肼耐药的相关性研究[J].中国卫生检验杂志,2013, 23(6):1430-1432.
[9]Kiepiela P, Bishop KS, Smith AN, et al .Genomic mutations inkatG,inhAandahpCgenes are useful for the prediction of isoniazid resistance inMycobacteriumtuberculosisisolates from Kwazulu Natal, South Africa[J]. Tuber Lung Dis, 2000, 80(1): 47-56.
[10]Lin SF, Liang QF, Chen QY, et al. Mutations of drug-resistance genes related to INH inMycobacteriumtuberculosisisolates in Fujian province, China[J]. Chin J Zoonoses, 2014, 30(6): 588-593. DOI: 10.3969/cjz.j.issn.1002-2694.2014.06.009 (in Chinese) 林淑芳,梁庆福,陈求扬,等.福建省结核分枝杆菌异烟肼耐药相关基因突变特征初步分析[J].中国人兽共患病学报,2014, 30(6):588-593.
[11]Li Q, Xia H, Ou XC, et al. Cost comparison analysis of line probe assay and conventional drug susceptibility testing for diagnosis of drug resistance ofMycobacteriumtuberculosis[J]. Chin J Antituberc, 2013, 35(3): 187-190. (in Chinese) 李强,夏辉,欧喜超,等.应用线性探针技术与传统药敏试验检测耐药结核病的成本比较 [J].中国防痨杂志,2013, 35(3):187-190.
[12]Zhao Y, Lin SF, Liang QF, et al. Analysis of the drug resistant status of multi-drug resistantMycobacteriumtuberculosisin Fujian province[J]. Chin J Health Lab Tec, 2013, 23(18): 3603-3605. (in Chinese) 赵永,林淑芳,梁庆福,等.福建省耐多药结核分枝杆菌耐药现状分析[J].中国卫生检验杂志,2013, 23(18):3603-3605.
Evaluation on the performance of GenoType MTBDRplus assay for rapid diagnosis MDRMycobacteriumtuberculosisisolates in Fujian Province, China
WEI Shu-zhen,LIN Shu-fang,ZHAO Yong,LIN Jin,LIANG Qing-fu,LIN Yong-ming
(FujianCenterforDiseaseControlandPrevention,Fuzhou350001,China)
We conducted evaluation on the performance of GenoType MTBDRplus assay for rapid detecting multi-drug resistantMycobacteriumtuberculosisComplex (MDR-MTBC) isolates in Fujian Province, China. The strains including 79 MDR and 50 pan-susceptible were chosen randomly from 30 survey sites. The MTBDRplus was applied to detect RFP and INH resistance of the strains, and the results were compared with the result of sequencing data aboutrpoB,katGandinhAmutation. The Tub control were positive in all strains (100%), the results showed the patterns of 50 pan-susceptible strains were concordant with DST. By the assay, 67 (84.81%) MDR strains of 79 were correctly identified, 10 strains (12.66%) were mono resistant to RFP, and 2 were mono resistant to INH. The mutation inrpoBgene of 77 MDR strains and inkatG/inhAgene of 71 MDR strains was detected by sequencing. Provided that conventional DST is the "gold standard," the sensitivity of the MTBDR assay were 97.47% for RFP resistance detection, 87.34% for INH resistance detection and 84.81% for MDR detection. And the assay had the specificity of 100% for the detection of RFP, INH and MDR. The concordance rate of detection for RFP, INH and MDR was 98.45% (127/129), 92.25% (119/129), 90.70% (117/129), respectively. Thus, the new GenoType MTBDRplus assay represents a rapid, reliable and easy tool for the detection of INH and RFP resistance in clinical strains of MDR in Fujian Province and the sensitivity needs to be improved.
Mycobacteriumtuberculosis; MDR; line probe; gene mutation; rapid diagnosis
梁庆福,Email:liangqingfu@hotmail.com; 林勇明,Email:lym3428425@126.com
福建省疾病预防控制中心,福州 350001
Supported by the Fujian Provincial Medical Innovation Project (No. 2014-CXB-8) and the Fujian Provincial Science Foundation Project (No. 2010J01116) Corresponding authors: Liang Qing-fu, Email: liangqingfu@hotmail.com; Lin Yong-ming, Email: lym3428425@126.com
R378
A
1002-2694(2015)08-0728-05
2015-02-09;
2015-05-31
福建省医学创新课题(No.2014-CXB-8)和福建省自然科学基金课题(No.2010J01116)联合资助

