猫用高效狂犬病灭活疫苗研究
张 菲,何 娜,王 颖,刘 晔,张守峰,扈荣良
猫用高效狂犬病灭活疫苗研究
张 菲,何 娜,王 颖,刘 晔,张守峰,扈荣良
目的 研制水包油新型佐剂狂犬病疫苗开展猫的免疫试验。方法 利用BHK-21细胞培养狂犬病病毒鼬獾源性JX04-45株,病毒滴度达到107.5TCID50/mL以上的病毒培养物用于灭活和疫苗制备,佐剂为新型水包油型;通过本实验室建立的荧光抗体病毒中和试验(FAVN)测定疫苗效力和猫免疫后的中和抗体,并进行了攻毒试验,评价本疫苗免疫效果。结果 一个剂量的疫苗免疫小鼠后FAVN方法测定的疫苗效力≥3.0 IU/剂量;水包油佐剂型狂犬病灭活疫苗免疫猫后14 d时无不良反应,FAVN测得其诱导的中和抗体水平平均达16.04±4.29 IU/mL,28 d平均达37.13±6.12 IU/mL,56 d为21.01±7.61 IU/mL。180 d为6.71±3.44 IU/mL,360 d为2.66±2.01 IU/mL。至15个月时,咬肌攻毒106MIC LD50狂犬病病毒BD06株,观察90 d试验组无一死亡,对照组全部死亡。结论 本疫苗诱导长达1年的免疫保护,可扩大安全评价和临床试验,以验证其实用价值。
狂犬病;灭活疫苗;猫;中和抗体;攻毒试验
狂犬病(Rabies)是由狂犬病病毒(Rabies Virus)感染引起的一种以脑脊髓炎为主要病理特征、感染后100%死亡的人兽共患传染病[1-3]。
犬引起的人的狂犬病在我国人狂犬病病例中平均约占95%,是人狂犬病的主要传播宿主[4],但针对犬的狂犬病疫苗我国已批准了5种以上灭活疫苗产品,另有4种进口产品和2种弱毒疫苗[5],因此犬的狂犬病疫苗基本上可以满足我国犬免疫的需求。猫引起的人的狂犬病在我国不同地区所占比例为1%~9%不等,因此猫也是人狂犬病的重要传播宿主之一。但在我国批准的狂犬病弱毒疫苗和灭活疫苗中,针对猫的产品只有1种,且迄今未见正式生产和销售。为此本实验室利用分离的JX04-45株制备了一种水包油佐剂狂犬病灭活疫苗,并开展在猫的免疫试验,取得良好的效果。
1 材料与方法
1.1 病毒株 用于狂犬病灭活疫苗制备的毒株为分离自鼬獾的JX04-45株[6],在BHK-21细胞上增殖;用于攻毒用的强毒株为BD06,分离自河北保定的一只疯犬,在犬脑内传代;用于中和抗体测定的毒株为CVS-11,在BHK-21细胞上增殖。
1.2 细胞 用于病毒增殖的细胞为乳仓鼠肾传代系BHK-21,培养基为含有2%血清、100 IU青霉素/mL、100 μg链霉素/mL、pH7.2的MEM(Invitrogen)。
1.3 动物 2~3 kg的家猫20只,购自长春市某养殖中心,荧光抗体病毒中和试验(FAVN)检测猫的血清显示,所有猫体内均没有狂犬病中和抗体。16~20 g昆明鼠20只,购自长春生物制品研究所。狂犬病标准疫苗(11.6 IU/支)和标准血清(13.1 IU/mL)购自EDQM。
1.4 狂犬病灭活疫苗的制备 将JX04-45毒种按5%比例接种于BHK-21细胞上,于37 ℃培养至96 h,冻融2次后,按常规方法测定其半数细胞感染量(TCID50)。将107.5TCID50/mL以上的病毒培养物混合后,加入1/4 000的β-丙内酯,4 ℃灭活24 h,37 ℃水浴中水解2 h,按1∶2的比例将特制的水包油佐剂加入灭活的病毒液中混匀,1.1 mL/瓶分装,2~8 ℃保存备用。
1.5 FAVN方法 利用本实验室前期获得的抗狂犬病病毒核蛋白单克隆抗体2株,采用常规方法制备异硫氰酸荧光黄标记荧光抗体[7]。利用狂犬病毒灭活疫苗免疫犬1次,14 d后采集血清,制备抗狂犬病毒血清,并以OIE标准品进行标定,参考OIE指定方法,确定中和试验程序。其中血清加入量减少为50 μL,样品检测设置2个重复。
1.6 疫苗效力测定 采用免疫小鼠-血清测定的方法:将20只约16 g的昆明小鼠随机分成2组,采用胰岛素注射器吸取待测疫苗50 μL,于后肢肌肉注射途径接种,正常饲养至14 d时,摘除眼球,吸取小鼠血液,分离血清。
通过修饰的FAVN法测定各小鼠血清中的狂犬病中和抗体水平,修饰的FAVN方法主要不同在于:(1)血清加样时每个样品采用2个重复,减少一倍;(2)血清样品用量50 μL,减少1倍;(3)FITC标记抗体均为抗核蛋白单克隆抗体。测定出结果后,取中位数进行比较,根据结果判定待测疫苗的效力。
1.7 猫的免疫和抗体测定 随机取10只猫,每只猫注射1个剂量的上述疫苗于后退肌肉,注射后密切观察7 d后,如无异常,正常饲养,分别于接种前和接种后2、4、8周,180 d、360 d分别采集血清,通过FAVN方法测定抗体。对照猫不进行任何处理,并同上采集血清测定。
1.8 攻毒试验 将免疫猫和对照猫分别置于铁笼内隔离饲养,每只猫在咬肌注射BD06病毒2×105MIC LD50。观察猫的临床表现。攻毒猫在出现疑似狂犬病临床表现时,采用安乐死的方式处理病猫,并采用上述荧光抗体对脑组织进行染色检测确诊。
2 结 果
2.1 疫苗效力 共制备病毒效价大于107.5/mL的细胞培养物4 000 mL,制备疫苗6 000 mL,分装后制成疫苗5 385支。经测定,标准疫苗(稀释至3.0 IU/mL)和待测疫苗免疫10只小鼠后血清样品中中和抗体效力的中位数分别为7.86 IU/mL和9.36 IU/mL,因此,待测疫苗的效力>3.0 IU/mL。10只小鼠测定的结果如表1。
2.2 免疫猫不同时间中和抗体测定结果 通过FAVN方法测定的10只免疫猫在免疫后不同时间的中和抗体结果如表2。
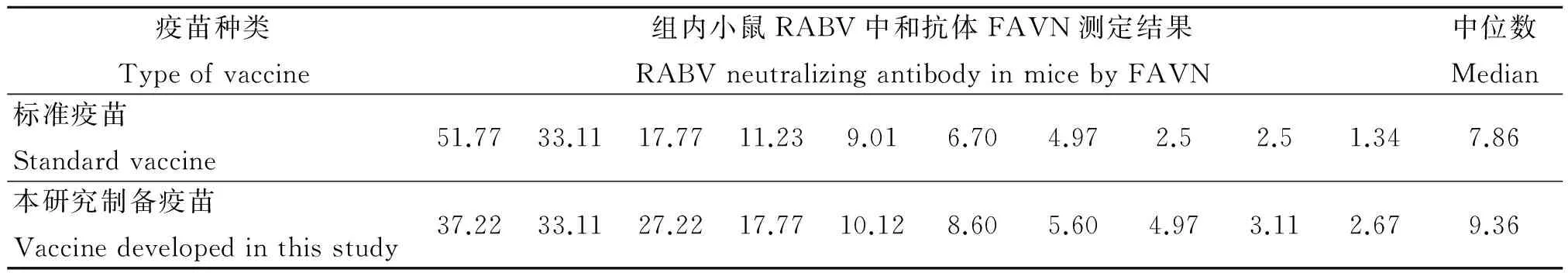
表1 疫苗效力检测结果
2.3 攻毒试验结果 10只免疫猫攻毒后在观察的90 d内无一出现异常临床表现,试验结束时未见任何猫死亡,全部获得保护。对照的10只猫于攻毒后的11~32 d相继死亡,经FAT检测进一步确定为RABV感染。
3 讨 论
本试验采用的病毒株为本实验室分离鉴定的JX04-45株,过去国内研制狂犬病疫苗大部分采用国外引进的疫苗株,如CVS-11、Flury-LEP、PV株等,有些则为国内人用疫苗弱毒株灭活苗,如CTN等。JX04-45株系分离自鼬獾的街毒,经过小鼠脑内连续传代后潜伏期缩短为7 d,在BHK-21细胞上具有稳定和高滴度的复制能力。因此,本疫苗系首次采用国内分离的狂犬病病毒高效毒株制备的猫用狂犬病灭活疫苗。
由于采用特制的水包油佐剂,疫苗免疫效力在抗原含量不需特别高的情况下即可在动物体内诱导较高的抗体滴度,说明本佐剂可提高疫苗的效力。国内批准用于犬的狂犬病疫苗质量标准中标示的效力分别为2.0 IU/剂量和2.5IU/剂量,后者至今未见投放市场。进口的4种狂犬病疫苗效力均只在1-2IU/剂量范围内。本疫苗可以达到3.0 IU/mL的效力,是目前国内动物用狂犬病疫苗效力中最高的。从抗体维持水平来看,犬用疫苗2.0 IU/剂量的效力在免疫后1年内后约有80%的犬保持在有效保护水平内,本疫苗免疫猫的抗体水平在1年后,100%(10/10)仍维持在保护水平以上。

表2 狂犬病新型佐剂疫苗在猫的免疫试验
攻毒后,在阴性对照猫全部死亡的情况下,免疫猫全部健活。尽管犬用疫苗通常采用30条以上/组的犬进行保护性试验,但保持30条猫的数量相对于其种类来说数量较大;由于猫对狂犬病病毒的敏感性较高,故10只猫的数量尽管属于中等数量的样本,但从未免疫对照组的全部死亡结果来看,攻毒数量和两组之间的显著差异可以看出,本研究制备的狂犬病灭活疫苗具有完全的保护效果。
本研究采用的佐剂为水包油佐剂,与其他已报道的狂犬病灭活疫苗采用的铝佐剂有所不同。该佐剂制备简单,采用普通疫苗使用的白油即可。佐剂性状为乳黄色水样,使用(注射)时极为方便,值得在同类灭活疫苗中推广。
本研究效力的测定采用免疫动物的中和抗体技术,而非采用小鼠攻毒试验,这种技术为半定量技术,需将标准疫苗稀释为期望的最低值,待测疫苗只要到该疫苗最低值疫苗所诱导的抗体水平,就可说明待测疫苗优于标准疫苗所含的效力。但是由于该方法只能取试验鼠血清测定结果的中位数或四分位数,而非全部鼠中和抗体的平均数,因此,也可能在一定条件下造成结果判定上的偏差。平均数在该类活体应答的检测中也不宜应用,主要是因为个体对同一抗原的应答水平相差悬殊,不适合平均数的统计学分析,同时本方法使用小鼠20只,期限缩短至16 d,取代了使用220只动物,耗时28 d的NIH方法,大大节省了费用。
[1]Official website of World Health Organization[EB/OL]. 世界卫生组织官方网站 http://www.who.int/mediacentre/factsheets/fs099/en/[EB/OL]
[2]The people’s Republic of China National Health and Family Planning Commission[EB/OL]. 中华人民共和国国家卫生和计划生育委员会 http://www.moh.gov.cn/3.htm[EB/OL]
[3]Song M, Tang Q. Analysis of related factors of rabies epidemic in China[J]. Chin J Epidemiol, 2005, 26(3): 956-959. (in Chinese) 宋淼,唐青.中国狂犬病流行相关因素分析[J].中华流行病学杂志, 2005, 26(3):956-959.
[4]Hu RL, Fooks AR, Zhang SF, et al. Inferior rabies vaccine quality and low immunization coverage in dogs (Canisfamiliaris) in China[J]. Epidemiol Infect, 2008, 137: 1-8.
[5]Cha L, Gao J, Hou JY. Safety and immune effect of adjuvant-free rabies vaccine[J]. Chin J Biologicals, 2006, 19(3): 206-207. (in Chinese) 查力,高军,侯剑英.无佐剂狂犬病疫苗的反应及免疫效果观察[J]. 中国生物制品学杂志, 2006,19(3):206-207.
[6]Liu Y, Fang LJ, Zhao JH. Culture and immunogenicity of a rabies virus isolate from Ferret Badger[J]. Chin J Biologicals, 2011, 24(2): 192-194. (in Chinese) 刘晔,房丽君,赵敬慧.鼬獾狂犬病病毒分离株的培养及其免疫原性[J].中国生物制品学杂志,2011,24(2):192-194.
[7]Zhang SF, Cao L, Zhang F. Establishment and application of hybridomas producing anti-rabies nucleoprotein McAb and fluorescent antibody virus neutralization test [J]. Chin J Lab Med, 2006, 29(6): 554-557. (in Chinese) 张守峰,曹亮,张菲.狂犬病毒核蛋白单抗和荧光抗体中和试验的建立与应用[J].中华检验医学杂志,2006, 29(6):554-557.
Hu Rong-liang, Email: ronglianghu@hotmail.com
Effective inactivated rabies vaccine for feline use
ZHANG Fei,HE Na,WANG Ying,LIU Ye,ZHANG Shou-feng,HU Rong-liang
(InstituteofVeterinarySciences,AcademyofMilitaryMedicalSciences,Changchun130122,China)
In this study, we carried out immunity test in cats with a high effective rabies vaccine, which was developed with new oil-in-water adjuvant. By the fluorescent antibody virus neutralization (FAVN) established in our laboratory, we assayed the efficacy of the vaccine in mice and monitored the neutralizing antibody level in cats after vaccination, and also challenged the cats to evaluate the immune effect of vaccine. Results showed that the efficacy of the vaccine tested in mice was to be more than 3.0 IU/dose and the vaccine had no adverse reaction in cats. The viral neutralizing antibody in cats was 16.04±4.29 IU/mL averagely 14 days post inoculation (dpi); 37.13±6.12 IU/mL, 28 dpi; 21.01±7.61 IU/mL, 56 dpi; 6.71±3.44 IU/mL, 180 dpi; 2.66±2.01IU/mL, 360 dpi. In 15 months, masseter muscle inoculation with 106MIC LD50of rabies virus BD06 strain was performed in cats. All cats in control group died after 90 days, while all in the vaccinated group survived, indicating the immune protection of the vaccine lasted for one year long.
rabies inactivated vaccine; cat; neutralizing antibody; challenge test
10.3969/cjz.j.issn.1002-2694.2015.08.001
国家863课题(No.2012AA101303)资助
扈荣良,Email:ronglianghu@hotmail.com
军事医学科学院军事兽医研究所,长春 130122
Supported by the National High Technology Research and Development Program (“863” program) of China (No. 2012AA101303)
R373
A
1002-2694(2015)08-0691-03
2014-07-18;
2014-11-21

