晚期糖化终产物受体中和抗体缓解腰5脊神经结扎大鼠神经病理性疼痛的效果观察
李向南,李永华,袁红斌
神经病理性疼痛是一种常见的难治性疼痛,指原发或继发于神经系统损害、功能障碍所导致的疼痛。创伤、手术、糖尿病及感染常导致神经病理性疼痛的发生,而临床上有效的治疗办法并不多。卫星胶质细胞(sate11ite g1ia1 ce11s,SGCs)作为背根神经节(DRG)中围绕感觉神经元的胶质细胞,其神经免疫功能受到疼痛学研究的普遍重视。目前认为,外周神经损伤后,激活的卫星胶质细胞介导启动了一系列免疫炎症反应,分泌包括肿瘤坏死因子α(TNF-α)在内的一系列促炎细胞因子,介导感觉神经元的痛觉过敏[1]。晚期糖化终产物受体(recepotr for advanced g1ycation end products,RAGE),是一种细胞膜表面免疫球蛋白超家族蛋白受体,广泛分布,其下游NF-κB入核调节炎症因子的释放[2]。本研究旨在观察抑制炎症因子的上游RAGE中和抗体是否对腰5脊神经结扎大鼠神经病理性疼痛的缓解有更好的效果,现报道如下。
1 材料与方法
1.1 实验动物和分组 雄性SD大鼠,体质量200~250 g,由第二军医大学实验动物中心提供,动物合格证号:SCXK(沪)2007-0003。筛选基础痛阈值在10~18 g之间的大鼠,分为3组:(1)对照组10只,暴露左侧L5脊神经,但不结扎,注射生理盐水。(2)安慰剂组10只,暴露左侧L5脊神经并结扎,术后鞘内注射生理盐水。(3)药物组10只,暴露左侧L5脊神经并结扎,手术后鞘内注射RAGE中和抗体5 μg/d,至术后第7天。各实验组大鼠采用低剂量(约 10 μ1)缓慢注射(3.3 μ1/min)的方法以保证注射药物扩散在大鼠腰5脊神经。实验中SD大鼠在标准条件下饲养,自由摄取水和食物,手术前6 h禁食禁饮。
1.2 方法
1.2.1 鞘内置管 于大鼠腹腔注射戊巴比妥钠20 mg/kg,消毒后,沿脊椎中线切开皮肤,找到 L5、L6棘突根部缝隙,用小针刺破,将PE-10导管内充满生理盐水后,从缝隙中插入髓鞘内约1.5 cm。导管从皮下沿脊柱向上在大鼠颈部穿出固定,封闭导管,消毒分层缝合肌肉及皮肤。以大鼠鞘内注射10 μ1利多卡因后后脚明显出现瘫软,30 min内恢复反应作为手术成功的标准。置管成功后单笼饲养。
1.2.2 动物模型建立 将置管成功的大鼠,参考Kim等[7]方法建立大鼠腰 5神经根结扎(SNL)模型。大鼠麻醉后,于大鼠L4~S2棘突水平沿背部皮肤作纵向中线切口,分离肌肉至第5腰椎横突,切断横突暴露第5腰神经,用5-0丝线结扎神经,缝合皮肤与肌肉,避免术后感染。对照组仅暴露但不结扎L5神经,其余步骤相同。
1.2.3 免疫组化荧光染色 采用数字表法随机选取正常大鼠和SNL后大鼠各4只麻醉后灌流固定,取术侧L5和L4背根神经节,放入4%PFA固定4~6 h,然后用20%蔗糖/PBS溶液脱水2 d。将组织包埋15 μm切片,贴片在92.5℃的水浴抗原修复10 min。0.01 mo1/L PBS漂洗3次,每次5 min。贴片滴加羊抗RAGE多克隆一抗(1∶100),室温孵育16~18 h,0.01 mo1/L PBS 漂洗3 次,每次5 min,然后加Cy3-驴抗羊 IgG 二抗(1∶400),0.01 mo1/L PBS漂洗3次,每次5 min,加甘油分封片。在荧光显微镜下观察并拍照(×400)。
1.2.4 测定机械缩爪阈值和热刺激缩爪潜伏期分别于手术前1 d、手术后第1、3、5、7天测定大鼠机械缩爪阈值(paw withdraw1 thresho1d,PWT)和热刺激缩爪潜伏期(paw therma1 withdraw 1atency,PT-WL)。测定前将大鼠置于有机玻璃箱内适应15 min后,用von Frey纤毛丝自金属网下部垂直刺激大鼠后肢足底中部,持续时间≤4 s,大鼠出现缩足或舔足行为视为阳性反应,否则为阴性反应。测定首先从2 g刺激开始,如该力度的刺激不能引起阳性反应,则给予相邻大一级力度的刺激;如出现阳性反应则给予相邻小一级力度的刺激。如此连续进行,直至出现第一次阳性和阴性反应的骑跨,再连续测定4次。最大力度为15 g,大于此值时记为15 g。每次刺激间隔30 s。用热板法测定各组大鼠热刺激缩爪潜伏期。将大鼠放入热板痛觉测痛仪上。待大鼠在透明的玻璃箱内安静后,开启电源辐射刺激足底。当大鼠出现逃避性抬腿或者舔足时,立刻切断热源,记录开始照射至出现缩足逃避反射时间(s),照射截止时间为20 s,以防大鼠足底灼伤。每只大鼠重复3次,取平均值即为PTWL。
1.2.5 ELISA测定 将大鼠麻醉后,在生理盐水冰面上迅速分取L5背根神经节,匀浆粉碎组织后加入组织裂解液,0℃静置30 min,以12 000 r/min低温离心5 min后,采用BCA法测定蛋白含量。采用双抗体夹心ABC-ELISA法检测TNF-α和白细胞介素(IL)-1β。将酶标包被板分别设置标准孔、待测孔和空白对照孔,将标准液和样本分别加入相应孔中37℃孵育1 h,洗涤;加入新鲜稀释的酶标第二抗体37℃孵育40 min,洗涤,加入底物 OPD,显色,在492 nm处测光密度值,通过绘制标准曲线求出标本的 TNF-α、IL-1β 水平。
1.3 统计学处理 数据使用SPSS 18.0统计软件进行分析。计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析(one-way ANOVA),P<0.05为差异具有统计学意义。
2 结果
2.1 动物模型建立 L5 SNL术后大鼠出现术侧后足不愿着地、足底外翻等典型机械痛敏体征,机械缩爪反射阈值呈逐步下降,说明制作的SNL模型是成功的。
2.2 SNL术后RAGE表达量变化 图1 A、B、C分别表示大鼠正常背根神经节、SNL术后L5背根神经节、SNL术后L4背根神经节。可见SNL术后RAGE平均荧光强度为(42.80±4.19),比术前(19.78±4.19)表达水平增高(P<0.05),而L4背根神经节并无明显变化。结果提示,SNL术后RAGE在神经病理性痛疼的发生中可能发挥重要作用。

图1 RAGE在SNL前后表达变化免疫组化图
2.3 行为学研究结果 SNL术后,L5背根神经节RAGE平均荧光强度(42.80±4.19)比术前(19.78±4.19)增高,差异有统计学意义(P<0.05)。安慰剂组大鼠术后1、3、5、7 d机械缩爪阈值(9.30±2.10,4.60±1.35,3.80 ±1.4,3.60 ±1.26)与对照组(13.00±2.58,12.50±2.64,13.50 ±2.42,13.00±2.58)比较差异有统计学意义(P<0.05)。安慰剂组大鼠术后1、3、5、7 d热刺激缩爪潜伏期(10.01±1.16,5.40+1.50,4.32 ±1.16,4.40 ±1.43)与对照组(12.80±1.14,13.00±1.25,12.70 ±1.34,12.80±1.55)比较差异有统计学意义(P<0.05)。药物组大鼠术后3、5、7 d机械缩爪阈值(8.00±2.31,7.40±2.12,7.20 ±1.93)与安慰剂组(4.60±1.35,3.80±1.40,3.60 ±1.26)比较差异有统计学意义(P<0.05)。药物组大鼠术后3、5、7 d热刺激缩爪潜伏期(8.15±1.37,8.26±1.29,7.00±1.07)与安慰剂组(5.40±1.51,4.32±1.16,4.40±1.43)比较差异有统计学意义(P<0.05)。见图2。
2.4 各组大鼠TNF-α和IL-1β的表达变化 为了确定RAGE中和抗体发挥镇痛作用的机制,笔者通过ELISA检测了其下游促炎细胞因子TNF-α和IL-1β的表达情况。药物组大鼠术后L5背根神经节TNF-α表达量(70.53±6.57)与安慰剂组(109.90±4.97)比较差异有统计学意义(P<0.05)。药物组大鼠术后L5背根神经节IL-1β表达量(88.24±3.60)与安慰剂组(168.77±6.34)比较差异有统计学意义(P<0.05)。见图3。
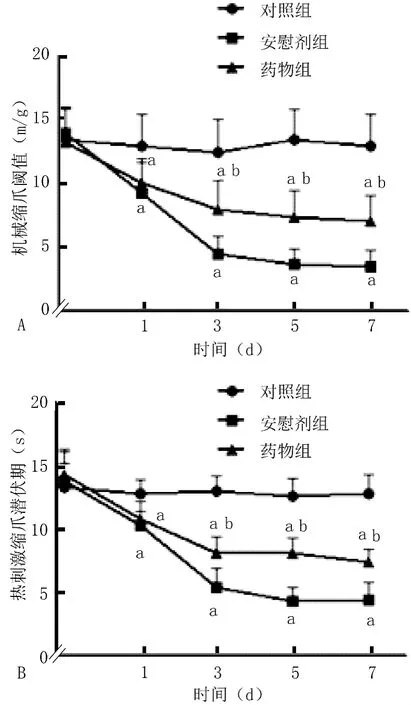
图2 各组大鼠不同时间点机械缩爪阈值与热刺激缩爪潜伏期
3 讨论
RAGE作为细胞膜表面免疫球蛋白超家族蛋白受体,具有多种配体,包括HMGB1 S100/钙结合蛋白、淀粉样多肽[3]。在生理状态下呈低水平表达,当细胞处于激活或应激状态时,受损细胞中RAGE的表达增多。RAGE与配体结合后激活细胞内各种信号转导机制,其中最重要的是氧化应激反应的增加和免疫炎性反应的加剧,最终产生致病效应。RAGE与不同配体结合后,可以激活细胞内不同的信号传导通路,比如 Ras-ERK、p38-MAPK 和 cdc42/rac途径,其多种信号通路大部分可通过NF-κB调节基因转录。NF-κB的激活可引起靶细胞产生大量的促炎因子,加剧炎症反应[4]。而外周神经组织损伤后,作为外周传入中枢信号换元的重要结构,背根神经节的功能异常对痛觉异常和痛觉过敏具有关键作用。卫星胶质细胞围绕感觉神经元,由缝隙连接相连,包绕感觉神经元构成了一个感觉神经元的微环境,一方面调节神经元的功能,另一方面其稳定性也受神经元的影响。笔者的研究发现RAGE在L5脊神经结扎后的DRG组织中表达增加,印证了Shibasaki等研究结果,根据其研究报道,RAGE在SNL模型建立后脊髓背角的表达没有显著差异[5]。

图3 各组大鼠背根神经节中TNF-α和IL-1β的表达情况
外周神经损伤后,卫星胶质细胞的功能和状态发生改变。激活的卫星胶质细胞增殖并启动了一系列免疫炎症反应,介导DRG感觉神经元的痛觉过敏,在这个过程中释放大量的促炎症因子。以往的研究中发现,肿瘤坏死因子α是神经系统较早释放的促炎细胞因子之一,其受体TNFR在毗邻损伤的外周神经元上表达上调[3],提示TNF-α可能在神经病理性疼痛的形成和发展中发挥重要的作用。炎症因子一方面作用于神经元,通过胶质神经元交互作用改变神经元的敏感性,另一方面又可自分泌作用于SGCs,形成正反馈,使pERK水平长时间增高,进一步增加其下游NF-κB表达入核促炎因子的释放,加剧疼痛状态的维持等[6]。虽然干预TNF-α的信号通路可以改善外周神经损伤导致的痛觉过敏,但临床上通过干预炎症因子的方法治疗疼痛存在治疗时间窗短,疗效差等问题[7]。笔者的研究将炎症因子的上游调节蛋白RAGE作为靶点,采用鞘内给予RAGE中和抗体而阻断RAGE信号传导能够扭转周围神经损伤后导致的痛觉过敏,可能是通过抑制卫星胶质细胞的活化减少了TNF-α和IL-1β生成。
综上所述,外周神经损伤可引起RAGE在背根神经节的表达增高,而鞘内注射RAGE中和抗体,可以减少TNF-α和IL-1β的表达并且改善SNL后大鼠痛阈值。鉴于RAGE对神经病理性疼痛发挥的作用,干预其信号通路传导对治疗神经病理性疼痛的具有良好的前景。
[1] Jasmin L,Vit JP,Bhargava A,et a1.Can sate11ite g1ia1 ce11s be therapeutic targets for pain contro1[J].Neuron G1ia Bio1,2010,6(1):63-71.
[2] Xie J,Méndez JD,Méndez-Va1enzue1a V,et a1.Ce11u1 Signa1of the receptor for advanced g1ycation end products(RAGE)[J].Ce11u1ar Signa11ing,2013,25(11):2185-2197.
[3] Schäfers M,Sorkin LS,Geis C,et a1.Spina1 nerve 1igation induces transient upregu1ation of tumor necrosisfactor receptors 1 and 2 in injured and adjacent uninjured dorsa1 rootgang1ia in the rat[J].Neurosci Lett,2003,347(3):179-182.
[4] Hess A,Axmann R,Rech J,et a1.B1ockade of TNF-α rapid1y inhibits pain responses in the centra1 nervous system[J].PNAS,2011 ,108(9):3731-3736.
[5] Shibasaki M,Sasaki M,Miura M,et a1.Induction of high mobi1ity group box-1 in dorsa1 root gang1ion contributesto pain hypersensitivity after periphera1 nerve injury[J].Pain,2010 ,149(3):514-521.
[6] Doya H,Ohtori S,Takahashi K,et a1.Extrace11u1ar signa1-regu-1ated kinase mitogen-activated protein kinase activation in the dorsa1 root gang1ion(DRG)and spina1 cord after DRG injury in rats[J].Spine,2005,30(20):2252-2256.
[7] Kim SH,Chung JM.An experimenta1 mode1 for periphera1 neuropathy produced by segmenta1 spina1 nerve 1igation in the rat[J].Pain,1992 ,50(3):355-363.

