血清高尔基蛋白体73与异常凝血酶原联合检测在肝癌诊断中的应用
王文鼎,缪亚梅,金 梅,王正兵
(1.泰州市溱潼人民医院检验科,江苏 泰州 225508; 2.泰州市人民医院检验科,江苏 泰州 225300; 3.扬州大学临床医学院普外科,江苏 扬州 225001)
血清高尔基蛋白体73与异常凝血酶原联合检测在肝癌诊断中的应用
王文鼎1,缪亚梅1,金 梅2,王正兵3
(1.泰州市溱潼人民医院检验科,江苏 泰州 225508; 2.泰州市人民医院检验科,江苏 泰州 225300; 3.扬州大学临床医学院普外科,江苏 扬州 225001)
目的 探讨高尔基体蛋白73(Golgi protein 73,GP73)及异常凝血酶原(des-gamm-carboxy-prothrombin,DCP)用于肝细胞肝癌(hepatocellular carcinoma,HCC)诊断的临床价值。方法 采用酶联免疫吸附法分别检测56例HCC患者、34例肝硬化患者以及30例健康体检者血清GP73以及DCP水平。结果 HCC组患者血清GP73含量为(201.9±92.9)μg·L-1,明显高于肝硬化组的(76.4±25.5)μg·L-1以及对照组的(29.9±15.0)μg·L-1(均P<0.01);HCC组患者血清DCP含量为(115.1±36.1)μg·L-1,明显高于肝硬化组的(45.6±16.4)μg·L-1以及对照组的(23.2±11.4)μg·L-1(均P<0.01)。Spearman相关分析发现,HCC患者GP73与DCP含量之间具有一定相关性,r=0.573,P<0.01。血清GP73诊断HCC最佳临界值为128.5 μg·L-1,其诊断灵敏度为80.4%,特异性为87.5%,曲线下面积为0.925 8;血清DCP诊断HCC最佳临界值为73.2 μg·L-1,其诊断灵敏度为76.8%,特异性为81.3%,曲线下面积为0.885 3。与血清GP73及DCP单项检测相比,二者联合检测能明显提高HCC的诊断灵敏度、特异性、阳性预测值、阴性预测值以及总有效率均明显高于(P<0.05);而二者单项检测各指标之间比较差异均无统计学意义(P>0.05)。 结论 HCC患者血清GP73及DCP含量显著增加,并且2个指标的联合检测对HCC的临床诊疗具有重要价值。
肝细胞肝癌; 肝硬化; 高尔基体蛋白73; 异常凝血酶原
肝细胞肝癌(hepatocellular carcinoma,HCC)是一种临床常见的恶性程度高且预后差的恶性肿瘤,多数HCC患者确诊时已经处于中晚期,手术切除后复发率高、易转移。因此早期发现、诊断及治疗对改善患者存活率和生活质量显得尤为重要。目前临床上以血清甲胎蛋白(AFP)检测作为HCC诊断的重要指标,但仍有30%~50%的HCC患者AFP为阴性,其敏感性与特异性仍差强人意[1-2]。因此,寻找更特异、敏感的血清肿瘤标志物对于HCC诊断显得尤为必要。高尔基体蛋白73(Golgi protein 73,GP73)以及异常凝血酶原(des-gamm-carboxy-prothrombin,DCP)是近年来新发现的有望成为HCC早期诊断以及判断预后的血清学诊断标志物[3-4]。本研究旨在联合检测HCC患者血清中GP73以及DCP水平,探讨二者在HCC临床诊断中潜在的应用价值。
1 资料与方法
1.1 研究对象
研究对象为泰州市人民医院2011年1月至2013年12月住院患者,其中:HCC组56例,男49例,女7例,平均年龄(53.5±10.5)岁,所有病例均经病理检查明确诊断;肝硬化组34例,男26例,女8例,平均年龄(49.6±11.4)岁,诊断符合2000年全国(西安)会议修订的《病毒性肝炎防治方案》[5];另选择同期本院健康体检者(对照组)30例,男24例,女6例,平均年龄(48.1±7.9)岁,经检查均排除肝脏良、恶性疾患。3组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2 检测方法
使用促凝管采集受试者清晨空腹肘静脉血3 mL,离心分离血清,-70 ℃保存待检。采用酶联免疫吸附试验(ELISA)法定量检测各组GP73以及DCP水平,试剂盒由美国R&D公司提供,严格按操作说明书进行,每次检测均重新建立定标曲线。
1.3 统计学方法
2 结果
2.1 3组患者血清GP73和DCP检测结果比较
HCC组患者血清GP73含量为(201.9±92.9)μg·L-1,明显高于肝硬化组的(76.4±25.5)μg·L-1以及对照组的(29.9±15.0)μg·L-1(均P<0.01);肝硬化组患者血清GP73也明显高于对照组(P<0.01),见图1A。HCC组患者血清DCP含量为(115.1±36.1)μg·L-1,明显高于肝硬化组的(45.6±16.4)μg·L-1以及对照组的(23.2±11.4)μg·L-1(均P<0.01);肝硬化组患者血清DCP也明显高于对照组(P<0.01),见图1B。Spearman相关分析发现,HCC患者GP73与DCP含量之间具有一定相关性,r=0.573,P<0.01,提示二者相关性较好,均可作为HCC血清学诊断标志物。
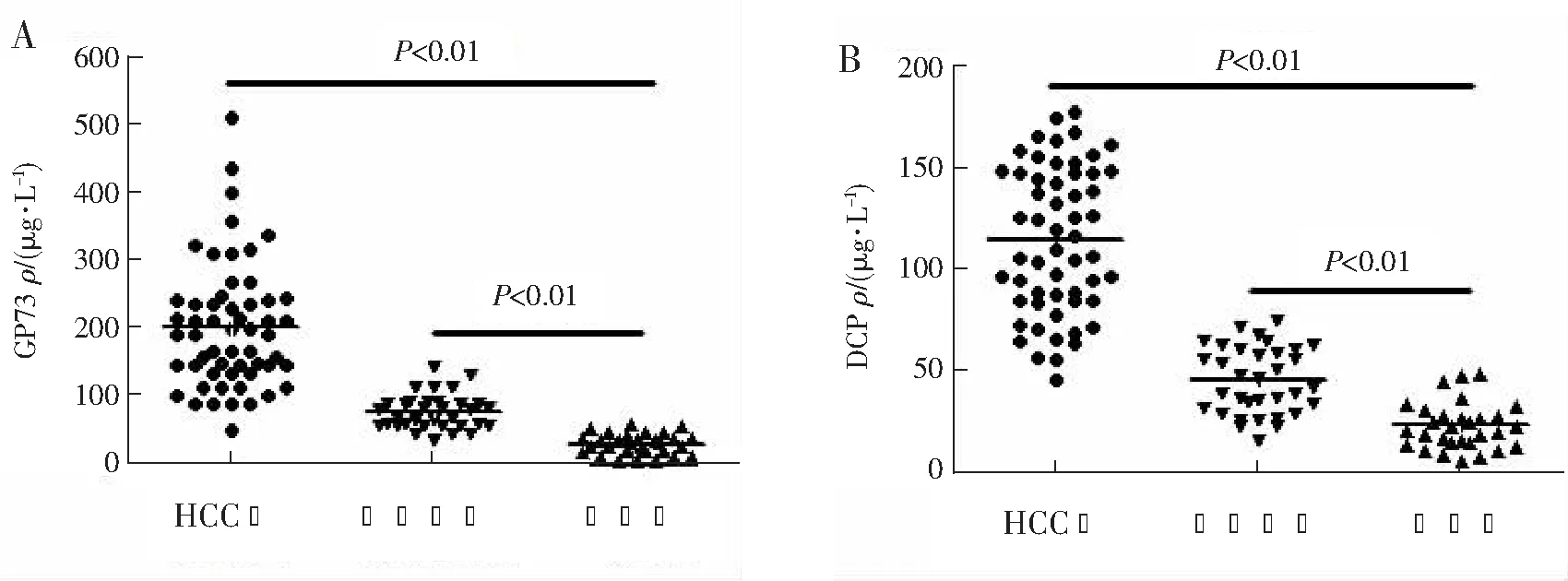
A:GP73;B:DCP。
2.2 ROC曲线分析血清GP73和DCP对HCC的诊断价值
通过ROC曲线确定临界值,以诊断HCC的灵敏度与特异性之和的最高值进行界定,血清GP73诊断HCC最佳临界值为128.5 μg·L-1,其诊断灵敏度为80.4%,特异性为87.5%,曲线下面积为0.925 8,95%置信区间为0.876 1~0.975 6,见图2A。血清DCP诊断HCC最佳临界值为73.2 μg·L-1,其诊断灵敏度为76.8%,特异性为81.3%,曲线下面积为0.885 3,95%置信区间为0.824 0~0.946 6,见图2B。
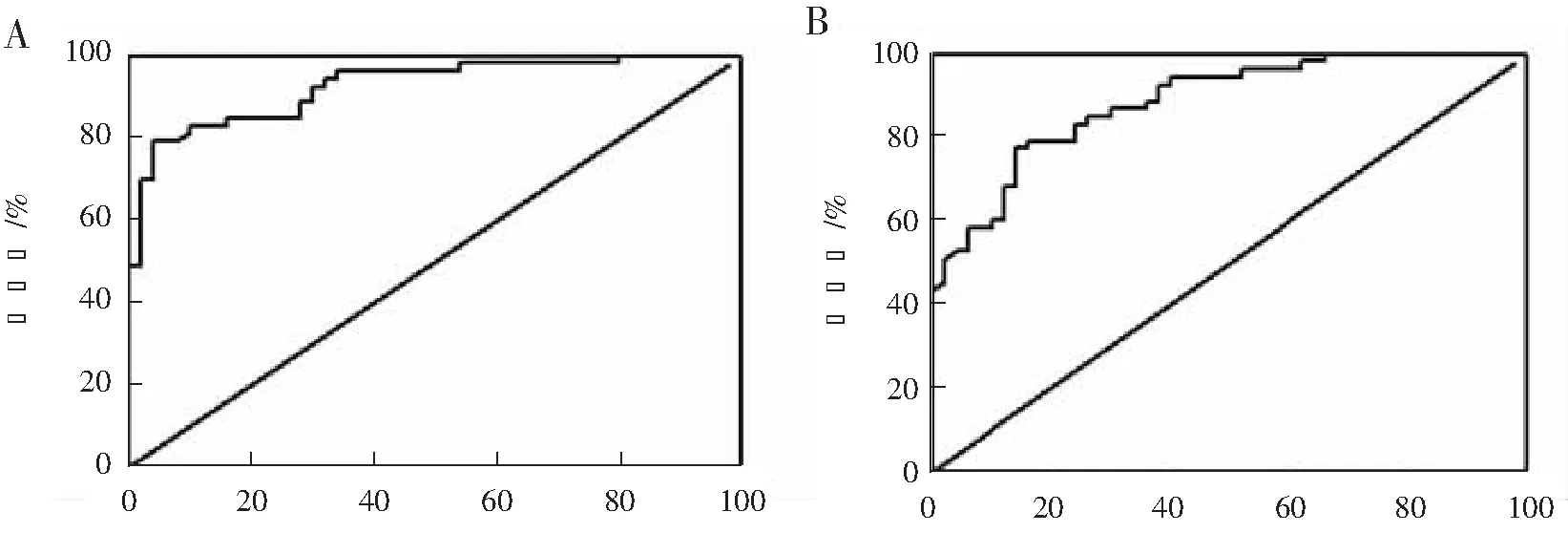
100%-特异性% 100%-特异性%
2.3 GP73与DCP联合检测对HCC的诊断价值
与血清GP73及DCP单项检测相比,二者联合检测能明显提高HCC的诊断灵敏度、特异性、阳性预测值、阴性预测值以及总有效率(均P<0.05);而血清GP73单项检测与血清DCP单项检测各指标之间比较差异均无统计学意义(均P>0.05),见表1。提示GP73与DCP联合检测能明显提高HCC的诊断价值。
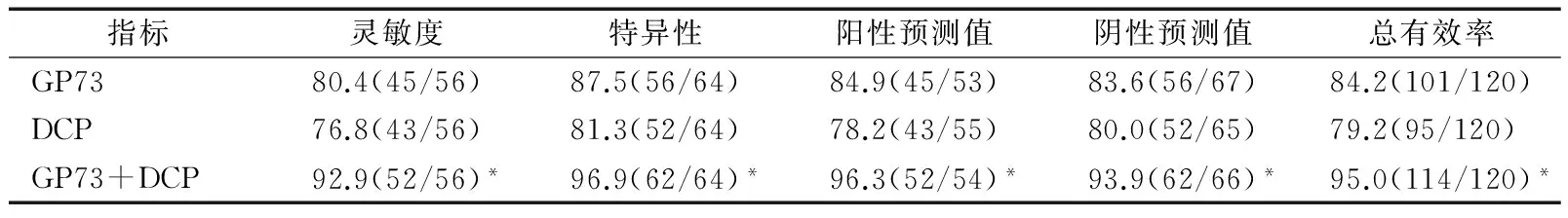
表1 血清GP73与DCP联合检测对HCC的诊断价值 %(n/n)
*P<0.05与单项GP73及DCP检测比较。
3 讨论
由于HCC早期缺乏典型的临床症状,多数患者发现时已到晚期,因此,HCC的早期诊断对患者的预后起着关键作用;而AFP在临床应用有局限性,寻找新的、敏感度和特异度高的HCC血清学诊断标志物已成为各国学者研究的热点[6]。
GP73是一种存在于高尔基体的跨膜蛋白,因其相对分子质量为73 000而得名,其编码基因位于9号染色体,全长3 042 bp,在正常的人体肝组织中,主要在胆管上皮细胞表达,通过膜生成结构域锚定在顺面高尔基体上[7]。有研究[8-9]发现,在HCC患者中GP73表达异常的活跃,其可能机制是:在疾病状态下,GP73从高尔基体顺面膜囊上游离并释放到达细胞表面或细胞外,从而导致HCC患者血清GP73含量异常增加。
DCP又称为维生素K缺乏或拮抗剂Ⅱ诱导蛋白(protein induced by vitamin K absence or antagonist-Ⅱ,PIVKA-Ⅱ)。肝脏合成的凝血酶原是无活性的凝血酶前体,通过维生素K作为辅助因子羧化后转为活化的凝血酶形式。有研究[10-12]表明,HCC患者血清DCP含量异常增高,其可能原因是:肝癌细胞异常摄取维生素K致使局部维生素K缺乏;肝癌细胞过度产生凝血酶原前体,导致不完成羧化概率增加;肝癌细胞内γ-谷氨酸羧化酶活性降低;肝癌细胞内氧化还原循环异常致维生素K利用降低等,从而导致HCC患者DCP合成增加。
本研究显示,HCC组患者血清GP73以及DCP含量均明显高于肝硬化组以及对照组,与Zhou等[6]以及Matsubara等[10]的研究结果相类似,提示血清GP73以及DCP均可作为临床HCC血清学诊断潜在标志物。本研究结果显示,HCC患者GP73与DCP含量之间具有一定相关性(r=0.573,P<0.01),提示在HCC患者中,血清GP73与DCP含量变化的趋势一致,二者联合检测可互为补充,以降低漏诊率。二者ROC曲线分析显示,血清GP73诊断HCC灵敏度(80.4%)、特异性(87.5%)以及曲线下面积(0.925 8)均高于血清DCP诊断HCC相应的灵敏度(76.8%)、特异性(81.3%)以及曲线下面积(0.885 3),但限于本研究所收集的病例数较少,二者各自的临床诊断价值需进一步深入研究。
另外,本研究初步探讨了GP73与DCP联合检测对HCC的诊断价值,血清GP73及DCP联合检测对HCC诊断灵敏度、特异性、阳性预测值、阴性预测值以及总有效率均明显高于血清GP73及DCP单项检测;而二者单项检测各指标之间比较差异均无统计学意义,提示GP73与DCP联合检测能有效地提高HCC诊断的灵敏度,防止漏诊以及误诊,有利于HCC早期诊断,从而提高HCC诊断效率,对HCC的鉴别诊断也有重要的临床意义。对GP73与DCP联合AFP、AFP-L3等其他HCC诊断标志物的临床诊断价值,仍需进一步探讨。
综上所述, GP73与DCP作为新的血清学标志物可用于HCC诊断,且二者联合检测对HCC的早期诊断具有重要的临床价值。但仍需扩大病例,对GP73和DCP在HCC鉴别诊断、病情评估、预后判断、提示复发转移以及抗肿瘤治疗等方面发挥的作用进一步深入探讨。
[1] Hu Bin,Tian Xiaohui,Sun Jie,et al.Evaluation of individual and combined applications of serum biomarkers for diagnosis of hepatocellular carcinoma:a meta-analysis[J].Int J Mol Sci,2013,14(12):23559-23580.
[2] Bertino G,Ardiri A,Malaguarnera M A,et al.Hepatocellualar carcinoma serum markers[J].Semin Oncol,2012,39(4):410-433.
[3] Wang Y,Yang H,Xu H,et al.Golgi protein 73,not Glypican-3,May be a tumor marker complementary to alpha-fetoprotein for hepatocellular carcinoma diagnosis[J].J Gastroenterol Hepatol,2014,29(3):597-602.[4] Tanaka T,Taniguchi T,Sannomiya K,et al.Novel des-γ-carboxy prothrombin in serum for the diagnosis of hepatocellular carcinoma[J].J Gastroenterol Hepatol,2013,28(8):1348-1355.
[5] 中华医学会传染病与寄生虫病学分会、肝病学分会.病毒性肝炎防治方案[J].中华传染病杂志,2001,19(1):56-62.
[6] Zhou L,Liu J,Luo F.Serum tumor markers for detection of hepatocellular carcinoma[J].World J Gastroenterol,2006,12(8):1175-1181.[7] Ba M C,Long H,Tang Y Q,et al.GP73 expression and its significance in the diagnosis of hepatocellular carcinoma:a review[J].Int J Clin Exp Pathol,2012,5(9):874-881.
[8] Zhou Y,Yin X,Ying J,et al.Golgi protein 73 versus alpha-fetoprotein as a biomarker for hepatocellular carcinoma:a diagnostic meta-analysis[J].BMC Cancer,2012,12:17.
[9] Sun Y,Yang H,Mao Y,et al.Increased golgi protein 73 expression in hepatocellular carcinoma tissue correlates with tumor aggression but not survival[J].J Gastroenterol Hepatol,2011,26(7):1207-1212.
[10] Matsubara M,Shiraha H,Kataoka J,et al.Des-γ-carboxyl prothrombin is associated with tumor angiogenesis in hepatocellular carcinoma[J].J Gastroenterol Hepatol,2012,27(10):1602-1608.
[11] Saito M,Seo Y,Yano Y,et al.A high value of serum des-γ-carboxy prothrombin before hepatocellular carcinoma treatment can be associated with long-term liver dysfunction after treatment[J].J Gastroenterol,2012,47(10):1134-1142.[12] Inagaki Y,Xu H L,Hasegawa K,et al.Des-gamma-carboxyprothrombin in patients with hepatocellular carcinoma and liver cirrhosis[J].J Dig Dis,2011,12(6):481-488.
(责任编辑:钟荣梅)
Application of Combined Detection of Serum Golgi Protein 73 and Des-Gamma-Carboxy-Prothrombin in Diagnosis of Hepatocellular Carcinoma
WANG Wen-ding1,MIAO Ya-mei1,JIN Mei2,WANG Zheng-bing3
(1.DepartmentofLaboratoryMedicine,QintongPeople’sHospitalofTaizhou,Taizhou225508,China; 2.DepartmentofLaboratoryMedicine,TaizhouPeople’sHospital,Taizhou225300,China; 3.DepartmentofGeneralSurgery,ClinicalMedicalCollegeofYangzhouUniversity,Yangzhou225001,China)
Objective To investigate the clinical value of combined detection of serum Golgi protein 73 (GP73) and des-gamma-carboxy-prothrombin (DCP) in the diagnosis of hepatocellular carcinoma (HCC).Methods Serum levels of GP73 and DCP were determined by ELISA in 56 patients with HCC (HCC group),34 patients with liver cirrhosis (cirrhosis group) and 30 healthy subjects (control group).Results The serum levels of GP73 and DCP were,respectively,(201.9±92.9)μg·L-1and (115.1±36.1)μg·L-1in HCC group,(76.4±25.5)μg·L-1and (45.6±16.4)μg·L-1in cirrhosis group,and (29.9±15.0)μg·L-1and (23.2±11.4)μg·L-1in control group.Compared with cirrhosis group or control group,serum GP73 and DCP levels significantly increased in HCC group(P<0.01).Spearman’s correlation analysis showed a correlation between GP73 and DCP levels in patients with HCC (r=0.573,P<0.01).The cut-off value,sensitivity,specificity and area under curve (AUC) were,respectively,128.5 μg·L-1,80.4%,87.5% and 0.925 8 for serum GP73 detection,and 73.2 μg·L-1,76.8%,81.3% and 0.885 3 for serum DCP detection.Compared with single detection,combined GP73 and DCP detection significantly increased the sensitivity,specificity,negative predictive value,positive predictive value and total efficiency for the diagnosis of HCC(P<0.05).However,no significant differences in these parameters were found between single GP73 detection and single DCP detection(P>0.05).Conclusion The serum levels of GP73 and DCP obviously increase in patients with HCC.The combined detection of these two markers has important value in the clinical diagnosis and treatment of HCC.
hepatocellular carcinoma; liver cirrhosis; Golgi protein 73; des-gamma-carboxy-prothrombin
2014-09-03
王文鼎(1971—),男,学士,副主任技师,主要从事消化道肿瘤基础与临床的研究。
王正兵,副教授, E-mail:wzhb403@163.com。
R735.7
A
1009-8194(2015)02-0005-04
10.13764/j.cnki.lcsy.2015.02.002