嵌合体真核表达质粒pVAX1- SPG的构建及表达研究
王怡丹, 孙天瞳, 刘建国,3, 柴巧学, 曲云鹏, 于晓光, 白国辉,3, 田 源,3, 韩 琪
(贵州 遵义: 1. 遵义市第一人民医院口腔科, 563002; 2. 遵义医学院口腔医学院口腔内科学教研室, 563099;3. 贵州省高等学校口腔疾病研究特色重点实验室 遵义市口腔疾病研究重点实验室, 563099)
嵌合体真核表达质粒pVAX1- SPG的构建及表达研究
王怡丹1,3, 孙天瞳2, 刘建国2,3, 柴巧学2, 曲云鹏2, 于晓光2, 白国辉2,3, 田 源2,3, 韩 琪2
(贵州 遵义: 1. 遵义市第一人民医院口腔科, 563002; 2. 遵义医学院口腔医学院口腔内科学教研室, 563099;3. 贵州省高等学校口腔疾病研究特色重点实验室 遵义市口腔疾病研究重点实验室, 563099)
目的: 构建含变异链球菌表面蛋白SpaP的P区编码基因spap- P和葡聚糖结合蛋白GbpA的葡聚糖结合区编码基因gbd的嵌合体真核表达质粒pVAX1- SPG,并观察其在哺乳动物细胞293T中的表达。方法:通过基因工程技术构建嵌合体真核表达质粒pVAX1- SPG,并采用脂质体转染法将其转染至293T细胞中;然后分别采用免疫组化SABC法和Western- blot检测嵌合蛋白SpaP/P- GBD在真核细胞中的表达。结果:重组真核表达质粒pVAX1- SPG经酶切、测序鉴定证实,其所携带的外源基因片段为2.4 kb的目的基因片段,序列同源性为99%;免疫组化染色结果显示,经pVAX1- SPG转染的293T细胞胞质呈棕褐色染色;Western- blot检测结果显示,分子量为72 kDa的嵌合蛋白SpaP/P- GBD能够被正确表达。结论: 构建成功的嵌合体真核表达质粒pVAX1- SPG能在真核细胞293T中正确表达目的蛋白。
变异链球菌; 表面蛋白抗原; 葡聚糖结合蛋白; 哺乳动物细胞; 真核表达
[Chinese Journal of Conservative Dentistry,2015,25(11):645]
龋病是口腔的常见病和多发病,其主要致病菌为变异链球菌。变异链球菌的主要致龋作用是其对牙面的粘附、聚集、产酸和耐酸。表面蛋白(surfaceprotein antigen,SpaP)又被不同学者命名为PAc、P1和AgI/Ⅱ 等,是变异链球菌的主要粘附素(adhesins)。有研究表明,SpaP在介导变异链球菌对牙面的蔗糖非依赖性粘附中起着关键作用,被视为变异链球菌族细菌的主要毒力因子之一[1]。葡聚糖结合蛋白(glucan bind protein,Gbp)是变异链球菌菌细胞表面的葡聚糖结合受体,其在变异链球菌参与的蔗糖依赖性粘附中起着关键的作用。目前已有4种不同的Gbp被相继发现,分别为GbpA、GbpB、GbpC和GbpD。GbpA的葡聚糖结合区(glucan- binding domain,GBD)被认为是介导变异链球菌粘附的重要功能区,与牙菌斑生物膜的形成关系密切[2]。本研究拟构建含变异链球菌表面蛋白SpaP的功能区P区编码基因spap- P和葡聚糖结合蛋白GbpA的功能区葡聚糖结合区编码基因gbd的嵌合体真核表达质粒pVAX1- SPG,并观察其在真核细胞293T中的表达,以期为下一步嵌合体基因防龋疫苗pVAX1- SPG的动物实验研究奠定基础。
1 材料和方法
1.1 材料
1.1.1 主要试剂
PrimeSTAR® HS DNA Polymerase高保真DNA聚合酶、In- Fusion Advantage PCR Cloning Kit连接试剂盒、DNA分子量Marker λ- Hind Ⅲdigest、DNA分子量Marker DL2000(大连宝生物公司);质粒pVAX1和lipofectamine 2000(Invitrogen, 美国);GoldViewTM核酸染料(北京赛百盛);DMEM培养基(Sigma, 美国);胎牛血清(Hyclone,美国);SABC试剂盒(武汉博士德);质粒提取试剂盒(北京TIANGEN);抗SpaP的IgG抗体和抗GBD的 IgG抗体(本课题组前期制备);生物素标记的羊抗兔IgG(Amresco,美国)。
1.1.2 质粒及细胞株
含基因spap- P和gbd的重组质粒pVAX1-SpaP/P、pVAX1- GbpA/GBD(本课题组前期构建)[3-4];大肠杆菌JM109(中科院成都生物所马欣荣博士惠赠);293T细胞(中科院上海细胞所)。
1.2 方法
1.2.1 目的质粒克隆
分别取重组质粒pVAX1- SpaP/P、pVAX1- GbpA/GBD,经高频转化法转化至大肠杆菌的JM109细胞后,采用质粒提取试剂盒提取质粒,并进行双酶切鉴定。
1.2.2 目的片段的扩增
1.2.2.1 引物设计
根据GenBank中报道的spap- P和gbd序列设计引物,并交大连宝生物公司进行引物合成(表1)。

表1 PCR引物序列
在spap-P上游引物中引入Kpn I酶切位点GGTACC和Kosak序列ACCACCACCATG,在spap-P下游引物的互补序列和gbd上游引物上设计相同的15个碱基序列GATAATCCAAGAGAA,在gbd下游引物增加EcoR I的酶切位点GAATTC和终止密码子TAG。
1.2.2.2 PCR 扩增目的片段
PCR 反应体系共50 mL,分别为:质粒pVAX1-SpaP/P、pVAX1- GbpA/GBD各0.5 μL,spap- P或gbd上游引物(20 pmol/μL)0.5 μL,spap- P或gbd下游引物(20 pmol/μL)0.5 μL,dNTP Mixture(各2.5 mmol/L)4 μL,5×PrimeSTAR Buffer(Mg2-plus)10 μL,PrimeSTAR HS DNA Polymerase(2.5 U/μL)0.5 μL,ddH2O 33.5 μL。反应条件为(98 ℃ 10 s,55 ℃ 15 s,72 ℃ 2 min)×30循环,72 ℃延伸10 min。
1.2.3 重组质粒pVAX1- SPG的构建及鉴定
严格按相关试剂盒操作说明纯化回收PCR产物,并用内切酶Kpn I和EcoR I 对载体pVAX1进行酶切和回收。然后用In- Fusion Advantage PCR Cloning连接试剂盒对上述酶切回收的产物进行连接,连接体系共10 μL, 分别为:PCR扩增产物spap- P 1μL,PCR扩增产物gbd 1μL,载体质粒pVAX1 1μL,5×In- Fusion Reaction Buffer 2μL,In- Fusion Enzyme 1μL,ddH2O 4 μL。连接条件为37 ℃ 15 min,50 ℃ 15 min。上述连接完成后,取1 μL连接产物转化JM109感受态细胞。并将转化后的JM109 涂布于含20 μg/mL 卡那霉素的LB抗性筛选平板上,置于37 ℃条件下进行培养。培养16 h后挑取单个菌落,再置于37 ℃条件下振荡培养过夜,并进行质粒提取。所提取的质粒通过Kpn I 和EcoR I 双酶切进行鉴定后,即得到与目的基因大小相符的条带,然后将其送宝生物技术公司进行测序鉴定。
1.2.4 重组质粒pVAX1- SPG的表达鉴定
1.2.4.1 脂质体介导pVAX1- SPG瞬时转染293T细胞
取293T细胞常规复苏培养后,用DMEM制成密度1.0×105/mL的细胞悬液,并将其接种于6孔培养板内预先放置的载玻片上(每孔2 mL);常规条件下培养至24 h细胞汇合达80%进入对数生长期时,利用 lipofectamine 2000 分别将8 μg重组质粒pVAX1- SPG和8 μg pVAX1空载体质粒转染至实验组和对照组293T细胞中。所有操作均严格按SABC试剂盒说明。
1.2.4.2 免疫组化染色观察重组质粒pVAX1-SPG在细胞内的表达
细胞转染48 h后,采用免疫组化SABC法检测重组质粒pVAX1- SPG在293T细胞内的表达情况。具体方法如下:分别取实验组和对照组细胞爬片,用40 g/L多聚甲醛固定后,PBS漂洗5 min×3次;滴加30 mL/L过氧化氢液室温孵育10 min;PBS漂洗5 min×3次,滴加50 g/L BSA封闭液37 ℃ 封闭30 min;PBS漂洗5 min×3次,滴加抗SpaP或抗GBD的 IgG抗体(1 ∶150)4 ℃孵育过夜;37 ℃复温30 min后PBS漂洗5 min×3次,滴加羊抗兔IgG抗体,37 ℃孵育30 min;PBS漂洗5 min×3次,滴加SABC复合物37 ℃孵育30 min;PBS漂洗5 min×3次,DAB显色、苏木素复染;梯度乙醇脱水、二甲苯透明、中性树胶封片,光学显微镜下观察染色结果并拍照。
1.2.4.3 Western- blot检测嵌合蛋白SpaP/P-GBD在细胞中的表达
转染48 h后,分别离心收集实验组和对照组的293T细胞,并经蛋白裂解液裂解后提取其总蛋白。所提取的蛋白样品经120 g/L的SDS- PAGE 胶进行分离后,转移至NC 膜上,并用含100 g/L BSA 的PBS进行封闭;然后再分别用稀释的一抗和酶标记的IgG二抗进行免疫标记。标记结束后,滴加ECL发光试剂进行激发,并用凝胶成像系统进行检测。同时取实验组细胞总蛋白的SDS- PAGE 胶进行考马斯亮蓝染色观察。
2 结果
2.1 重组质粒pVAX1- SpaP/P、pVAX1- GbpA/GBD的酶切鉴定
本课题组前期构建的重组质粒pVAX1- SpaP/P经EcoR I和BamH I双酶切后,可得到大小约3.0 kb 和1.2 kb的片段(图1);pVAX1- GbpA/GBD经EcoR I和Xba I双酶切后,亦可得到大小约3.0 kb和1.2 kb的片段(图2),均与目的片段大小相符。


图1 pVAX1-SpaP/P酶切产物 图2 pVAX1-GbpA/GBD酶切产物
2.2 PCR扩增产物胶回收电泳结果
以重组质粒pVAX1- SpaP/P、pVAX1- GbpA/GBD为模板进行PCR扩增后,分别扩增出了1.2 kb的spap- P片段和1.2 kb的gbd片段,其分子量均与预计的大小相同(图3)。
2.3 重组质粒pVAX1- SPG的酶切鉴定和测序分析
重组质粒pVAX1- SPG经Kpn I和EcoR I双酶切后,可得到大小约3.0 kb和2.4 kb大小的片段(图4);委托宝生物工程公司使用T7、BGHrev进行测序分析,该序列核苷酸同源性与Genbank数据库中同源性达到99%,表明目的基因顺利嵌合到载体pVAX1中,成功构建出重组真核表达质粒pVAX1- SPG。


图3 目的基因spap-P,gbd PCR结果 图4 pVAX1-SPG酶切产物
2.4 重组质粒pVAX1- SPG在真核细胞中的表达鉴定
2.4.1 免疫染色结果
SABC法瞬时转染293T细胞48 h免疫组化染色结果显示,重组质粒pVAX1- SPG转染的细胞胞质中呈棕褐色染色; pVAX1空载体质粒转染的细胞胞质无着色(图5~6)。提示,将pVAX1- SPG转染入293T细胞后,在细胞内表达的蛋白能够与抗体特异性结合,具有抗原性。

图5 空载体质粒pVAX1转染的293T细胞免疫组化结果(×400) 图6 重组质粒pVAX1-SPG转染的293T细胞免疫组化结果(×400)
2.4.2 Western- blot检测结果
转染48 h后,分别提取实验组和对照组细胞总蛋白进行Western- blotting分析显示,转染pVAX1- SPG的实验组中,其表达产物嵌合蛋白SpaP/P- GBD能与SpaP和GBD发生对应的抗体反应,在72 kDa处可见阳性条带;而转染空载体pVAX1的对照组中未出现特异性条带(图7)。以上结果说明,表达的外源蛋白具有免疫活性结构,构建的质粒pVAX1- SPG可以在293T细胞中成功表达。
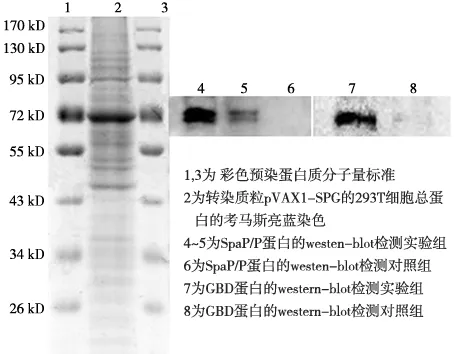
图7 细胞总蛋白的考马斯亮蓝染色和表达产物的Western- blot分析
3 讨论
变异链球菌是目前公认的重要致龋菌之一,其表面抗原SpaP可介导其对牙面的非蔗糖依赖性粘附,是目前研究较多的毒力因子。变异链球菌表面蛋白SpaP蛋白分子中间存在2~3个由39个氨基酸残基组成的串联重复序列,该序列富含脯氨酸,呈伸展状态的β片层结构,同时还富含T、B细胞表位,称之为P区。P区能够诱发机体的免疫应答,是理想的防龋疫苗基因选择区。
变异链球菌能合成多种胞外多糖,其中Gbp在变异链球菌参与的蔗糖依赖性口腔菌斑生物膜形成中起着关键的作用。多数研究表明,GbpA的GBD是介导变异链球菌粘附的重要功能区,有较好的免疫原性。吴补领等[5]报道,将GbpA的GBD蛋白经皮下注射免疫SD大鼠后,能够诱导抗GBD抗体的产生。苏凌云等报道[6],将构建的真核表达质粒pcDNA3.1- GBD经颌下腺区注射免疫SD大鼠后,可使 SD大鼠的龋病发生率和患龋程度明显降低。
嵌合体防龋疫苗是利用基因工程技术将两种或两种以上的基因或其功能片断连接起来,并通过直接免疫机体或通过转化大肠杆菌、植物等宿主后,再经诱导使其表达,以获取具有抗原成分的融合蛋白;然后再用该蛋白免疫机体,即可诱导机体产生针对抗原的保护性免疫。这两个或多个基因可以是具有协同效用的抗原基因或片断,也可以是抗原基因和免疫佐剂的编码基因,均可通过连接而增强疫苗的效能[7-8]。目前嵌合体防龋疫苗常用的候选基因主要有:①变异链球菌族细菌表面蛋白及其功能区编码基因,虽然表面蛋白的命名有所不同,但其核苷酸序列和蛋白序列具有高度的同源性,且具有较好的免疫原性[7];有学者通过将变异链球菌表面蛋白PAc的A区、P区及葡糖基转移酶GTF- I的编码葡聚糖结合区GLU的基因序列克隆到真核载体pCI后,构建了嵌合表达载体pGLUA- P,并证实该重组质粒能够在原核、真核细胞中表达正确的GLU- A- P融合蛋白[9-10]; ②葡糖基转移酶及其功能区编码基因,有研究表明,葡糖基转移酶GTF- I的催化活性区CAT的抗体能抑制变异链球菌合成水溶性和水不溶性葡聚糖;葡聚糖结合区GLu含有重要的抗原决定簇,能抑制GTF- I的作用[3,11]。孙静华[12-13]和Niu[14]等研制了包含表兄链球菌OMZl76GTF—I的CAT区和变异链球菌PAc、GLU基因序列的复合防龋DNA疫苗,将重组质粒及对照质粒分别经股四头肌注射和鼻腔滴注免疫BALB/c小鼠后发现,实验组小鼠的血清和唾液中的抗PAc、抗GLU、抗CAT抗体水平均显著高于空载体对照组。
嵌合体防龋疫苗常用的免疫佐剂主要有:霍乱毒素(cholera toxin,CT)及其亚单位CTB、不耐热肠毒素(heat- labile enterotoxin, LT) 及其B亚单位 (LTB)和CpG免疫刺激序列、一些细胞因子和沙门氏菌鞭毛蛋白等;这些佐剂均能有效提高抗原的免疫原性,且可降低免疫耐受的发生[15-16],其编码基因不仅能通过与抗原基因连接而表达融合蛋白,同时还能表达兼具两者活性的产物。杨小青等[17]对编码PAcA的DNA片段进行扩增后,通过T- A克隆技术将目的DNA 片段克隆于载体pMD18- T,并进一步亚克隆于含有CpG免疫刺激序列的真核表达载体pcDNA3.1中,从而成功构建了含有免疫刺激序列且可防止变异链球菌在牙面粘附的DNA疫苗pcDNA3.1- PAcA。Shi等[18]将鞭毛素蛋白佐剂和抗原PAc融合成功构建了一个既包含黏膜佐剂又包含疫苗目标抗原的重组蛋白,进一步研究发现,用该蛋白经鼻腔黏膜免疫可诱导产生高效的特异抗体应答,尤其是口腔特异IgA抗体应答。
防龋疫苗的研究已有70余年的历史。我国在防龋基因疫苗领域的研究已处于国际先进水平,且已研制出了针对变异链球菌单个或多个毒力因子的基因疫苗,并经动物实验证实均有较好的防龋效果,其中以针对两种毒力因子的嵌合体基因疫苗的保护作用更好[19-20]。尽管如此,嵌合体防龋基因疫苗的研究仍存在以下一些问题[7-8]:①不同的变异链球菌粘附素有所不同,与之反应的配体也不同(不同的配体在蛋白分子中会有相应的粘结位点),当粘附素与不同状态的配体结合时,会产生不同的生物学意义(与附着在固相表面的配体结合会促进变异链球菌在牙齿表面的粘附,而与液相配体结合则会促进变异链球菌凝集,有利于对致龋菌的非免疫性清除);②基因重组多肽的表达宿主、纯化方式不同,会导致其生物学性能的改变。③以融合蛋白形式制备的多肽在空间结构和生物学特性上可能会受到相互之间不同程度的影响,这也是不同研究者用同一抗原的相同免疫活性区段进行多肽研究时,所得到的结论不同甚至完全相反的原因之一;④多肽粘附能力可能与其链的长度有关,过短的肽链因不能提供充足的结合位点,往往观察不到粘附作用;⑤蛋白、酶等抗原分子的二级结构和三级结构仍不确定,通过基因工程技术制备的用于粘附相关研究的基因工程多肽的空间结构与其蛋白的天然分子立体结构存在一定差异,而且这些多肽的结构也不甚清楚。
本研究通过将变异链球菌的两个重要毒力因子SpaP的P区编码基因spap- P和GbpA的GBD编码基因gbd进行嵌合,构建了嵌合体真核表达质粒pVAX1- SPG;经相关实验并证实,该重组质粒能在真核细胞中正确表达。从而为其后续的免疫原性研究,以及单个基因与嵌合基因免疫效果的对比研究奠定了基础。
[1]Kahashi N, Sasakawa C, Yoshikawa M,etal. Molecular characterization of a surface protein antigen gene from serotype C Streptococcus mutans, implicated in dental caries[J].MolecularMicrobiology, 1989,3(5):673-678.
[2]许庆安.防龋疫苗[J]. 中国实用口腔科杂志,2012,5(10):5921-594.
[3]白国辉,刘建国,柴巧学,等.变异链球菌表面蛋白spap P区真核表达质粒的构建及表达[J]. 中国组织工程研究与临床康复, 2010,14(15):2765-2768.
[4]韩琪,刘建国,曲云鹏,等. 变异链球菌葡聚糖结合蛋白真核表达质粒的构建以及在哺乳动物细胞中的表达[J]. 牙体牙髓牙周病学杂志, 2010,20(6):310-313,340.
[5]吴补领,苏凌云,范继红,等. 变异链球菌GbpA的GBD融合蛋白诱导SD大鼠产生免疫应答[J]. 中华微生物学和免疫学杂志, 2003,23(6):450-452.
[6]苏凌云,吴补领,董文波. 变异链球菌GbpA的GBD基因疫苗动物免疫防龋研究[J]. 临床口腔医学杂志,2006, 22(9):526-528.
[7]樊明文. 防龋疫苗研究的现状和思考[J]. 中华口腔医学杂志, 2009,44(2):65-68.
[8]孙天瞳,吴志刚,刘建国. 基因工程嵌合体防龋疫苗的研究现状[J]. 口腔医学研究,2014,30(1):89-92.
[9]Fan MW, Bian Z, PengZX,etal. A DNA VaccineEncodinga Cell- surface ProteinAntigen of Streptococcus mutans ProtectsGnotobioticRats from Caries[J].JDentRes,2002,81(11):784-787.
[10]贾荣,樊明文,边专, 等. 融合防龋DNA疫苗pGJA- P的构建及其细胞表达研究[J]. 中华口腔医学杂志, 2002,17(6):456-459.
[11]GuoJH, JiaR, FanMW. Construction and Immunogenic Characterization of a Fusion Anti- caries DNA vaccine against PAc and Glucosyltransferase I of Streptococcus mutans[J].JDentRes, 2004,83(3):266-270.
[12]Sun J,Yang X, Xu QA,etal.Protective efficacy of two new anti-caries DNA vaccines[J].Vaccine, 2009,27(52):7459-7466.
[13]孙静华,牛玉梅,樊明文,等.变异链球菌、表兄链球菌复合防龋DNA疫苗的研制[J]. 中华医学杂志,2009,89(32): 2286-2291.
[14]Niu Y,Sun J,Fan M,etal.Construction of a new fusion anti-caries DNA vaccine[J].JDentRes, 2009,88(5):455-460.
[15]Isaka M,Yasuda Y,Taniguchi T,etal. Mucosal and systemic antibody responses against an acellular pertussis vaccine in mice after intranasal co- administration with recombinant cholera toxin B subunit as an adjuvant[J].Vaccine,2003,21(11-12):1165-1173.
[16]Huy NX, Yang MS, Kim TG. Expression of a cholera toxin B subunit- neutralizing epitopeof the porcine epidemic diarrhea virus fusion genein transgenic lettuce (Lactuca sativa L.)[J].MolBiotechnol, 2011,48:201-209.
[17]杨小青, 姜广水, 张兆莲,等. 含变异链球菌PAcA基因的真核表达质粒pcDNA3.1- PAcA的构建与鉴定[J]. 山东大学学报(医学版),2002,40(4):289-291.
[18]Shi W, Liu F, Yang J,etal. Flagellinenhances saliva IgA response and protection of anti- caries DNA vaccine[J].JDentRes, 2012,91(10):941-947.
[19]周学东.我国龋病研究的现状与思考[J]. 中华口腔医学杂志,2011,46(12):710-713.
[20]SmithDJ. Prospects in Caries VaccineDevelopment[J].JDentRes, 2012,91(3):225-226.
《牙体牙髓牙周病学杂志》征订
《牙体牙髓牙周病学杂志》(月刊)是国内唯一的口腔内科学专业杂志,由第四军医大学口腔医学院主办,为中国科技核心期刊,入选北京大学《中文核心期刊要目总揽》。被美国化学文摘(CA)、美国《剑桥科学文摘(自然科学版)》(CSA)和波兰《哥白尼索引》(IC)、英国《国际农业与生物科学研究中心》(CABI)、乌利希国际期刊指南(Ulrich's)等国际检索系统收录。
本刊设有基础研究、临床研究、流行病学、治疗与应用、短篇报道、病案报道、综述、讲座、技术革新等栏目,内容包括龋病学、牙体修复学、牙髓病学、牙周病学以及儿童牙医学、老年牙医学、牙病预防学等许多领域。
订阅:全国各地邮局(所),邮发代号52-128(也可直接与本刊编辑部联系订阅,电话:029-84776082)
定价:每期8.00元,全年96.00元
Construction and expression of recombinant eukaryotic plasmid pVAX1- SPG
WANG Yi- dan*, SUN Tian- tong, LIU Jian- guo, CHAI Qiao- xue,QU Yun- peng, YU Xiao- guang, BAI Guo- hui, Tian Yuan, Han Qi
(*TheFirstPeople′sHospitalofZunyiGuizhou,Zunyi563002,China)
AIM: : To construct the eukaryotic plasmid including surface protein antigen (SpaP) P domain (SpaP- P) and glucan binding domain (GBD) of glucan binding protein A (GbpA) ofStreptococcusmutans, and to observe the expression of recombinant plasmid pVAX1- SPG in mammalian cells 293T. METHODS: The eukaryotic plasmid pVAX1-SPG carrying encoding gene of GBD of GbpA and SpaP- P of SpaP ofStreptococcusmutanswas constructed by recombinant DNA technology. The eukaryotic plasmid was transfected into 293T cells by lipofectamine reagent. The transient expression of the protein in 293T cells was detected by immunochemistry technique and Western-blot. RESULTS: The recombinant plasmidp VAX1- SPG was obtained and identified by restriction endonuclease analysis. Immunohistological staining showed that positive expression of SpaP/P-GBD was detected in the plasma of 293T cells transfected with recombinant plasmid pVAX1-SPG. Western-blot confirmed the expression of the fusion protein SpaP/P- GBD in 293T cells. CONCLUSION: The eukaryotic plasmid pVAX1-SPG can be constructed. The target protein SpaP/P-GBD can be expressed correctively in 293T cells.
streptococcus mutans; surfaceprotein antigen; glucan- binding protein; mammalian cells; eukaryoticexpression
2014-10-11;
2015-03-20
贵州省科技创新人才团队建设项目[黔科合人才团队(2013)4026] 贵州省高等学校重点学科建设项目(SZXK-201207-04) 省市科技合作专项资金项目[省市科合(2014)41号] 贵州省高等学校特色重点实验室建设项目[黔教合KY字(2013)109]
王怡丹(1971-),女,汉族,贵州遵义人。硕士,副主任医师
刘建国, E-mail:13087891001@163.com
R780.2
A
1005-2593(2015)11-0645-06
10.15956/j.cnki.chin.j.conserv.dent.2015.11.002

