大承气汤泻下作用对内毒素血症大鼠肠道菌的影响
谢 斌,汪德超,陈 乔
(1.江西中医药大学,江西 南昌 330006;2.韶关市中医院,广东 韶关 512000)
大承气汤泻下作用对内毒素血症大鼠肠道菌的影响
谢 斌1,汪德超2,陈 乔1
(1.江西中医药大学,江西 南昌 330006;2.韶关市中医院,广东 韶关 512000)
目的:探索大承气汤泻下作用对内毒素血症大鼠肠道乳酸杆菌和大肠杆菌的影响。方法:将SD大鼠盲肠结扎穿孔造成内毒素血症模型,术后8h分别予以大承气汤高(5g/kg·q12h)、中(2.5g/kg·q12h)、低(1.25g/kg·q12h)剂量灌胃给药,每12h 给药1次,共5次。以实时荧光定量PCR检测大鼠造模前及造模后8h(给药前)、2天、7天肠道大肠杆菌及乳酸杆菌数量。结果:造模后8h,高、中、低剂量大鼠大肠杆菌数量LOG值增加大于3;造模后2天,高、中剂量大肠杆菌数量LOG值减少,乳酸杆菌数量LOG值增加;造模后7天,高、中剂量乳酸杆菌、大肠杆菌数量LOG值恢复至造模前水平。结论:大承气汤泻下作用治疗内毒素血症的微生态机理可能与促进乳酸杆菌增殖并抑制大肠杆菌生长有关。
大承气汤;内毒素血症;乳酸杆菌;大肠杆菌
内毒素血症(endotoxemia,ETM)属阳明腑实证,其发病机理为肠道G-菌过度增殖,内毒素入血[1],中医治以通腑泻热,方用大承气汤功效卓越。研究表明,大承气汤泻热通腑能驱除肠道G-菌并促进内毒素排出[2],然而,现代微生态学理论认为,治疗疾病是使正常有益菌群充分发挥生物拮抗作用,从而抑制或驱除致病菌,但该方泻下作用对ETM肠道有益菌的影响尚不清楚,阐明泻下对肠道菌的影响对理解大承气汤治疗ETM的作用机制具有重要意义。
本文选取典型有益菌乳酸杆菌及条件致病菌大肠杆菌为代表,以QPCR(Real-time Quantitative PCR Detecting System)检测大承气汤用药前后ETM大鼠肠道两种细菌数量的动态变化,从微生态菌群相互拮抗的角度探索大承气汤治疗ETM的通腑泻热作用机制。
1 材料
1.1 菌种
乳酸杆菌购自中国普通微生物菌种保藏管理中心,编号CGMCC1.1480,大肠杆菌购自中国医学细菌保藏管理中心,编号CMCC44102。
1.2 动物
清洁级SD大鼠,雌雄各半,体重(200±20)g,购自湖南斯莱克曼达实验动物有限公司,批号:SCXK(湘)2011-0003。
1.3 药物
大承气汤:生大黄12g(后下)、芒硝9g(冲)、厚朴15g、枳实12g,购自江西省中医院。
1.4 试剂及仪器
EZNA stool DNA Kit,OMEGA,lot:00D40 15010 00H30 L017;QPCR Kit,TaKaRa,lot:BK3305;DU730型核酸蛋白分析仪,美国贝克曼;StepOne Real-Time PCR System,Applied Biosystems。
2 方法
2.1 药物制备
取枳实饮片12g,厚朴饮片15g,加10倍量水360mL浸泡30min后,沸水煎煮20min,滤液热浸12g大黄10min后过滤,厚朴和枳实药渣再加8倍量水300mL左右,沸水煎煮20min,滤液再热浸大黄10min后过滤,合并两次大黄滤液,趁热加入芒硝9g,搅拌使溶解后,低温浓缩至48mL,以上中药制成浓度为1g生药/mL的药液,置于4℃冰箱内保存备用。
2.2 造模
采用目前国际公认的盲肠结扎穿孔术(CLP)所致大鼠ETM模型[3]。
2.3 给药
大承气汤高、中、低剂量给药剂量分别为5g/kg·q12h、2.5g/kg·q12h、1.25g/kg·q12h,药量计算方法参考陈奇主编《中药药理学》,计算公式为:B种动物的剂量(mg/kg)=W×A种动物的剂量(mg/kg),每12h给药1次,共5次。
2.4 样本采集
以无菌镊子采取大鼠造模前、造模后8h(给药前)、造模后2天、造模后7天时新鲜粪便3粒,贮于无菌1.5mLEP管,记录时间、组别,并立即于-20℃冰箱保存。
2.5 引物
引用国外文献设计引物序列:乳酸杆菌(Lactobacillus group,341bp)[4-5],F:5'-AGCAGTAGGGAATCTTCCA-3',R:5'-CACCGCTACACATGGAG-3';大肠杆菌(Escherichia coli subgroup 340bp)[6],F:5'-GTTAATACCTTTGCTCATTGA-3',R:5'-ACCAGGGTATCTAAT CCTGTT-3',英潍捷基(上海)贸易公司生产。
2.6 标准曲线绘制
大肠杆菌经复苏、传代3次,采用涂板法计算细菌浓度为5.67×109个/mL。取细菌1mL,细菌基因组提取试剂盒提取DNA,将得到的DNA样品用无菌TE稀释至1/10倍,DU730型核酸蛋白分析仪测定A260、A280(DNA质量应满足A260/280≈1.7~1.9),同时根据细菌基因组大小计算相应模板数。将满足纯度质量要求的DNA样品用无菌TE连续10倍梯度稀释至10-9,制成系列标准品,将其作为阳性模板进行实时荧光定量PCR反应。
根据文献[7],Ct值(每个反应体系中荧光信号到达设定域值时经历的循环数)与该模板起始拷贝数的对数存在线性关系,起始拷贝数的对数与Ct值成反比,以阳性模板数的对数为横坐标,以获取的Ct值为纵坐标即可作出标准曲线。
2.7 粪便细菌DNA提取
按粪便细菌提取试剂盒说明提取细菌DNA。
2.8 QPCR条件优化
以样本细菌DNA为模板,普通PCR扩增,扩增条件为95℃预变性5min;95℃,30s;61℃,30s;72℃,10s;35个循环后,72℃延伸10min。以1.5%琼脂糖凝胶电泳分离鉴定PCR产物,与Marker条带对比,确定DNA片段为目的片段。
2.9 肠道菌DNA的QPCR
按试剂盒说明,采用20μL反应体系、两步法PCR反应程序,每个样本重复检测3次,加入SYBR Premix Ex TapⅡ 10μL,Forward Primer 0.8μL,Reverse Primer 0.8μL,Rox Reference Dye(50×) 0.4μL, DNA模板2μL,ddH2O6μL,扩增条件为95℃预变性30s;95℃,5s;61℃,34s;72℃,1min;35个循环。反应结束后记录相应Ct值。
2.10 数据处理
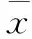
3 结果
3.1 大肠杆菌(CMCC44102)标准曲线
大肠杆菌(CMCC44102)DNA经QPCR获取建立标准曲线数据,见表1。

表1 大肠杆菌(CMCC44102)标准曲线数据
由此数据,用Excel作出标准曲线及方程,R2=0.999 1,见图1。
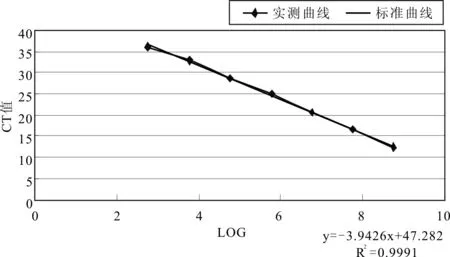
图1 大肠杆菌(CMCC44102)DNA经QPCR建立的标准曲线
3.2 大鼠肠道菌数量的常用对数值
研究结果表明:造模后8h(给药前),大肠杆菌数量增加显著,乳酸杆菌数量减少;造模后2d,高、中剂量大鼠肠道内过度增殖的大肠杆菌明显减少,乳酸杆菌数量迅速增加;造模后7d时,高、中剂量大鼠乳酸杆菌数量继续增殖,而大肠杆菌数量基本恢复至造模前水平。见表2。

表2 大鼠肠道菌数量的常用对数值 (±s)
4 讨论
中医理论认为,ETM属外感病极期,其病机为腑实内结、热甚阴竭,为典型的阳明腑实证,而大承气汤是《伤寒论》治疗阳明腑实证的经典方剂,临床用治ETM功效卓著。研究证实,该方具有泻热通腑、驱除肠道G-菌、促进内毒素排出的药理作用[2],这是本研究选用大承气汤的理论基础。
内毒素的主要化学成分为脂多糖(lipopolysaccharide/endotoxin,LPS),是G-菌(如大肠杆菌、伤寒杆菌、结核杆菌、痢疾杆菌)细胞壁的主要成分,而ETM发病的主要机理是肠道G-菌过度增殖,死亡细菌释放内毒素入血[1]。
乳酸杆菌是典型有益菌,现代微生态学理论认为,该菌能拮抗条件致病菌的生长,具有维护机体健康和调节免疫功能[8],抑制致病性有害菌和外源性细菌的生长,阻止有害菌入侵,纠正肠道菌群失调,重建肠道微生态的作用[9]。
因此,除了泻下驱除过度繁殖的G-菌外,促进肠道有益菌增殖,以拮抗G-菌增殖,恢复肠道菌群的平衡是治疗ETM的关键。故本文拟引入现代微生态学理论,选取乳酸杆菌及大肠杆菌为代表,从肠道菌的调节角度探索大承气汤泻下治疗ETM的作用机制。然而,肠道微生态系统大约包含有15 000~36 000个菌种[10],如何正确估算研究对象的数量,是本研究所面临的主要技术难题。
分子生物学的发展,催生了QPCR技术,该技术具有将极微量基因无限扩增并精确计算原始DNA模板数量的优点,为本课题准确估算肠道两种细菌数量提供了有力的技术保障。
研究结果表明,大承气汤泻下后肠道菌的动态变化分为三个阶段: 第一阶段,大肠杆菌显著增加,这是大鼠出现ETM的主要原因;乳酸杆菌数量远不及大肠杆菌数量,其原因可能与大肠杆菌过度增殖,拮抗了乳酸杆菌的生长。第二阶段,大承气汤泻下作用是大肠杆菌减少的主要原因,乳酸杆菌的增殖则基于大承气汤荡涤肠道糟粕为其提供了“洁净”的生长空间,乳酸杆菌为拮抗大肠杆菌的生长而“被动”增殖也可能是其原因之一。第三阶段,乳酸杆菌增殖占据优势,与其具有拮抗条件致病菌对肠道的入侵和定植、维持肠道菌群微生态平衡的作用有关。
泻下前后肠道菌的动态变化表明,大承气汤治疗ETM的作用不仅是泻下通腑以驱除G-菌,减少肠道内毒素的吸收,同时,其泻下通腑以荡涤肠道环境,客观上也为有益菌的增殖及拮抗条件致病菌的生长创造了条件,这可能是大承气汤泻下治疗ETM起效的机制之一。该方对ETM肠道其它菌群有何影响尚有待深入研究。
[1] 杨志寅.诊断学大辞典[M].北京:华夏出版社,2004.
[2] 周鹃,耿耘.大承气汤防治内毒素血症的研究概况[J].时珍国医国药,2009,20(9):2127-2128.
[3] 罗正曜.休克学[M].天津:天津科技出版社,2001:660-665.
[4] WALTER J, HERTEL C, TANNOCK GW, et al. Detection of Lactobacillus, Pediococcus, Leuconostoc, and Weissella species in human feces by using group-specific PCR primers and denaturing gradient gelelectrophoresis[J].Applied and Environmental Microbiology,2001,67(6):2578-2585.
[5] HEILIG HG, ZOETENDAL EG,VAUGHAN EE,et al. Molecular diversity of Lactobacillus spp.and other lactic acid bacteria in the human intestine as determined by specific amplification of 16S ribosomal DNA[J].Applied and Environmental Microbiology,2002,68 (1): 114-123.
[6] MALINEN E,KASSINEN A,RINTTILA T,et al. Comparison of real-time PCR with SYBR Green I or 5'-nuclease assays and dot-blot hybridization with rDNA-targetd oligonucleotide probes in quantification of selected faecal bacterial[J].Microbiology,2003,149(Pt1):269-277.
[7] 赵胜娟.实时荧光定量PCR法检测双歧杆菌对小鼠肠道菌群影响的研究[D].乌鲁木齐:新疆农业大学,2010.
[8] 金盼盼,邓燕杰.乳酸杆菌肽聚糖免疫作用的研究进展[J].中国微生态学杂志, 2013, 25(4):485-487.
[9] NEISH A S. Microbes ingastrointestinal heal and disease [J].Gastroenerology,2009,136(1):65-80.
[10] SARTOR RB. Microbial influences in inflammatory bowel diseases[J]. Gastroenerology,2008,134(2):577-594.
(责任编辑:魏 晓)
Research on Intestinal Bacterias in Rats with Endotoxemia of Dachengqi Decoction
Xie Bin1,Wang Dechao2,Chen Qiao1
(1.Jiangxi University of Traditional Chinese Medicine, Nanchang 330006,China; 2.Shaoguan Hospital of T.C.M, Shaoguan 512000,China)
Objective:To explore the effect of Dachengqi Decoction urgent purgation on endotoxemia rat intestinal Lactobacillus and Escherichia coli. Methods:Rats with cecal ligation and perforation caused by endotoxemia model, 8h after operation respectively Dachengqi Decoctionhigh (5g/kg·q12h), medium(2.5g/kg·q12h), low (1.25g/kg·q12h) dose, 1 times/q12h,a total of 5 times. Rats by real-time fluorescence quantitative PCR detection before modeling and after modeling 8h (before drug), number of 2d, 7d in Escherichia coli and lactobacillus. Results:After modeling 8h, high, low dose in rats, the number of Escherichia coli LOG was increased more than 3;2d after model establishment, high, middle dose quantity of Escherichia coli LOG value decreased, the amount of Lactobacillus LOG value increased; 7d after model establishment, high, middle dose of Lactobacillus, Escherichia coli LOG value.Return to the level before molding. Conclusion:The micro ecological mechanism of Dachengqi Decoction took effect of treating endotoxemia might promote theproliferation and inhibit the growth of Lactobacillus on Escherichia coli.
Dachengqi Decoction;Endotoxemia;Lactobacillus;Escherichia coli
2014-09-24
江西省教育厅科技项目(GJJ12526);江西中医药大学校级课题(2012ZR045)
谢斌(1975-),男,博士,江西中医药大学副教授,研究方向为中药抗感染研究。
R285.5
A
1673-2197(2015)04-0010-03
10.11954/ytctyy.201504006

