中国水仙NtSTK基因的克隆、序列和组织表达分析
吴菁华 吴少华 杨超 张志忠 林文雄
摘 要 MADS-box基因在植物花发育中发挥着重要的作用。为了研究D类MADS-box基因在中国水仙花发育中的功能,本实验采用RACE和RT-PCR技术从中国水仙‘金盏银台中分离到1个MADS-box基因,命名为NtSTK。该基因含有1个705 bp的开放阅读框,编码234个氨基酸,并且该基因在3个不同类型的中国水仙中序列差异较小。系统进化树显示NtSTK属于D类MADS-box基因。荧光定量分析表明该基因在‘金盏银台和‘玉玲珑的雌蕊和子房中表达水平较高,在根和叶片中低水平表达,在花被和雄蕊及鳞茎中不表达。
关键词 中国水仙;MADS-box基因;NtSTK基因;花发育
中图分类号 S682.21 文献标识码 A
cDNA Cloning, Sequence Analysis and Tissue Expression
of NtSTK in Narcissus tazetta var. chinensis
WU Jinghua1, WU Shaohua1, YANG Chao1, ZHANG Zhizhong1, LIN Wenxiong2
1 College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
2 Institute of Agroecology, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Abstract MADS-box genes play an important role in flower development. To investigate the function of D-class gene on flower development in Chinese narcissus, A MADS-box gene, named NtSTK, was cloned from‘Jinzhanyintaiflower buds by RACE and RT-PCR. The ORF of NtSTK is 705 bp in length that putatively encodes a protein with 234 amino acids. Sequence analysis indicated little differences among the three NtSTK genes cloned from Chinese narcissus. Homology analysis showed that the NtSTK was a D-class MADS-box gene. Quantitative real-time PCR analysis demonstrated that NtSTK was expressed higher levels in pistil and ovary from‘Jinzhanyintaiand‘Yulinglong, with low expression in leaf and root and no expression in perianth, stamen and bulb.
Key words Narcissus tazetta var. chinensis; MADS-box gene; NtSTK gene; Flower development
doi 10.3969/j.issn.1000-2561.2015.10.016
植物花器官发育近年来成为发育生物学研究的热点,继花发育ABC模型提出后,学者又不断的进行补充和完善,提出了ABCDE模型[1-3]。此模型中基因大部分属于MADS-box基因家族,该家族基因都具有MADS-box保守结构域,参与了多种植物生命活动,如调节植物开花时间[4]、花器官发育[5-6]、果实发育[7]、组织分化[8]和根、叶等营养器官的发育[9-10]。
到目前为止,在所有主要的种子植物中都发现有AGAMOUS基因(AG基因)。AG基因在被子植物和裸子植物分化之后、被子植物进化早期发生了一次重要的基因重复事件,产生了C类和D类基因,C类基因可进一步分为两亚进化枝:euAG亚进化枝和PLENA亚进化枝[11-12]。根据ABCDE模型,B、C和E基因调控形成花瓣和雄蕊;C和E基因调控心皮形态发生;D和E基因是参与胚珠的发育。这些基因产物构成多聚体调控复合体通过识别目标基因特定的顺式元件来调控花器官的发育[13-15]。
中国水仙(Narcissus tazetta var. chinensis)是福建省的特色花卉,具有极高的观赏和经济价值。目前关于中国水仙花发育相关的报道较少[16-19],主要集中在B类、C类和E类基因中,未见关于D类基因的报道。本研究以中国水仙3个品种为材料,利用RT-PCR结合RACE技术克隆STK基因,并对其表达模式进行了分析。本实验为分析花发育ABCDE模型在单子叶植物中的适用性提供材料,同时也为阐明水仙花发育机理和利用分子生物学手段对水仙进行遗传改良奠定理论基础。
1 材料与方法
1.1 材料
‘金盏银台和‘玉玲珑来自于福建省漳州市的2个中国水仙品种,平潭水仙是来自于福建省平潭综合实验室的水仙种质。分别取花芽、叶片、鳞茎以及盛花期的花瓣、副冠、雄蕊和雌蕊,液氮处理后置于-80 ℃保存备用。
1.2 方法
1.2.1 中国水仙NtSTK基因的克隆 采用多糖多酚植物总RNA快速提取试剂盒(北京百泰克生物技术有限公司)提取中国水仙‘金盏银台、‘玉玲珑和平潭水仙花蕾的RNA,用Clontech公司SMARTerTM RACE cDNA Amplification Kit合成cDNA。根据Genebank中单子叶植物STK类基因保守区序列设计特异引物,NtSTK1:5′-ATGGGGAGGGGAAAGA
TTGAGATAAAGAGG-3′,NtSTK2:5′-ACCCAAGA
TGAAGGGCTGTTTG-3′,以‘金盏银台cDNA为模板,进行PCR扩增,获取中国水仙STK基因保守区序列。据此序列设计3′RACE引物,NtSTK3:5′-GCAGCAAAACTGCGCCATCAGATTCAG-3′,与试剂盒中的引物进行PCR扩增获得该基因的3′端。根据上述实验结果设计NtSTK基因ORF的上游引物NtSTK4:5′-TATGAGCTCATGGGGAGGGGAAAG
ATT-3′和下游引物NtSTK5:5′-CTGTCTAGATCA
TTCTTCAGGATCAGCTT-3′,分别以‘金盏银台、‘玉玲珑和平潭水仙cDNA为模板进行PCR扩增,获得各品种的NtSTK基因ORF。
1.2.2 序列的生物信息学分析 利用ExPASY系统中的ProtParam工具(http://www.expasy. org/tools/ protparam.html)对水仙STK基因编码氨基酸进行分析,运用Blast搜索同源基因,使用Mega5软件对搜索获得的基因进行多重序列比对,构建系统发生树。
1.2.3 NtSTK基因的表达分析 分别提取单瓣水仙‘金盏银台的花瓣、副冠、雄蕊、雌蕊、叶片、根、鳞茎、子房和重瓣水仙‘玉玲珑的花瓣、副冠、瓣化雄蕊、瓣化雌蕊的总RNA,测定OD值后,取相同量RNA逆转录成cDNA,稀释10倍后待用。依据中国水仙NtSTK基因设计特异引物,分别为:NtSTK6:5′-GACTCACGCGGCTACTA
CCATGTC-3′,NtSTK7:5′- ACACCAATGTCCTCG
CTCCC TC-3′;用中国水仙Actin基因作为内参基因。Actin基因上游引物:5′-TGCCCAGAAGTGCTA
TTCCAG-3′,下游引物:5′-GTTGACCCACCACTA
AGAACAATG-3′。采用两步法荧光定量PCR。反应体系为20 μL:SYBR Premix Ex Taq 10 μL,引物各0.4 μL,稀释的cDNA 2 μL,补ddH2O到20 μL。反应程序:94 ℃预变性10 s,94 ℃变性5 s,57 ℃退火20 s,50个循环。以各样品为模板进行分析,3次重复。
1.3 数据处理
试验数据采用2-△△Ct方法进行处理。
2 结果与分析
2.1 中国水仙NtSTK基因的克隆
以中国水仙“金盏银台”的cDNA为模板,经PCR扩增后获得了679 bp的片段(图1)。Blast分析结果显示,该序列与已登录NCBI的多种植物的SEEDSTICK-like基因同源性都较高,其中与球花石斛(Dendrobium thyrsiflorum,DQ 017703)、麝香百合(Lilium longiflorum,AY 522502)、杂种百合(Lilium hybrid cultivar,AB 359184)、杂种蝴蝶兰(Phalaenopsis hybrid cultivar,AB 232953)和垂枝桦(Betula pendula,AM 283033)的同源性分别高达80%、79%、78%、78%和76%,可推断此片段为中国水仙STK基因的保守区片段。
根据所设计的3′RACE引物,经PCR扩增,得到一条约600 bp的单一条带(图1)。测序结果显示与保守区有395 bp的重叠区域,出现的第一个终止密码子是TGA,获得了中国水仙NtSTK基因的3′端。
根据所设计的中国水仙NtSTK基因的ORF引物,分别对‘金盏银台、‘玉玲珑和平潭水仙进行PCR扩增,分别得到ORF片段大小都为705 bp,分别命名为NtSTKJ,NtSTKY和NtSTKP。
2.2 中国水仙NtSTK基因生物信息学分析
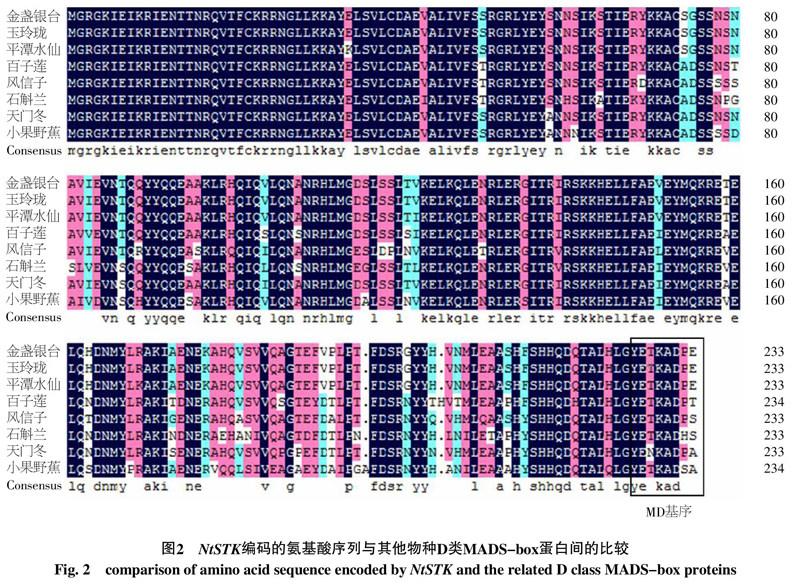
将中国水仙NtSTKJ基因所编码的氨基酸序列进行blast分析,结果表明该序列与其它物种中已知的SEEDSTICK-like基因氨基酸序列具有很高的一致性,其中与天门冬(Asparagus virgatus,BAD 83772)、百子莲(Agapanthus praecox,BAC 66963)、风信子(Hyacinthus orientalis,AAF 08830)、小果野蕉(Musa acuminata,AAY 53908)和石斛兰(Dendrobium nobile,ABQ 08574)等的同源性分别为91%、89%、88%、83%和82%,说明这些单子叶植物的SEEDSTICK类基因比较保守,‘金盏银台、‘玉玲珑和平潭水仙的SEEDSTICK基因相似度很高,仅有3个碱基的差异,这些差异可能是基因本身的差异,也可能是PCR扩增或者测序误差而导致的差异。
NtSTK基因编码的氨基酸序列与不同物种STK基因氨基酸序列的比对结果(图2)显示,此类基因在C端都有AG类基因具有的高度保守的AGI基序和AGII基序;同时也具有单子叶植物STK类基因特有的MD基序。这些保守基序的存在说明NtSTK基因属于D类MDAS-box基因。
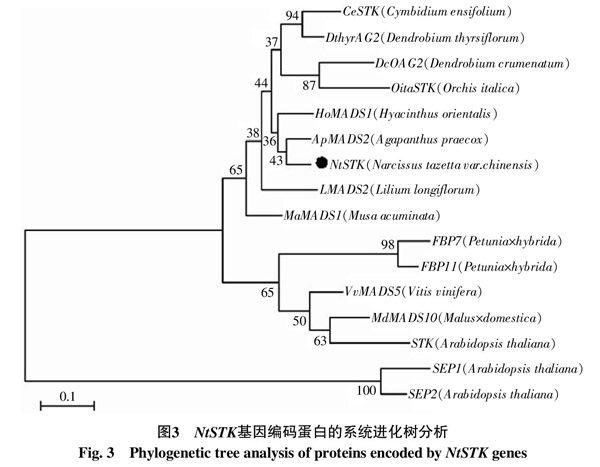
为了研究STK基因的进化关系,采用MEGA5.0软件构建了系统进化树(图3)。所有单子叶植物归为一类,双子叶植物归为另一类。NtSTK与百子莲的ApMADS2、风信子的HoMADS1聚在一起,且与兰科植物的STK聚在一起,说明这些单子叶植物的STK相似度较高,预示着其功能具有一定的相似性。
2.3 组织表达分析
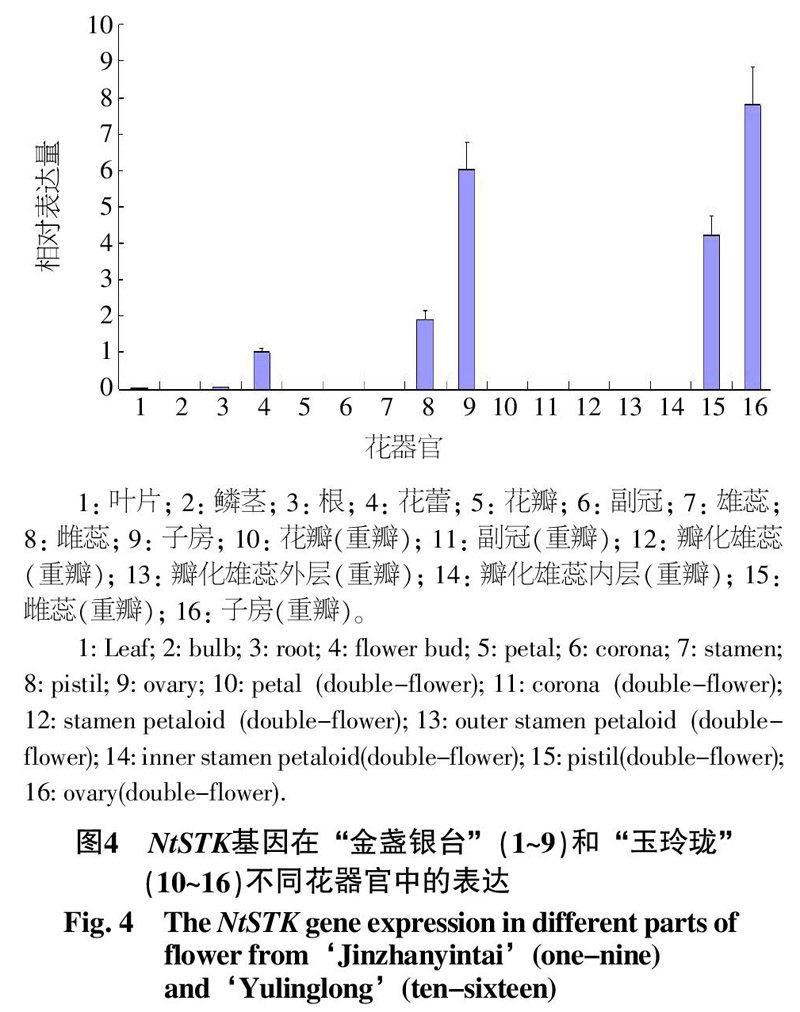
实时荧光定量PCR分析结果(图4)显示,NtSTK基因在“金盏银台”和“玉玲珑”的雌蕊和子房中表达,在叶片和根中有微量表达,在花的其它部位以及鳞茎中均不表达。由于水仙的花蕾中已包含了发育的雌蕊和子房,故NtSTK在花蕾中也有表达。
3 讨论与结论
通过基因重复事件产生不同的AG进化枝基因,这些不同类型的基因在序列上仍然比较相似,其蛋白C末端依然具有AGI基序和AGII基序[20]。在本研究中水仙的NtSTK也具有相似的基序,并且可与其它植物STK基因聚在一起,说明本实验分离的NtSTK基因属于D类基因。
不同植物AG基因的表达模式有一定差异,但均主要在雌蕊和雄蕊中表达。过去认为C类基因控制雄蕊和心皮的发育,如拟南芥中的AG[1];而D类基因参与胚珠的发育,例如矮牵牛中的FBP7和FBP11[21-22]。然而,近年来人们发现这2类基因的表达模式很难完全区分开。如球花石斛(Dendrobium thyrsiflorum Rchb)的C类基因DthyrAG1和D类基因DthyrAG2在成熟花中的表达模式基本一致,在子房的发育过程中也均有表达[23];从蝴蝶兰(Phalaenopsis amabilis)中克隆得到的C功能基因PhalAG1和D功能基因PhalAG2,二者在唇瓣、蕊柱及子房中都能表达,且表达情况基本没有差异[24]。
本试验对获得的NtSTK基因进行了组织特异性表达模式研究,结果表明该基因只在中国水仙的雌蕊和子房中表达,说明NtSTK基因应该是AG基因家族中的一员,对中国水仙雌蕊和子房的发育起着一定的作用。
本实验中发现,NtSTK(D类)在重瓣水仙“玉玲珑”雌蕊和子房中的表达量都比在单瓣水仙“金盏银台”雌蕊和子房中的表达量要高,其他学者的研究表明水仙NTMADS1(C类)在中国水仙副冠、雄蕊和子房中均有表达[16],产生这种现象的原因可能是中国水仙C类基因和D类基因在调控雌性生殖器官发育的过程中存在着功能冗余。
前人研究一般认为D类基因在胚珠发育过程中起核心作用,最新的研究成果改变这一认识。Heijmans等[25]重新分析了矮牵牛C类和D类基因的功能,在fbp7 fbp11突变体中,胚珠的发育很大程度上是不受影响,这表明胚珠的发育不仅仅是D类基因决定。当fbp7 fbp11双突变体与PMADS3-RNAi株系或fbp6突变体之一结合,获得了胚珠缺失严重的株系。这些结果表明,所有的矮牵牛AG成员在指定胚珠身份上功能冗余,不单单由D类基因来决定胚珠的特征。本实验结果也暗示水仙雌蕊和子房的发育可能受C类基因和D类基因的共同调控。
参考文献
[1] Coen E S, Meyerowitz E M. The war of the whorls: genetic interactions controlling flower development[J]. Nature, 1991, 353(6 339): 31-37.
[2] Theissen G. Development of floral organ identity: stories from the MADS house[J]. Curr Opin Plant Biol, 2001, 4(1): 75-85.
[3] Ferrario S, Immink R G, Angenent G C. Conservation and diversity in flower land[J]. Current Opinion in Plant Biology, 2004, 7(1): 84-91
[4] 孙崇波, 向 林, 李小白, 等. 蕙兰Flowering locus T基因的克隆及其对开花的影响[J]. 中国农业科学, 2013, 46(7): 1 419-1 425.
[5] Chang Y Y, Kao N H, Li J Y, et al. Characterization of the possible roles for B class MADS-box genes in regulation of perianth formation in orchid[J]. Plant Physiol, 2010, 152(2): 837-853.
[6] Pan Z J, Cheng C C, Tsai W C, et al. The duplicated B-class MADS-box genes display dualistic characters in orchid floral organ identity and growth[J]. Plant Cell Physiol, 2011, 52(9): 1 515-1 531.
[7] Colombo M, Masiero S, Vanzulli S, et al. AGL23, a typeⅠMADS-box gene that controls female gametophyte and embryo development in Arabidopsis[J]. Plant J, 2008, 54(6): 1 037-1 048.
[8] Ferrario S, Shchennikova A V, Franken J, et al. Control of floral meristem determinacy inpetunia by MADS-box transcription factors[J]. Plant Physiol, 2006, 140(3): 890-898.
[9] Ku A T, Huang Y S, Wang Y S, et al. IbMADS1(Ipomoea batatas MADS-box 1 gene)is involved in tuberous root initiation in sweet potato(Ipomoea batatas)[J]. Ann Bot, 2008, 102(1): 57-67.
[10] Benlloch R, Roque E, Ferrándiz C, et al. Analysis of B function in legumes: PISTILLATA proteins do not require the PI motif for floral organ development in Medicago truncatula[J]. Plant J, 2009, 60(1): 102-111.
[11] Kramer E M, Jaramillo M A, Di Stilio V S. Patterns of gene duplication and functional evolution during the diversification of the AGAMOUS subfamily of MADS-box genes in angiosperms[J]. Genetics, 2004, 166(2): 1 011-1 023.
[12] Zahn L M, Leebens-Mack J H, Arrington J M, et al. Conservation and divergence in the AGAMOUS subfamily of MADS-box genes: evidence of independent sub-and neofunctionalization events[J]. Evol Dev, 2006, 8(1): 30-45.
[13] Honma T, Goto K. Complexes of MADS-box proteins are sufficient to convert leaves into floral organs[J]. Nature, 2001, 409(6 819): 525-529.
[14] Theissen G, Saedler H. Plant biology. Floral quartets[J]. Nature, 2001, 409(6 819): 469-471.
[15] Ferrario S, Immink R G, Shchennikova A, et al. The MADS- box gene FBP2 is required for SEPALLATA function in petunia[J]. Plant Cell, 2003, 15(4): 914-925.
[16] 陈段芬. 中国水仙花型、 花色发育基因(NTMADS1, NTMADS3, NTPDS1, NTPZDS1)的克隆与转化[D]. 北京: 中国林业科学研究院, 2008: 62-65.
[17] 邓新杰, 熊莉君, 王 洋, 等. 过量表达中国水仙(Narcissus tazetta var. chinensis)NTAG1基因促进拟南芥早花和衰老[J]. 分子植物育种, 2011, 9(2): 238-244.
[18] 吴菁华, 杨 超, 吴少华. 中国水仙NtPI基因的克隆与表达分析[J]. 热带作物学报, 2012, 33(6): 1 084-1 088.
[19] 杨 超, 吴菁华, 吴少华. 中国水仙NTAP1基因的克隆与表达分析[J]. 西北植物学报, 2014, 34(1): 66-71.
[20] Kramer E M, Jaramillo M A, Di Stilio V S. Patterns of gene duplication and functional evolution during the diversification of the AGAMOUS subfamily of MADS-box genes in angiosperms[J]. Genetics, 2004, 166(2): 1 011-1 023.
[21] Angenent G C, Franken J, Busscher M, et al. A novel class of MADS-box genes is involved in ovule development in petunia[J]. Plant Cell, 1995, 7(10): 1 569-1 582.
[22] Colombo L, Franken J, Van der Krol A R, et al. Downregulation of ovule~specific MADS-box genes from petunia results in maternally controlled defects in seed development[J]. Plant Cell, 1997, 9(5): 703-715.
[23] Skipper M, Pedersen K B, Johansen L B, et al. Identification and quantification of expression levels of three FRUITFULL-like MADS-box genes from the orchid Dendrobium thyrsiflorum[J]. Plant Sci, 2005, 169(3): 579-586.
[24] Song I J, Nakamura T, Fukuda T, et al. Spatiotemporal expression of duplicate AGAMOUS orthologues during floral development in Phalaenopsis[J]. Dev Genes Evol, 2006, 216(6): 301-313.
[25] Heijmans K, Ament K, Rijpkema A S, et al. Redefining C and D in the petunia ABC[J]. Plant Cell, 2012, 24(6): 2 305-2 317.

