利用ID—ELISA技术调查分析海南3种主要番木瓜病毒分布及感病情况
杨勇 庹德财 沈文涛 言普 黎小瑛 周鹏 王锐萍
摘 要 利用PCR方法分别扩增番木瓜环斑病毒(papaya ringspot virus,PRSV)、番木瓜畸形花叶病毒(papaya leaf distortion mosaic virus,PLDMV)和番木瓜花叶病(papaya mosaic virus,PaMV)的外壳蛋白(coat protein,CP)基因,并连接到原核表达载体pET-28a上,获得重组质粒pET28-PRSV-CP、pET28-PLDMV-CP和pET28-PaMV-CP,通过转化、诱导表达后,经SDS-PAGE分析显示,这3种CP蛋白在大肠杆菌中高效表达,其中PRSV CP蛋白和PLDMV CP以包涵体形式存在,PaMV CP以可溶蛋白形式存在。利用Ni2+-NTA琼脂糖亲和层析纯化获得了3种病毒的重组CP蛋白,并免疫大白兔获得高效价的抗体。Western blot检测结果表明,这3种抗血清与对应的诱导表达蛋白发生特异反应。再采用抗血清建立一种快捷、简便和低成本的ID-ELISA(Indirect enzyme-linked immunosorbent assay)技术,并利用此技术对海南岛283个疑似感病的番木瓜样品进行检测鉴别,初步掌握了海南岛3种主要番木瓜病毒的分布及感病情况,为下一步该病的有效防治策略提供科学依据。
关键词 番木瓜病毒;外壳蛋白;抗血清;ID-ELISA
中图分类号 S41-30 文献标识码 A
Survey on Distributions and Infectious Status of Three Main Kinds
of Papaya Virus by ID-ELISA in Hainan
YANG Yong1,2, TUO Decai1, SHEN Wentao1, YAN Pu1,
LI Xiaoying1, ZHOU Peng1 *, WANG Ruiping2 *
1 Institute of Tropical Bioscience and Biotechnology, Chinese Academy of
Tropical Agricultural Sciences, Haikou, Hainan 571101, China
2 College of Life Science, Hainan Normal University, Haikou, Hainan 571158, China
Abstract The CP genes were amplified from PRSV, PLDMV and PaMV sequences by PCR,which were kept in our laboratory. Then the CP genes were connected to prokaryotic expression vector of pET-28a, after identification by enzyme digestion and sequencing, the three recombinant plasmids of pET28-PRSV-CP,pET28-PLDMV-CP and pET28-PaMV-CP were transformed into the expressing bacteria BL21(DE3). The CP genes were expressed efficiently with IPTG inducing by SDS-PAGE analysis. PRSV CP and PLDMV CP existed in the form of inclusion body, while PaMV CP expressed in the soluble form. The expressed proteins were purified with Ni2+-NTA agarose affinity chromatography and were used as antigens to immunize the rabbits for antiserum preparation. Western blot analysis confirmed that the antiserum only reacted with the corresponding expressed induced protein. 283 of unhealthy papaya leaves collected on the whole Hainan were tested by ID-ELISA. This study would preliminarily establish the distribution of papaya virus in Hainan, and provid scientific basis and a effective method for the prevention of papaya virus.
Key words Papaya viru; Coat protein; Antibody; ID-ELISA
doi 10.3969/j.issn.1000-2561.2015.10.024
海南岛地处热带和亚热带地区,气候温暖,自然条件优越,是中国番木瓜的主要种植区,但是病毒病是困扰番木瓜生产的主要因素,之前普遍认为危害海南番木瓜种植主要因素来自PRSV[1-2],然而近年来在海南地区番木瓜植株上发现了PLDMV[3]和PaMV[4],这3种病毒均为RNA病毒,侵染番木瓜后均出现叶片卷曲、花叶、果实有环斑状水渍等相似的症状[1-4],无法用常规的方法区分,给鉴别和防治带来了诸多困难。然而,采用电镜方法可直接观察到病毒生物大分子的亚基单位,从而可以对病毒进行鉴定和分类[5],但是电镜价格昂贵,操作要求严格,无法在大规模检测中应用;基于分子生物学的PCR检测技术在检测植物病毒中虽然具有高特异性和灵敏性,但是由于需要扩增设备,只能局限在实验室内操作[6],耗时长和成本较高,也不能适用于大规模的检测。
基于血清学的酶联免疫吸附法操作简单快捷、成本低、不需要复杂仪器,即可进行快速检测[7],可以用于大规模的病毒检测,但是利用病毒粒子制备的抗血清过程复杂,特异性不高,容易出现假阳性的现象[8]。随着近年来分子生物学的不断发展和原核表达技术的成熟,通过基因工程的途径,在蛋白酶缺陷性的大肠杆菌中表达病毒的CP基因获得病毒外壳蛋白,以纯化的重组蛋白作为抗原用来制备高特异性的抗血清,是目前抗血清制备的最为快捷有效的方式,可以解决使用病毒粒子制备抗血清特异性不高和效价不高的现象[9-10]。赵芹等利用原核表达技术制备了PRSV CP重组蛋白,通过免疫制备抗血清用于PRSV的检测[11],Bau等[12]利用原核表达技术制备了PLDMV CP蛋白用于PRSV和PLDMV血缘关系分析,但目前为止,尚未见利用原核表达技术制备商品化抗血清。为便于快速精确检测海南地区番木瓜病毒分布情况和种类,本研究利用PRSV、PLDMV和PaMV这3种病毒的重组CP蛋白制备抗血清,对海南岛283个疑似感病的番木瓜样品进行检测,建立一套简单、快捷、适于规模化有效检测和鉴别病毒的ID-ELISA技术,将有助于大量快速地调查番木瓜病毒的分布情况和鉴别病毒种类,从而有利于预警预报继而采取针对性的防控措施,对番木瓜种植业及其相关产业的健康可持续发展具有重要的现实意义。
1 材料与方法
1.1 材料
基因来源:含PRSV、PLDMV、PaMV全长基因质粒(Genbank登录号分别为JX974555、HQ424465和JX524226),均为本实验室克隆保存;菌株来源:trans 10和BL21(DE3),购自北京全式金生物技术有限公司;载体:pET-28a,购自Novagen公司。
根据这3种病毒的CP基因序列设计扩增引物并分别在上游引物和下游引物添加NcoⅠ酶切位点和XhoⅠ酶切位点,见表1所示,由上海英潍捷基公司合成。
1.2 方法
1.2.1 PRSV、PLDMV、PaMV的CP基因扩增
以PRSV、PLDMV和PaMV全长基因质粒为模板,参照表1中的引物,采用PCR扩增PRSV、PLDMV和PaMV的CP基因。反应体系:PRSV、PLDMV和PaMV全长基因的质粒0.5 μL、Pyrobest DNA Polymerase(日本TaKaRa)0.5 μL、dNTPs 8 μL、上下游引物各1 μL、10×Pyrobest BufferⅡ 5 μL、RNase-free Water 32.5 μL,共50 μL。扩增条件:94 ℃预变性5 min;95 ℃变性30 s、52 ℃退火30 s,72 ℃延伸1 min,72 ℃终延伸5 min,共30个循环。
1.2.2 原核表达载体的构建 3个CP基因胶回收片段和pET-28a载体分别利用NcoⅠ和XhoⅠ进行双酶切。反应体系:回收片段/pET-28a载体12.5 μL,NcoⅠ、XhoⅠ各1 μL,10×FD Green Buffer 2.5 μL,RNase-free Water 7 μL,共计25 μL,37 ℃酶切2 h后使用1%琼脂糖凝胶电泳,对扩增片段和载体进行胶回收,再经T4 DNA Ligase连接。反应体系:T4 DNA Ligase 0.5 μL,pET-28a载体2 μL,10×ligase Buffer 1 μL,回收片段4 μL,RNase-free Water 2.5 μL,共计10 μL,4 ℃连接过夜后转化大肠杆菌trans 10,筛选阳性克隆测序,再提取质粒并进行双酶切鉴定。
1.2.3 CP基因的诱导表达及热可溶性分析 将构建好的3个原核表达载体pET28-PRSV-CP、pET28-PLDMV-CP和pET28-PaMV-CP分别转化E. coli BL21(DE3),挑取阳性克隆的单菌落,接种于100 mL LB液体培养基中,37 ℃摇床培养至OD600约为0.8,分别向3个表达菌液中加入30 μL 0.1 mol/L的IPTG ,使IPTG的终浓度为0.3 mmol/L,37 ℃诱导3 h后5 000 r/min离心5 min收集菌体,加入细胞裂解缓冲液(140 mmol/L NaCl、50 mmol/L Tris-Cl、5 mmol/L EDTA,pH值8.0)20 mL,冰上放置超声波破碎10 min,15 000 r/min离心15 min,分离上清和沉淀,用含有8 mol/L的平衡液(20 mmol/L咪唑、20 mmol/L Tris-Cl、500 mmol/L NaCl,pH值8.0)溶解沉淀,取菌体裂解液的上清和沉淀溶液各10 μL,SDS-PAGE分析3种CP蛋白的可溶性。
1.2.4 表达蛋白的纯化及定量 SDS-PAGE分析显示,PRSV CP和PLDMV CP蛋白以不溶的包涵体形式存在,PaMV CP蛋白以可溶蛋白形式存在,取PRSV CP、PLDMV CP沉淀溶液和PaMV上清,利用Ni2+-NTA琼脂糖亲和层析柱(BIO-RAD)对这3种蛋白进行纯化。纯化后的蛋白经PBS(pH8.0)透析3次后,利用分光光度计测量这3种蛋白在260 nm和280 nm的光吸收值,根据公式(蛋白浓度(mg/mL)=1.45OD280-0.74OD260)计算出这3种蛋白的浓度。
1.2.5 抗血清的制备及效价的测定 将纯化后的蛋白均稀释至0.5 mg/mL,各取0.5 mL加入等体积的弗氏佐剂乳化后静脉注射大白兔,其后的4次注射利用弗氏不完全佐剂乳化抗原,每次间隔7 d,最后1次注射10 d后心脏取血制备抗血清,利用ID-ELISA法测定抗血清的效价。
1.2.6 Western blot分析 表达菌体裂解后进行SDS-PAGE,电转至硝酸纤维素膜上,分别用制备的3种抗血清作为一抗,5 000倍稀释碱性磷酸酯酶标记的羊抗兔IgG作为二抗进行western blot分析抗血清特异性。
1.2.7 样品的检测分析 本实验室保存的感染PRSV、PLDMV和PaMV的样品各取3个进行ID-ELISA检测,再根据这3种病毒序列设计特异性引物对样品进行RT-PCR验证。从海南岛采集感病的番木瓜叶片样品,以幼叶出现斑驳、畸形、花叶等症状为基准,共采集样品283个,每个样品的间隔距离大于10 km,其中保亭8个、昌江25个、澄迈13个、东方28个、海口45个、乐东27个、陵水19个、琼海8个、琼中18个、三亚31个、屯昌11个、万宁9个、文昌33个、五指山9个。
2 结果与分析
2.1 PRSV、PLDMV、PaMV的CP基因扩增
以PRSV、PLDMV和PaMV全长基因的质粒为模板,分别扩增出了约900、900和650 bp大小的片段,和预期的结果相符,见图1所示。
2.2 原核表达载体构建
对3种重组质粒进行NcoⅠ和XhoⅠ双酶切,出现2个条带(图2),其中载体大小约5 500 bp,测序结果显示,插入的片段阅读框均未发生移码突变,表明已成功构建了原核表达载体pET28-PRSV-CP、pET28-PLDMV-CP和pET28-PaMV-CP。
2.3 CP蛋白的诱导表达
原核表达载体pET28-PRSV-CP、pET28-PLDMV-CP和pET28-PaMV-CP转化大肠杆菌BL21(DE3),IPTG终浓度0.3 mmol/L诱导3 h后,诱导组分别在38、38和26 ku出现特异性条带,而空载体对照组和未诱导的菌液在此处没有出现条带(图3)。由于表达蛋白的氨基酸序列含有组氨酸标签,使得其在聚丙烯酰胺凝胶中的迁移速度较慢,所以电泳得到的片段比理论大小(PRSV CP、PLDMV CP、PaMV CP分别是34.6、33.9、24.1 ku)稍微大一些[13]。因此可以判定SDS-PAGE所测结果与预期相符。
2.4 蛋白的可溶性分析
表达菌体经超声波破碎后,离心分离沉淀和上清,然后经过12% SDS-PAGE分析,结果显示,原核表达PRSV CP和PLDMV CP蛋白主要以不可溶的包涵体形式存在,可溶蛋白含量很少;PaMV CP蛋白主要以可溶性蛋白的形式存在,包涵体形式的蛋白很少(图4)。
2.5 蛋白的纯化及定量
以包涵体形式表达的PRSV CP和PLDMV CP蛋白沉淀用含有8 mol/L尿素的平衡液溶解后,再利用Ni2+-NTA琼脂糖亲和层析柱进行纯化;可溶性PaMV CP蛋白的离心上清液直接加入到Ni2+-NTA琼脂糖亲和层析进行纯化,成功去除了杂蛋白。测定透析后蛋白的浓度分别为0.95、0.84和1.12 mg/mL(图5)。
2.6 抗血清制备和效价测定
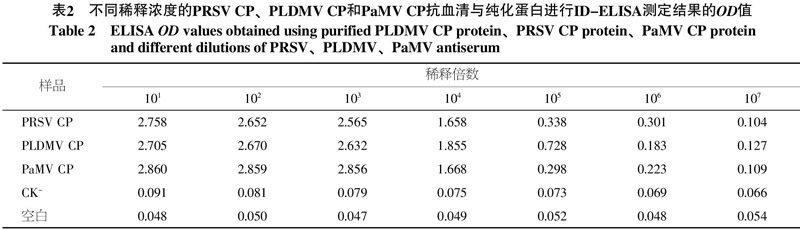
将纯化的3个CP蛋白免疫大白兔,获得PRSV、PLDMV和PaMV的抗血清,抗血清效价及工作浓度分别以纯化不同稀释倍数的CP蛋白为抗原进行ID-ELISA测定,结果显示:抗血清稀释106倍仍可以明显的呈阳性反应(表2)。
2.7 Western Blot分析结果
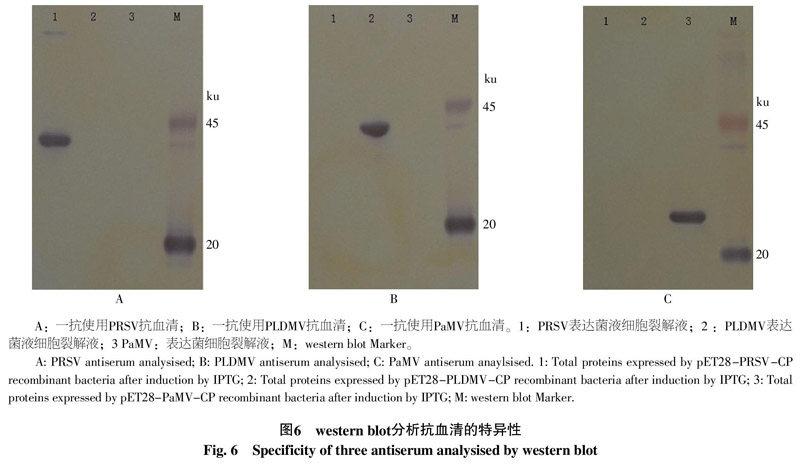
Western blot结果显示,当以PRSV抗血清作为一抗时,在第一泳道38 ku处有特异性条带(图6-A);当以PLDMV抗血清作为一抗时,在第二泳道38 ku处有特异性条带(图6-B);当以PaMV抗血清作为一抗时,在第三泳道26 ku处有特异性条带(图6-C)。表明这3个抗血清之间不会发生交叉反应,诱导蛋白仅和对应的抗血清发生反应,以此判定3种抗血清具有高特异性。
2.8 样品的检测与分析
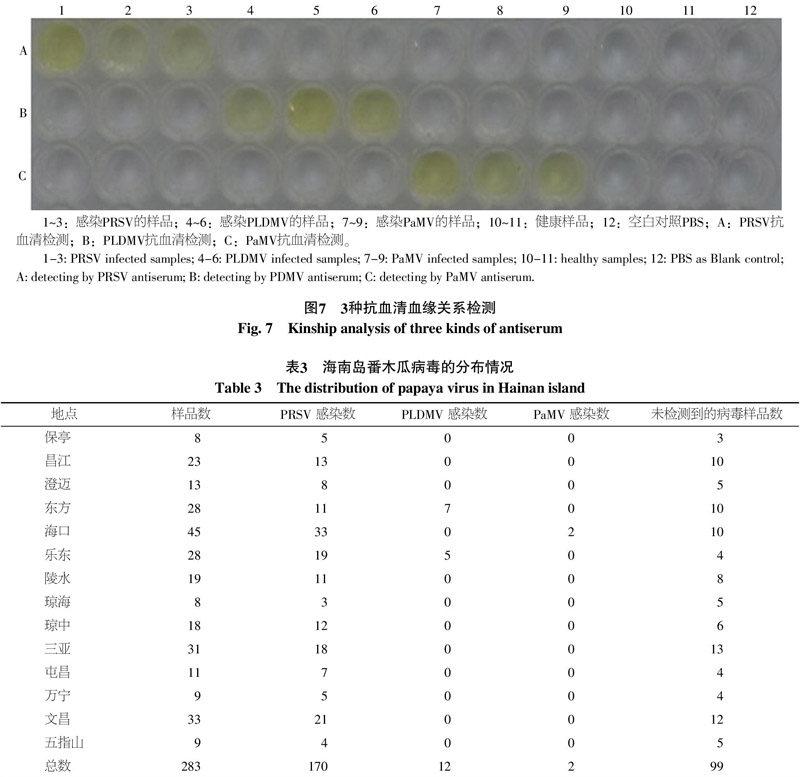
用本研究中制备的3种抗血清对本实验室保存的感病样品进行ID-ELISA检测,感病样品均和对应的抗血清发生反应,而不与其他抗血清发生反应,健康样品与这3种抗血清均不发生反应(图7所示)。RT-PCR检测结果与ID-ELISA检测结果相符。
对海南岛各市县采集到的283个样品进行ID-ELISA检测,在检测的样品中,有170个样品感染了PRSV,占60.2%,在各个市县均有发现,并呈随机分布;有12个样品感染了PLDMV,占4.2%,只分布于乐东和东方地区;感染PaMV的样品有2个,占0.7%,仅在海口发现。在检测的样品中,有2个样品同时感染了PRSV和PLDMV(表3)。
3 讨论与结论
在本研究中,3种工程菌株经过终浓度为0.3 mmol/L的IPTG诱导3 h,目的蛋白得以高效表达,表达的3种病毒CP蛋白中,其中PRSV CP和PLDMV CP是以不可溶的包涵体形式表达,PaMV CP以可溶蛋白的形式表达。在同样的表达和诱导条件下,包涵体的出现,可能与蛋白质的氨基酸序列有关。包涵体蛋白无法直接用于免疫大白兔,将包涵体形式表达的蛋白通过复性的方式,可以形成可溶的蛋白以便用于后续试验。
本研究制备的3种抗血清,不会发生交叉反应,是ID-ELISA检测番木瓜病毒的前提条件。在检测的过程中,注意抗血清的稀释比例应适当,抗血清含量高容易形成假阳性,含量过低又无法检测到病毒。通过多次重复实验,确定了检测的工作浓度。以感病叶片为抗原的试验中,当抗血清稀释10~100倍时,健康叶片和空白对照都出现显色反应,说明抗血清浓度过高,在酶标板中本底反应较为明显,不适用于样品的检测;当抗血清的稀释倍数在103到106时,感病叶片有显色,健康叶片的对照和空白均不显色;当稀释大于等于106倍时,感病样品和对照组都不出现显色反应,因此3种抗血清稀释103到106倍作为检测的工作浓度较为合适。
近年来有报道称在墨西哥和菲律宾发现PRSV和PaMV同时侵染番木瓜植株的现象[14-15],在中国台湾地区和海南地区发现有PLDMV侵染抗PRSV转基因植株的现象[12,16],本研究利用ZO-ELISA技术在海南发现了PRSV和PLDMV同时侵染番木瓜的现象,预示着在海南番木瓜病毒可能会以新的发病方式危害其种植业,必须尽早采取有效的防治措施。因此,对番木瓜病毒分布及感病情况作进一步调查,及时发现并消灭病毒源,同时对新出现的病毒混和侵染番木瓜的分子机制作深入探究十分重要,结果可为有效控制番木瓜病毒病情的防控策略制定提供科学依据。
参考文献
[1] Purcifull D E, Edwardson J R, Hiebert E, et al. Papaya ringspot virus[J]. CMI/AAB Descriptions of plant viruses, 1984, 292(84): 8.
[2] Naqvi S. Diseases of fruits and vegetables[M]. New York: Springer, 2004.
[3] 杨 勇, 庹德财, 沈文涛, 等. 海南地区番木瓜畸形花叶病毒的发现与鉴定[J]. 热带作物学报, 2013, 34(12): 2 442-2 445.
[4] 王永辰, 沈文涛, 王树昌, 等. 海南番木瓜花叶病毒全长cDNA克隆及序列分析[J]. 热带作物学报, 2013, 34(2): 297-300.
[5] 代永欣, 牛建新, 王 林, 等. 核果类果树病毒病检测研究进展[J]. 新疆农业科, 2008, 45(1): 52-55.
[6] Narayanasamy P. Microbial Plant Pathogens-Detection and Disease Diagnosis: Viral and Viroid Pathogens[M]. New York: Springer Science & Business Media, 2010.
[7] 金 羽, 文景芝. 植物病毒检测方法研究进展[J]. 黑龙江农业科学, 2005(3): 37-40.
[8] Gonsalves D, Ishii M. Purification and serology of papaya ringspot virus[J]. Phytopathology, 1980, 70: 1 028-1 032.
[9] 梁文星, 宋丽敏, 黄金光, 等. 紫藤脉花叶病毒cp基因在大肠杆菌中的表达及抗血清的制备[J]. 中国病毒学, 2005, 19(3): 281-284.
[10] 吴育鹏, 王健华, 冯团诚, 等. 辣椒斑驳病毒CP基因的原核表达及抗血清的制备[J]. 园艺学报, 2010, 37(10): 1 598-1 604.
[11] 赵 芹, 李华平, 谢大森, 等. 番木瓜环斑病毒外壳蛋白基因原核表达蛋白的抗血清制备及其检测应用[J]. 园艺学报, 2012, 39(8): 1 457-1 464.
[12] Bau H J, Kung Y J, Raja J A J, et al. Potential threat of a new pathotype of Papaya leaf distortion mosaic virus infecting transgenic papaya resistant to Papaya ringspot virus[J]. Phytopathology, 2008, 98(7): 848-856.
[13] 唐威华, 张景六, 王宗阳, 等. SDS-PAGE法测定His-tag融合蛋白分子量产生偏差的原因[J]. 植物生理学报, 2000, 26(1): 64-68.
[14] Noa-Carrazana J C, González-de-León D, Ruiz-Castro B S, et al. Distribution of Papaya ringspot virus and Papaya mosaic virus in papaya plants(Carica papaya)in Mexico[J]. Plant disease, 2006, 90(8): 1 004-1 011.
[15] Tanada J M, Elvira P R V, Dolores L M, et al. Detection of mixed virus infection with Papaya ringspot virus(PRSV)in papaya(Carica papaya L.)grown in Luzon, Philippines[J]. Philippine Journal of Crop Science, 2009, 34(1): 62-74.
[16] Tuo D, Shen W, Yan P, et al. Complete genome sequence of an isolate of papaya leaf distortion mosaic virus from commercialized PRSV-resistant transgenic papaya in China[J]. Acta virologica, 2012, 57(4): 452-455.

