新型胆酸不对称双缩二氨基硫脲类衍生物的合成及其抗菌活性*
张丽娜,赵志刚,谭 炯,李 晖
(西南民族大学化学与环境保护工程学院,四川成都610041)
近年来,席夫碱由于其广泛的生物化学性质,已成为越来越多研究人员关注的热点[2]。然而双席夫碱结构类化合物却鲜有报道[3]。含有硫脲基的席夫碱显示出良好的生物活性[4],如抗肿瘤[5-6]、抗癌[7-8]、抗病毒[9-10]、抗细菌[11-13]、抗真菌[14-15]、抗疟疾[16-17]及抗细胞增殖[18-19]等,具有潜在的药用价值。
甾体是一类广泛存在于生物体中并具有重要功能的化合物[20],由于其独特的化学结构,在母体上引入不同官能团能使其生物活性发生变化[21-22]。另外,在微波辐射条件下进行的有机反应,具有速率快、效率高和产物易纯化等特点[23-25]。

Scheme 1
本文根据活性叠加原理,在微波辐射条件下,甾酮(1)与取代单缩二氨基硫脲(2a~2l)经缩合反应合成了12个新型的胆酸不对称双缩二氨基硫脲衍生物(3a~3l,Scheme 1),其结构经1H NMR,IR,ESI-MS和元素分析表征。并测试了3a~3l对枯草芽孢杆菌(ATCC 6633),金黄色葡萄球菌(ATCC 6538),大肠杆菌(ATCC 35218)和绿脓杆菌(ATCC 27853)的抑菌活性。
1 实验部分
1.1 仪器与试剂
WRS-1B型数字显微熔点仪(温度未校正);Wzz-2B型自动旋光仪(CH2Cl2为溶剂);Agilent-400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);PERKIN-ELMER1700型红外光谱仪(KBr压片);FINNIGAN-LCQ型质谱仪;VarioMICRO型自动元素分析仪;锐品-ECA-9272型电热恒温培养箱;东联-DL-CJ-1N型垂直层流洁净工作台。
1 和 2 按文献[26-28]方法合成;ATCC 6633,ATCC 6538,ATCC 35218和 ATCC 27853,中国普通微生物菌种保藏管理中心;其余所用试剂均为分析纯。
1.2 合成
(1)3a~3l的常规合成通法
在圆底烧瓶中加入乙醇15 mL,1 0.42 g(1 mmol),2 1 mmol及浓盐酸2滴,搅拌下回流(80℃)反应9 h~12 h(TLC监测)。冷却(析出固体),过滤,滤饼用乙醇重结晶得白色固体3a~3l。
(2)3a~3l的微波合成通法
在圆底烧瓶中加入中性氧化铝0.2 g,1 0.42 g(1 mmol),2 1 mmol和浓盐酸2滴,搅拌下微波辐射(500 W)反应4.0 min ~7.0 min(TLC 监测)。反应液用DMSO(3×10 mL)萃取,合并萃取液,加水20 mL(析出固体),过滤,滤饼用乙醇重结晶得白色固体3a~3l。
3a:产率88%,m.p.142℃ ~143℃,[α]20D-87.73 °(c 0.57);1H NMR δ:11.72(s,1H,NH),10.57(s,1H,NH),8.10(s,1H,CH),7.72~7.60(m,2H,ArH),7.47~7.39(m,3H,ArH),3.58(s,3H,OCH3),1.31(s,3H,19-H),1.01(s,3H,18-H),0.77(d,J=6.4 Hz,3H,21-H);IR ν:3 327,3 230,2 950,2 876,1 738,1 704,1 635,1 519,1 450,1 386,1 267,1 181,1 015,761 cm-1;ESI-MS m/z:615{[M+Na]+};Anal.calcd for C33H44N4O4S:C 66.86,H 7.48,N 9.45;found C 66.97,H 7.46,N 9.47。
3d:产率91%,m.p.205℃ ~206℃,[α]20D-98.47 °(c 0.58);1H NMR δ:11.78(s,1H,NH),10.66(s,1H,NH),8.51(s,1H,CH),8.09(s,1H,ArH),7.52 ~7.50(m,1H,ArH),7.44 ~ 7.42(m,2H,ArH),3.59(s,3H,OCH3),1.31(s,3H,19-H),1.01(s,3H,18-H),0.76(d,J=6.4 Hz,3H,21-H);IR ν:3 327,3 185,2 949,2 881,1 740,1 702,1 520,1 435,1 387,1 275,1 172,803 cm-1;ESI-MS m/z:649{[M+Na]+};Anal.calcd for C33H43N4O4SCl:C 63.19,H 6.91,N 8.93;found C 63.28,H 6.90,N 8.95。
3e:产率85%,m.p.168℃ ~169℃,[α]20D-126.96 °(c 0.60);1H NMR δ:11.74(s,1H,NH),10.62(s,1H,NH),8.08(s,1H,CH),7.75 ~7.62(m,2H,ArH),7.51(d,J=8.4 Hz,2H,ArH),3.58(s,3H,OCH3),1.31(s,3H,19-H),1.01(s,3H,18-H),0.76(d,J=6.4 Hz,3H,21-H);IR ν:3 320,3 188,2 942,2 876,1 737,1 695,1 591,1 443,1 315,1 228,1 096,830 cm-1;ESI-MS m/z:649{[M+Na]+};Anal.calcd for C33H43N4O4SCl:C 63.19,H 6.91,N 8.93;found C 63.07,H 6.92,N 8.91。
3g:产率87%,m.p.216℃ ~217℃,[α]20D-81.08 °(c 0.59);1H NMR δ:11.67(s,1H,NH),10.55(s,1H,NH),9.62(d,J=6.4 Hz,1H,OH),8.01(s,1H,CH),7.25(t,J=8.0 Hz,7.6 Hz,1H,ArH),7.14(s,2H,ArH),6.82(d,J=7.6 Hz,1H,ArH),3.58(s,3H,OCH3),1.27(s,3H,19-H),1.01(s,3H,18-H),0.76(d,J=6.0 Hz,3H,21-H);IR ν:3 318,3 200,2 949,2 873,1 740,1 704,1 613,1 513,1 436,1 329,1 222,1104,690 cm-1;ESI-MS m/z:631{[M+Na]+};Anal.calcd for C33H44N4O5S:C 65.10,H 7.28,N 9.20;found C 65.19,H 7.30,N 9.22。
3i:产率86%,m.p.234℃ ~235℃,[α]20D-107.52 °(c 0.60);1H NMR δ:11.76(s,1H,NH),11.55(s,1H,OH),10.78(s,1H,NH),9.91(s,1H,OH),8.56(s,1H,CH),7.13(d,J=6.0 Hz,1H,ArH),6.34(d,J=8.4 Hz,1H,ArH),6.29(s,1H,ArH),3.58(s,3H,OCH3),1.27(s,3H,19-H),1.00(s,3H,18-H),0.76(d,J=6.4 Hz,3H,21-H);IR ν:3 316,3 225,2 951,1 732,1 713,1 628,1 582,1 511,1 462,1 332,1 211,1 109,811 cm-1;ESI-MS m/z:647{[M+Na]+};Anal.calcd for C33H44N4O6S:C 63.44,H 7.10,N 8.97;found C 63.52,H 7.08,N 8.95。
1.3 抗菌活性测试
以阿莫西林为阳性对照,DMSO为阴性对照,测定3a~3l对两种革兰氏阳性细菌(ATCC 6633和ATCC 6538)和两种革兰氏阴性细菌(ATCC 35218和ATCC 27853)的抗菌活性。采用二倍稀释法与纸片扩散法进行抗菌活性筛选,每个测试重复三次,分别计算IC50及MIC值。
(1)IC50
对3,阿莫西林和环丙沙星分别用无菌DMSO溶解定容得浓度为640 μg·mL-1的母液。将母液依次稀释为(640,320,160,80,40,20,10,5)μg·mL-1;0 μg·mL-1作为空白对照。将活化后的细菌接种在培养基中,菌液浓度配成0.5麦氏比浊标准,约含(1~2)×108CFU·mL-1,用 MH肉汤将菌液进行1∶100稀释后,用无菌棉沾取菌液在营养琼脂培养基平板表面均匀涂抹3次,室温干燥10 min,将含有400 μL各梯度浓度药液的无菌干燥滤纸片(直径6 mm)贴放于培养基平板表面。于37℃恒温孵化18 h测得抑菌圈直径,计算IC50值。
(2)MIC
将活化后的细菌接种在培养基中,菌液浓度为0.5麦氏比浊标准,用MH肉汤将菌液进行1∶100稀释后备用。将3和阿莫西林分别用无菌DMSO溶解定容得母液浓度为1 280 μg·mL-1。采用二倍稀释法依次稀释至浓度为(256,128,64,32,16,8,4,2,1,0.5,0.25)μg·mL-1;0 μg·mL-1作为空白对照。将1 mL菌液加入各梯度浓度药物原液,于37℃恒温孵化18 h,观察结果并记录MIC值。
2 结果与讨论
2.1 微波辐射合成与常规合成对比
3a~3l的微波辐射合成法与常规合成法的对比结果见表1。
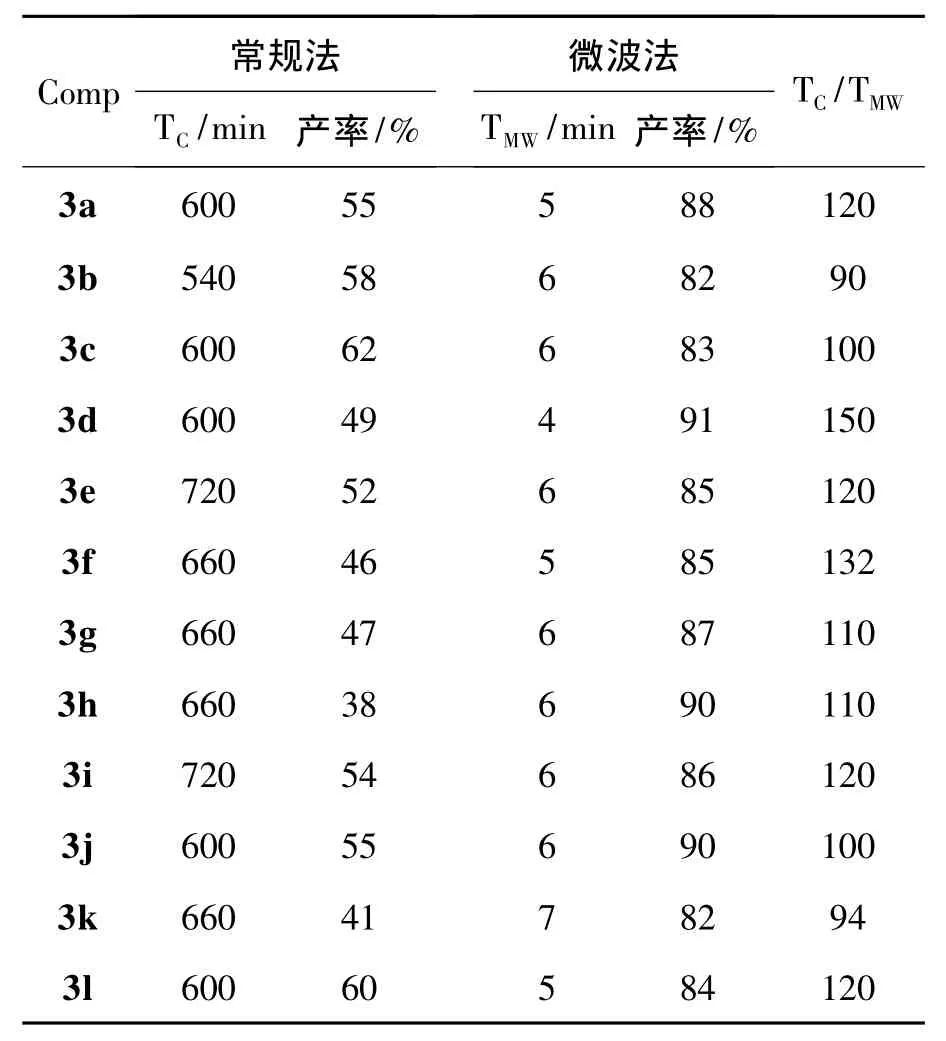
表1 微波辐射法与常规加热法合成3a~3l的比较*Table 1 Comparison between microwave irradiation and conventional heating for synthesizing 3a~3l
由表1可见,微波辐射合成法具有以下优点:(1)反应速率增大了94~150倍,大大缩短了反应时间;(2)反应收率大大提高,从常规法的38%~62%提高至82%~91%。可见,微波合成法是一种高效、快捷的合成胆酸不对称双缩二氨基硫脲类衍生物的好方法。
2.2 表征
在1H NMR 谱图中,δ 11.78~11.55 处的宽单峰和 δ 11.64 ~10.42处的单峰均为NH质子吸收峰;δ 8.69 ~8.00 处的单峰为CH=N上的活泼质子峰;δ 8.09~6.29处的吸收峰为苯环与噻吩环上的质子峰;δ 3.59 ~3.58处单峰为 CO2CH3质子峰;δ 1.31 ~1.27和 δ 1.01 ~1.00 处单峰与 δ 0.77 ~0.76处双峰分别为甾体上19-位,18-位与21-位氢的特征峰。
在IR 谱图中,3 413 cm-1~3 147 cm-1处的强吸收峰为N-H伸缩震动的特征峰;1 650 cm-1~1 506 cm-1与1 297 cm-1~1 236 cm-1处的强吸收峰分别为C=N与C=S的特征峰;1 742 cm-1~1 732 cm-1处的强吸收峰为CO2CH3中C=O吸收峰;1 713 cm-1~1 695 cm-1处的吸引峰则为甾酮中C=O基团的特征峰。
2.3 抗菌活性
3a~3l的抗菌活性结果见表2。由表2可见,3b,3f和3g对ATCC 6633显示出良好的抑制效果,3g效果最佳;3b,3e,3f和 3j对 ATCC 6538显示出抑制效果,3b与3e的活性优于3f与3j;3b,3e,3f和3k对ATCC 35218显示出抑制效果,3f的活性明显优于其他化合物,与标准对照药物阿莫西林相当;3b,3e,3f和3k均对ATCC 27853显示出抑制效果。由表2还可见,氨基硫脲上的取代基团为噻吩时只对革兰氏阴性细菌有抑制作用。
3 结论
本文以甾酮为起始原料,在无溶剂条件下,微波促进合成了12个新型的胆酸不对称双缩二氨基硫脲衍生物,产率高达91%。该合成方法具有反应时间短、产率高、绿色环保等优点。
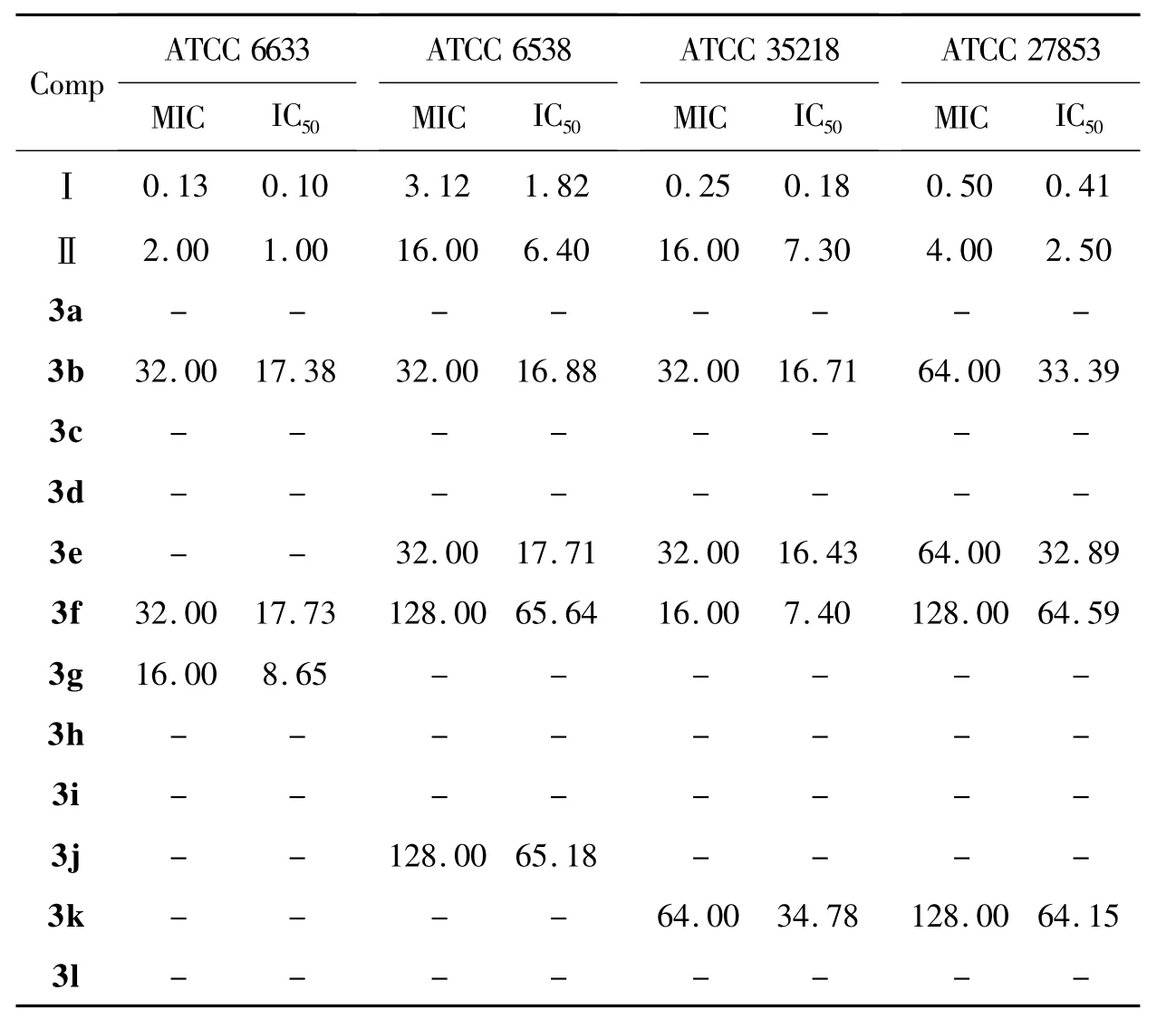
表2 3a~3l的抗菌活性*Table 2 Antibacterial activities of 3a~3l
抗菌活性测试结果表明:部分目标化合物具有良好的抗菌活性,其中,1-(2-羟基苯苄叉基)-5-[3-(3,7-二氧代-24-胆烷酸甲酯)亚甲基]二氨基硫脲(3f)的抗菌效果尤为显著。该研究工作对该类新药研发提供了一定的研究依据。
[1]胡云霞,李琬聪,周婷婷,等.1,2,3-三氮唑桥连水杨醛类席夫碱菊糖衍生物的合成及抑茵活性研究[J].化学与生物工程,2014,31:27-30.
[2]Abdel M A A,Mohamed E Z,Suliman A A.Synthesis,spectral characterization,molecular modeling and antimicrobial studies of tridentate azo-dye Schiff base metal complexes[J].J Mole Struct,2015,1084:36 -45.
[3] 仇晓阳.二核双席夫碱铜(Ⅱ)配合物的合成、晶体结构及抗菌活性研究[J].无机化学学报,2014,30:1667-1672.
[4]胡庆红,袁泽利,吴庆,等.二氨基硫脲双核席夫碱和其配合物的合成与抗菌活性[J].应用化学,2009,26:534 -537.
[5]Gustavo E C,Michael R H,Wara M A,et al.Initial evaluation of the antitumour activity of KGP94,a func-tionalized benzophenone thiosemicarbazone inhibitor of cathepsin L[J].Eur J Med Chem,2012,58:568 -572.
[6]Ana I M,Ines L,Pilar S.Palladium(Ⅱ)and platinum(Ⅱ)bis(thiosemicarbazone)complexes of the 2,6-diacetylpyridine series with high cytotoxic activity in cisplatin resistant A2780cisR tumor cells and reduced toxicity[J].J Inorg Biochem,2013,125:26 - 31.
[7]Floyd A B,Jeffrey T,Michael S J,et al.Synthesis and characterization of mixed-ligand diimine-piperonal thiosemicarbazone complexes of ruthenium(Ⅱ):Biophysical investigations and biological evaluation as anticancer and antibacterial agents[J].J Mole Struct,2011,992:39 -47.
[8]Duraippandi P,Ashoka G S.Dinuclear zinc bis(thiosemicarbazone)complexes:Synthesis,in vitro anticancer activity,cellular uptake and DNA interaction studys[J].Inorg Chim Acta,2013,408:152 - 161.
[9]Field H J,Reading M J.The inhibition of bovine herpesvirus-1 by methyl 2-pyridyl ketone thiosemicarbazone and its effects on bovine cell[J].Antiviral Res,1987,7:245 -256.
[10]Andreas J K.Broad-spectrum antiviral activity including human immunodeficiency and hepatitis C viruses mediated by a novel retinoid thiosemicarbazone derivatives[J].Eur J Med Chem,2011,46:1656 - 1664.
[11]Zhong Z M,Aotegen B,Xu H,et al.Structure and antimicrobial activities of benzoyl phenyl-thiosemicarbazone-chitosans[J].Inter J Biol Macromole,2012,50:1169-1174.
[12]Diana I,Elena P,Sergiu S,et al.Synthesis,characterization,crystal structure and antimicrobial activity of copper(Ⅱ)complexes with a thiosemicarbazone derived from 3-formyl-6-methylchromone[J].Polyhedron,2014,81:123 -131.
[13]仇丽颖,赵志刚,李琳,等.新型噻吩-2-甲醛不对称双缩二氨基硫脲衍生物的合成及其抗菌活性[J].合成化学,2014,22:293 -297.
[14]Kusai A,Anne L,Magali A,et al.Synthesis,structure and antifungal activity of thiophene-2,3-dicarboxaldehyde bis(thiosemicarbazone)and nickel(Ⅱ),copper(Ⅱ)and cadmium(Ⅱ)complexes:Unsymmetrical coordination mode of nickel complex[J].J Inorg Biochem,2013,126:76 -83.
[15]Qin Y K,Xing R G,Liu S,et al.Novel thiosemicarbazone chitosan derivatives:Preparation,characterization,and antifungal activity[J].Carbohydrate Polymers,2012,87:2664 -2670.
[16]Renata B O,Elaine M S F,Rodrigo P P S,et al.Synthesis and antimalarial activity of semicarbazone and thiosemicarbazone derivatives[J].Eur J Med Chem,2008,43:1983 -1988.
[17]Kewal K,Sarah S,Antonio G S,et al.Highly potent anti-proliferative effects of a gallium(Ⅲ)complex with 7-chloroquinoline thiosemicarbazone as a ligand:Synthesis,cytotoxic and antimalarial evaluation[J].Eur J Med Chem,2014,86:81 -86.
[18]Dimitra K D,Anastasia Gi,Nikolaos K,et al.Synthesis,characterization,crystal structure and antiproliferative activity of platinum(Ⅱ)complexes with 2-acetylpyridine-4-cyclohexyl-thiosemicarbazone[J].Polyhedron,2007,26:2871 -2879.
[19]Ana I M,Carolina H,Ana R,et al.3,5-Diacetyl-1,2,4-triazol bis(4N-substituted thiosemicarbazone)palladium(Ⅱ)complexes:Synthesis,structure,antiproliferative activity and low toxicity on normal kidney cells[J].J Inorg Biochem,2011,105:1613 -1622.
[20]金培元,巨勇.新型甾体缀合物的设计合成及活性研究[J].化学进展,2007,19:1883 -1895.
[21]张晓佳,崔建国,李莹,等.具有生理活性甾体肟类化合物的研究进展[J].有机化学,2010,30:655 -661.
[22]廖莉,焦艳晓,姚秋翠,等.甾体含氮化合物的合成及抗肿瘤活性研究[J].化学试剂,2012,34:211 -215.
[23]Lucas C L,Maria T M B,Karen M G,et al.Microwave versus conventional heating treatment[J].Enzyme Micro Tech,2015,69:10 -18.
[24]Shidokht Ni,Khashayar G.Solvent and microwave effects on oxidation of aromatic α-diketones[J].J Indus Engine Chem,2015,21:198 -205.
[25]赵志刚,石治川,刘强,等.新型猪去氧胆酸分子钳人工受体的微波无溶剂合成及其对氨基酸甲酯的识别性能[J].合成化学,2014,22(5):601 -607.
[26]李清寒,赵志刚.不对称双缩二氨基硫脲化合物的合成及表征[J].西南民族大学学报(自然科学版),2008,34:982 -984.
[27]Shi Z C,Zhao Z G,Liu M,et al.Solvent-free synthesis of novel unsymmetric chenodeoxycholic acid bis thiocarbazone derivatives promoted by microwave irradiation and evaluation of their antibacterial activity[J].C R Chimie,2013,16:977 -984.
[28]崔建国,黄立梁,黄燕敏,等.一种具有抗肿瘤活性胆酸衍生物的合成新方法[J].有机化学,2009,29:971-974.

