1,3,5-三甲氧基苯的绿色合成工艺*
刘耀杰,咸 漠,刘福胜,孙伟之
(1.青岛科技大学化工学院,山东青岛 266042;2.中国科学院青岛生物能源与过程研究所中国科学院生物基材料重点实验室,山东青岛 266101)
1,3,5-三甲氧基苯(TMB)是一种重要的有机合成中间体,广泛应用于医药、农药和精细化工产品的合成中,如用于血管扩张剂盐酸丁咯地尔[1]和普福美[2]的合成。目前,合成TMB的方法主要有三种:一是以六氯苯为原料经醚化和脱氯二步反应制备 TMB[3]。二是以1,3,5-三溴苯为原料经甲氧基化反应制备 TMB[4-5]。三是以间苯三酚(PG)为原料经甲基化反应制备 TMB[6-7]。方法一步骤较多且六氯苯毒性较大,使用甲醇钠,需要无水操作,总收率较低(54%)。方法二原料昂贵,成本高,也使用甲醇钠,需要无水操作,反应条件繁琐,周期较长。方法三工艺条件简单,后处理容易,收率较高。由PG甲基化制备TMB的传统甲基化试剂为硫酸二甲酯和卤代甲烷等剧毒试剂,污染严重、毒性大。与硫酸二甲酯等相比,碳酸二甲酯(DMC)是近年发展起来的一种绿色甲基化试剂[8-10],无毒无腐蚀性,可代替硫酸二甲酯和卤代甲烷等传统试剂以实现酚类的绿色甲基化[11-15]。
因此,本文以DMC为甲基化试剂,在K2CO3/(Bu)4NBr体系催化下,以PG为原料合成了TMB(Scheme 1),其结构经1H NMR,13C NMR和HRESI-MS确证。并对合成工艺进行了优化。
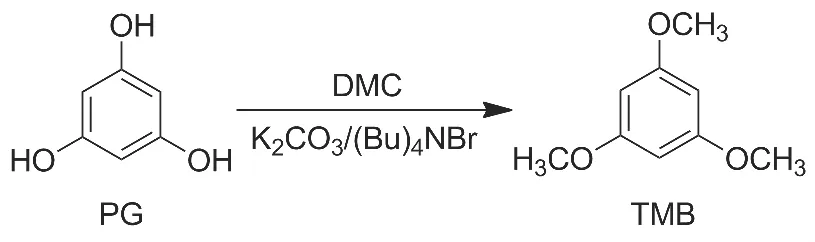
Scheme 1
该方法克服了传统合成方法的不足,提高了生产过程的安全性,为TMB的绿色合成提供了一条新的路径。
1 实验部分
1.1 仪器与试剂
AVANCEⅢ600 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker maXis UHR-TOF型液相色谱-超高分辨四极杆-飞行时间质谱(QTOF)联用仪。
所用试剂均为分析纯。
1.2 TMB 的合成
在反应瓶中依次加入PG 1.26 g(10 mmol),K2CO32.07 g(15 mmol),(Bu)4NBr 0.48 g(1.5 mmol),DMC 10.8 g(120 mmol)和 DMSO 15 mL,搅拌使其溶解;回流(160℃)反应24 h。冷却至室温,加入去离子水80 mL,搅拌30 min;用二氯甲烷(100 mL)萃取,萃取液用1 mol·L-1氢氧化钠溶液(2×100 mL)洗涤,蒸干后用石油醚重结晶得白色针状晶体 TMB,收率76.0%,m.p.52.5℃(52.5 ℃[3]);1H NMR δ:3.77(s,9H,OCH3),6.09(s,3H,ArH);13C NMR δ:161.55,92.93,55.36;HR-ESI-MS m/z:Calcd for C9H13O3{[M+H]+}168.085 9,found 168.085 8。与文献[3,16]报道一致。
2 结果与讨论
2.1 工艺条件优化
(1)相转移催化剂
在弱碱性条件下,以DMC为甲基化试剂,考察相转移催化剂的催化性能。
PG 10 mmol,其余反应条件同 1.2,分别以(Bu)4NBr,(Bu)4NOH,(Bu)4PCl,18-冠-6,PEG-800和PEG-2000作为相转移催化剂,考察其对反应的影响,结果见表1。由表1可见,无K2CO3且无相转移催化剂时,无TMB生成;仅在K2CO3催化下,TMB收率仅为16.7%,说明 K2CO3对 PG甲基化的催化活性较低;加入相转移催化剂后,在K2CO3/相转移催化剂体系下,TMB收率有明显提高,其催化活性顺序为(Bu)4NBr>18-冠-6>PEG-800>PEG-2000>(Bu)4PCl>(Bu)4NOH,其中在K2CO3/(Bu)4NBr体系下,TMB收率最高(61.3%)。故最佳的相转移催化剂为(Bu)4NBr。

表1 相转移催化剂对TMB收率的影响*Table 1 Effect of phase transfer catalysts on yield of TMB
(2)相转移催化剂用量
(Bu)4NBr为相转移催化剂,其余反应条件同2.1(1),考察(Bu)4NBr用量对反应的影响,结果见图1。由图1可见,随着(Bu)4NBr与PG摩尔比{r=n[(Bu)4NBr]∶n(PG)}增大,TMB 收率呈先升高后降低的趋势;当r=0.15∶1时,TMB收率达最高值61.3%;继续增加(Bu)4NBr用量反而减弱了反应活性,TMB收率降低。故最佳r为 0.15 ∶1。
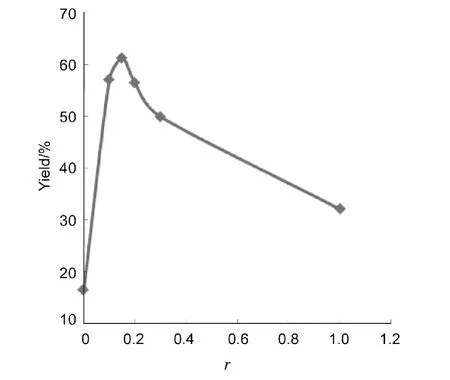
图1 r对TMB收率的影响*Figure 1 Effect of r on yield of TMB
(3)固体碱
r为0.15 ∶1,其余反应条件同 2.1(2),分别以固体碱 K2CO3,CaCO3,KHCO3和 KOH 与(Bu)4NBr组成催化体系,考察固体碱对TMB收率的影响,结果见表2。从表2可以看出,无固体碱催化剂时,TMB收率较低;不同固体碱对PG甲基化反应的催化活性顺序为:K2CO3>KHCO3>CaCO3>KOH。因此,最优的固体碱为K2CO3,即最佳的催化体系为K2CO3/(Bu)4NBr。

表2 固体碱对TMB收率的影响*Table 2 Effect of solid alkali on yield of TMB
(4)K2CO3用量
K2CO3为固体碱,反应条件同2.1(3),进一步考察K2CO3用量对TMB收率的影响,结果见图2。从图2可以看出,K2CO3用量较少时 TMB收率较低;随着K2CO3用量增加,TMB收率也随之迅速提高,在 K2CO3与 PG的摩尔比[γ=n(K2CO3)∶n(PG)]为1.5 ∶1时,TMB 收率较高(71.4%);此后随着 K2CO3用量的继续增加,TMB收率无明显提高,当γ>2.0时,收率反而略有下降。原因可能是随着K2CO3用量增加,反应体系碱性增强,加快了DMC的分解,从而导致TMB收率降低。故γ=1.5∶1较佳。
(5)反应温度
γ =1.5 ∶1,其余反应条件同 2.1(4),考察反应温度对TMB收率的影响,结果见图3。由于该反应是热力学吸热反应,升温有利于反应进行。从图3可以看出,随着反应温度升高,TMB收率逐渐增加,当反应温度为160℃,TMB收率最高(67.3%);再增加温度,TMB收率反而降低。其原因为温度过高时,一方面DMC容易气化挥发,导致TMB收率降低;另一方面温度过高时DMC易分解,同样不利于TMB收率的提高。故最佳的反应温度为160℃。
(6)DMC用量
反应温度为160℃,其余反应条件同2.1(5),考察DMC用量对TMB收率的影响,结果见图4。从图4可以看出,当 DMC用量较少时,TMB收率较低。随着DMC用量的增加,TMB收率逐渐提高,当n(DMC)/n(PG)=12时收率最高(76.2%);继续增大DMC用量,TMB收率基本不变。故n(DMC)/n(PG)=12较佳。

图2 γ对TMB收率的影响*Figure 2 Effect of γ on yield of TMB

图3 反应温度对TMB收率的影响*Figure 3 Effect of reaction temperature on yield of TMB

图4 DMC用量对TMB收率的影响*Figure 4 Effect of DMC dosage on yield of TMB
3 结论
以间苯三酚(PG)为原料,采用无毒的碳酸二甲酯(DMC)代替硫酸二甲酯和碘甲烷等传统剧毒试剂作为甲基化试剂,在K2CO3/(Bu)4NBr体系催化下,合成了1,3,5-三甲氧基苯。确定了最佳工艺条件为:PG 10 mmol,n(DMC)∶n[(Bu)4NBr]∶n(K2CO3)∶n(PG)=12 ∶0.15 ∶1.5 ∶1,于 160 ℃反应24 h,收率76.0%。
该合成工艺环境友好,克服了传统工艺毒性大、环境污染严重的缺陷,且操作简便,过程易于控制,具有良好的应用前景。
[1] 姜晔,张荣久.盐酸丁咯地尔的合成[J].中国医药工业杂志,1999,30(2):58 -59.
[2] 王泽民.当代结构药物全集[M].北京:北京科学技术出版社,1993:1417-1417.
[3] 胡益民,王修然,叶钟文,等.1,3,5-三甲氧基苯合成新方法研究[J].合成化学,1999,7(2):191 -193.
[4]冀亚飞,许忻,宗志敏,等.1,3,5-三甲氧基苯的合成[J].化学世界,2001,42(7):373 -374.
[5]黄志红.1,3,5-三甲氧基苯的合成[J].中国医药工业杂志,2005,35(11):676 -676.
[6]Asolkar R N,Kamat V P,Kirtany J K.Synthesis of maritimin,a chromone from Pancratiummaritimum[J].J Chem Res,2001,(12):549 -550.
[7]Catalán L E,Maturana E B,Marín KC,et al.Synthesis and antitumor activity of diterpenylhydroquinone derivatives of natural Ent-Labdanes[J].Molecules,2010,15(9):6502 -6511.
[8]Sagrera G,Seoane G.Total synthesis of 3',3‴-binaringenin and related biflavonoids[J].Synthesis,2010,2010(16):2776-2786.
[9]Ouk S,Thiebaud S,Borredon E,et al.O-Methylation of phenolic compounds with dimethyl carbonate under solid/liquid phase transfer system[J].Tetrahedron Lett,2002,43(14):2661 -2663.
[10] 吴婷,陈铎之,赵钊,等.芳甲醚的选择性合成及其结构表征[J].光谱实验室,2011,28(1):62-65.
[11]Chau K D N,Duus F,Le T N.Methyl esterification of carboxylic acids with dimethyl carbonate promoted by K2CO3/tetrabutylammonium chloride[J].Green ChemLett Rev,2013,6(1):89 -93.
[12]Bernini R,Crisante F,Ginnasi M C.A convenient and safe O-methylation of flavonoids with dimethyl carbonate(DMC)[J].Molecules,2011,16(2):1418-1425.
[13]Tilstam U.A continuous base-catalyzed methylation of phenols with dimethyl carbonate[J].Org Process Res Dev,2012,16(5):1150 -1153.
[14]Yadav G D,Salunke J Y.Selectivity engineering of solid base catalyzed O-methylation of 2-naphthol with dimethyl carbonate to 2-methoxynaphthalene[J].Catal Today,2013,207:180 -190.
[15]Selva M,Benedet V,Fabris M.Selective catalytic etherification of glycerol formal and solketal with dialkyl carbonates and K2CO3[J].Green Chem,2012,14(1):188-200.
[16]Yang J,Yang T,Luo Y,et al.The first total synthesis of tarennane,a potent antioxidant chalcone constituent from tarenna attenuate or magnolia officinalis[J].Letters in Organic Chemistry,2011,8(4):258-263.

