中药葛根微生物转化菌株的鉴定及转化特性的研究
宋艳秋,陈有为
(1.大理大学公共卫生学院,云南大理 671000;2.云南大学云南省微生物研究所,昆明 650091)
微生物转化是利用微生物代谢过程中产生的某个或某一系列的酶对底物进行催化反应〔1〕,具有选择性高、反应条件温和、副产品少等优点〔2〕。真菌在微生物中具有种类多、次生代谢产物多、并且具有分解多种营养物质的强大酶类等特点。因而成为中草药微生物转化的主要功能菌。利用微生物转化中草药,与一般的加工方法相比能大幅改变药性,提高疗效,降低毒副作用〔3〕。
葛根Pueraria lobata为豆科植物野葛或粉葛的根,葛根的有效成分主要是异黄酮类化合物(如葛根素、大豆素、大豆苷等),总黄酮具有扩张冠状动脉、增加冠状动脉血流量及降低心肌耗氧量等作用〔4〕。
在我国,葛根资源十分丰富,开展对中药材葛根的微生物转化研究,对提高其相关有效成分含量,产生新的活性成分,节省药源,减轻毒副作用等方面都必将具有重要的经济价值和社会意义。
通过反复筛选,获得1株能够较好转化葛根有效成分的丝状真菌,现将该菌株的分类鉴定结果及其转化中药葛根的前后化学成分和抑菌活性的变化报道如下。
1 材料与方法
1.1 材料
1.1.1 转化菌株 分离自福建省古田县红曲米,编号YM3207,保存于云南大学微生物研究所。
1.1.2 葛根 云南产中药,购于昆明市中药批发市场,经过云南省微生物研究所陈有为研究员鉴定为野葛Pueraria lobata(Willd.)Ohwi的根。
1.1.3 培养基
1)固体斜面培养基:马铃薯葡萄糖琼脂培养基(PDA)。
2)液体种子培养基:酵母膏肽,葡萄糖培养基(YPD)。
3)固体转化培养基(g/500 mL玻璃瓶):葛根干粉、水磨食米粉各20 g,起始含水量(相当于葛根干粉质量)50%。
4)菌落观察培养基:PDA平板培养基、察氏平板培养基、沙博弱氏培养基。
5)指示菌培养基:细菌类采用液体牛肉膏蛋白胨培养基;皮肤致病真菌类采用沙博弱氏培养基;植物致病真菌采用PDA培养基。
1.1.4 指示菌
1.1.4.1 细菌 YM1011大肠埃希氏杆菌Escherichia coli;YM1028藤黄八叠球菌Sarcina lutea;YM1029白色葡萄球菌Staphylococcus albus;YM1033结核分枝杆菌Mycobacterium tuberculosis。
1.1.4.2 皮肤致病真菌 YM3078皮炎单孢枝霉Hormodendrum dermatitidis;YM3096 疣状毛癣菌Trichophyton verrucosum;YM3099犬小孢子菌Microsporumcanis。
1.1.4.3 植物致病真菌 YM3031木霉Thrichoderma;YM3032棒束梗霉Isaria。
上述供试指示菌均由云南大学省微生物研究所提供。
1.2 方法
1.2.1 形态观察 取菌种斜面上少量孢子,分别点植于PDA培养基、察氏培养基、沙博弱氏培养基的平板上适当位置。(28±2)℃静置培养,观察菌落特征〔5〕。另取培养7 d后的YM3207菌体在Olympus BH-2型光学显微镜和S-3000N型扫描电镜下进行形态特征观察。
1.2.2 分子鉴定
1.2.2.1 菌株总DNA的提取 采用李绍兰等〔6〕的方法。
1.2.2.2 PCR反应及序列测定 PCR扩增使用的引物采用真菌核糖体基因转录间隔区通用引物ITS1和ITS4。ITS1和ITS4序列分别为:
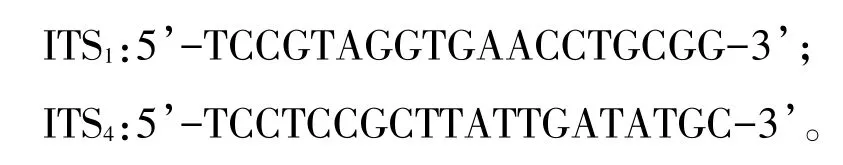
PCR扩增反应体系(50 μL)如下:PCR Buffer(×10,含20 mmol/L MgCl2)5 μL,10 mmol/L d NTP 4 μL,50 ng/μL DNA模板2 μL,5U Taq酶0.5 μL,50 pmol/L ITS1和50 pmol/L ITS4各2 μL,ddH2O 34.5 μL。反应条件为:94℃预变性4 min后进入循环,94℃1 min;54℃1 min;72℃2 min,共35个循环,最后72℃延伸10 min。扩增产物用1%的琼脂糖凝胶电泳检测,测序由北京三博远志生物技术有限公司完成。
1.2.2.3 ITS序列分析 将得到的ITS序列,用BLAST软件与GenBank中已知的ITS序列进行比对,用Clustal X〔7-8〕软件完成多序列比对,并通过MEGA3.1软件〔9-10〕中的 Kimura 2-parameter模型计算进化距离,Neighbor-Joining法构建系统发育树,1 000次数据随机抽样计算Bootstrap值,以评估系统发育树的置信度。
1.2.3 微生物转化实验 将活化好的斜面菌种接入三角瓶中(50 mL YPD培养基/200 mL三角瓶)(28±2)℃,200 r/min培养3 d,按10%的接种量接入固体转化培养基(40 g/500 mL玻璃瓶),于(28±2)℃静置培养14 d。培养结束后,于玻璃瓶中分别加入200 mL70%乙醇,浸提48 h,过滤,重复三次,合并浸提液,浓缩挥去乙醇得浸膏。
1.2.4 HPLC分析 色谱条件:根据文献〔11〕,色谱柱为Symmetry®C18柱(5 μm,4.6 mm×250 mm);流动相为甲醇-水梯度洗脱,洗脱条件见表1;检测波长:250 nm;流速:0.4 mL/min;柱温:室温;进样量:10 μL。
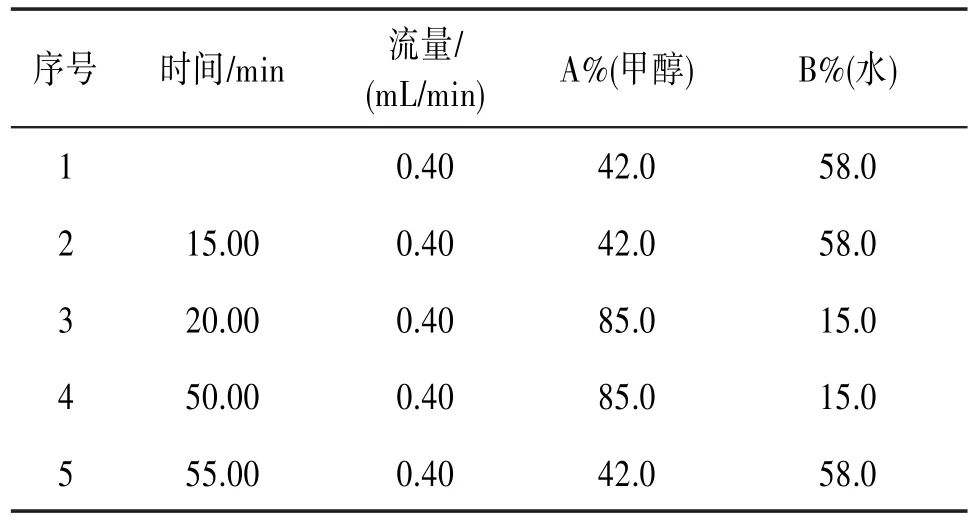
表1 流动相梯度洗脱程序
参照物溶液制备:采用染料木素、葛根素为参照物,精密称取,均制成浓度为1 mg/mL的参照物溶液。
样品制备:精确称取转化产物12.0 mg置于10 mL容量瓶中,甲醇定容。采用上述的提取方法提取葛根干粉的有效成分,精确称取葛根提取物11.3 mg置于10 mL容量瓶中,甲醇定容。
1.2.5 抑菌试验
1.2.5.1 样品的制备 将葛根提取物、转化产物分别配制成5 mg/mL的水溶液。
1.2.5.2 指示菌的培养 取指示菌的新鲜斜面培养物分别接5 mL无菌水稀释制成菌悬液。
1.2.5.3 滤纸片法(直径为8 mm) 分别取各指示菌液0.2 mL,涂布于培养基表面,凝固后分别放入蘸有上述两种样品的无菌滤纸片,细菌和皮肤致病真菌置于37℃,植物病原真菌置于28℃,培养48 h后,分别测量抑菌圈直径大小。
2 结果与分析
2.1 培养及形态特征 菌株YM3207在察氏培养基上菌株生长不是很理想,4 d后出现较少的淡红色菌丝,产红色素比较明显。PDA培养基上生长呈疮疤状,中间突起,24 h后,菌落为绒状白色透明,48 h后,菌落渐变为桔黄色至桔红色,最终成红紫色,背部边缘色素明显,呈深红色,有细长规则的辐射状褶皱。沙博弱氏培养基上气生菌丝绒长,菌落初为白色,48 h后逐渐变为桔黄色,最终为红色,反面呈菊花状辐射。
通过光学显微镜和扫描电镜观察,菌丝具横隔,多核,分枝甚繁,且不规律,菌丝体不生成与营养菌丝区别的分生孢子梗。分生孢子着生于菌丝及分枝顶端,单生或者2~6个成链。闭囊壳球形,有柄,柄长短不一。在显微镜下用测微尺测得菌丝直径约为3~7 μm,分生孢子球形或梨形,直径约为6~9 μm,子囊孢子卵形或椭圆形,无色,闭囊壳25~35 μm。如图1所示,综合上述观察研究结果,参照文献〔12-13〕将菌株YM3207鉴定为红曲霉属Monascus。
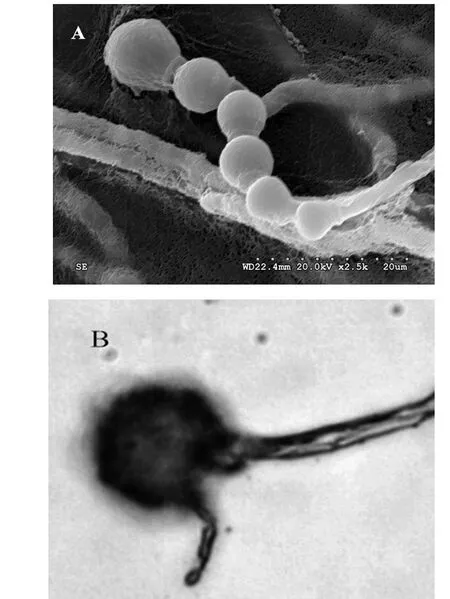
图1 菌株YM3207的形态特征
2.2 系统发育树的构建 对YM3207的ITS部分序列(535 bp)进行测序,以ITS序列为基础构建了包括YM3207在内的9株相关真菌的系统发育树(图2)。在系统发育树上可以看出,菌株YM3207与Monascus purpureus(AY498578)在同一分支上,同源性在99.9%以上。综上所述,通过菌株YM3207的菌落和显微形态特征及ITS序列分析,将该菌鉴定为紫色红曲霉Monascus purpureus。
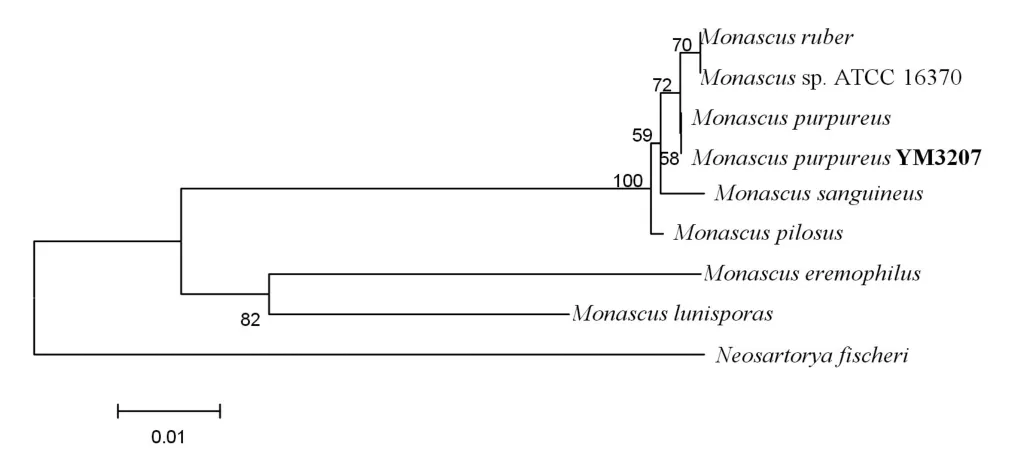
图2 菌株YM3207及从GenBank数据库中调集的相关种构建的以ITS序列为基础的系统发育树
2.3 HPLC分析结果 由HPLC检测图可知,在该色谱条件下,葛根素的保留时间为7.693 min,染料木素的保留时间为41.334 min。相同色谱条件下,在葛根提取物(C)和转化产物(D)的HPLC检测图中均可以找到相对应的峰,并且峰形比较完整,峰1、峰2分别为葛根素和染料木素。见图3。
通过计算可知,染料木素在葛根提取物中的百分含量是0.36%,而在转化产物中的含量为0.91%;葛根素在葛根提取物中的含量是4.1%,在转化产物中的含量达到了11.3%,都相应得到了提高。
2.4 抑菌试验结果 结果如表2所示,与葛根提取物比较,菌株YM3207转化产物抑菌活性有一定程度的增强,抗菌谱变广。尤其是对细菌的抑制活性增强较为明显。
3 讨论
本研究通过固态转化方式,对338株丝状真菌进行了反复筛选,最终得到一株能够较好转化葛根有效成分的丝状真菌YM3207,通过对其菌落和显微形态特征的观察,发现其具有典型的红曲霉属的形态特征,并根据ITS序列结果最终将该菌株鉴定为紫色红曲霉Monascus purpureus。
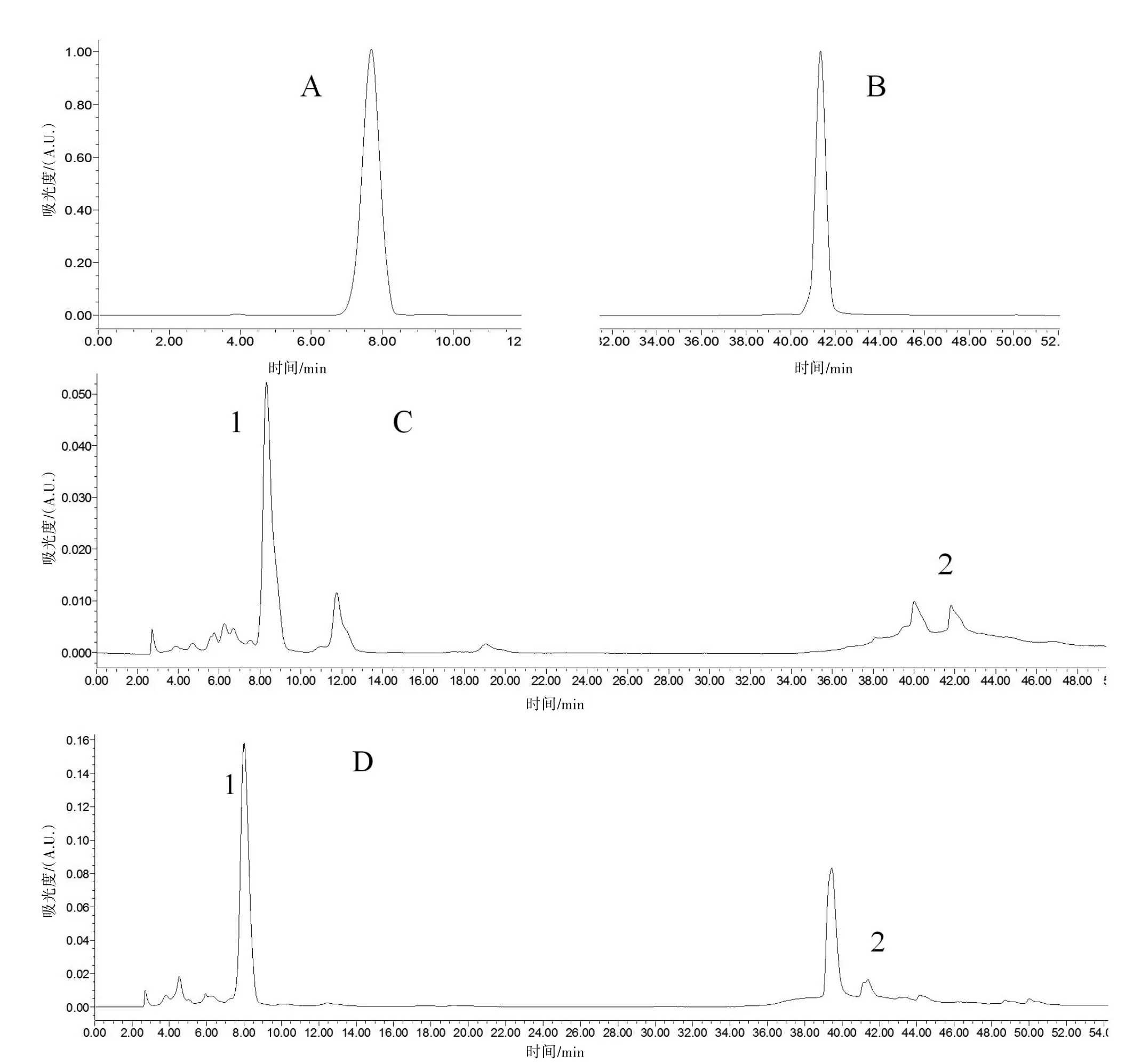
图3 葛根素(A)、染料木素(B)、葛根提取物(C)、转化产物(D)的HPLC图谱
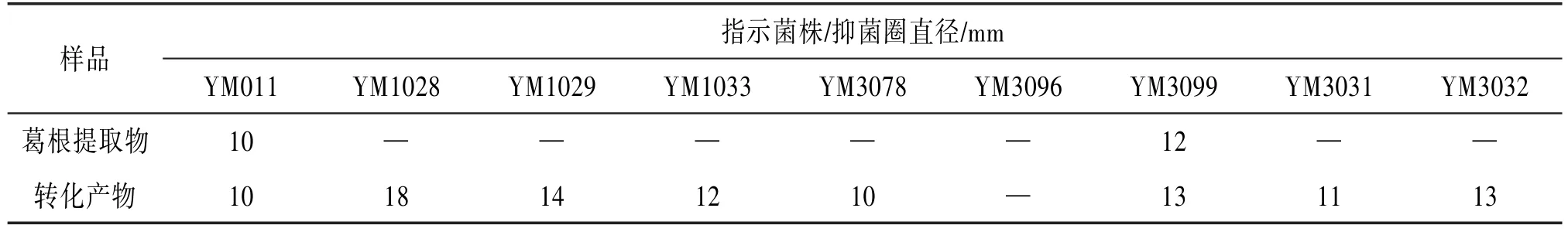
表2 葛根提取物和转化产物的抑菌试验结果
通过比较葛根乙醇提取物,菌株YM3207转化产物的HPLC图谱,可以发现通过菌株YM3207的转化作用,葛根的主要有效成分,在种类和量上发生了一定的变化,尤其是葛根素的含量得到了明显的提高。据文献报道〔14-15〕,不同产地的葛根其葛根素含量有所不同,但一般都只能到3%~4%,现经过微生物的转化,葛根素含量达到了11.3%。
异黄酮具有抑制细菌和真菌作用,异黄酮的浓度对抑菌效果有很大的影响〔16-17〕。抑菌试验的结果从另一个方面表明,通过微生物的转化作用,葛根中的一些化合物发生了变化,尤其是异黄酮类化合物相对含量得到提高,导致转化产物抑菌活性较转化前有一定程度的增强,抗菌谱变广。
综上所述,微生物转化完全有可能使中药中原来成分发生质和量的变化,利用微生物的代谢作用来提高中草药药效是可能的。
〔1〕LOUGHLIN W A.Biotransformation in organic synthesis〔J〕.Bioresource Technol,2000(74):49-62.
〔2〕占纪勋,钟建江,戴均贵,等.红豆杉愈伤组织中紫杉烷类成分sinenxan A的微生物转化研究〔J〕.药学学报,2003,38(7):555-558.
〔3〕唐燕红,张日俊.微生物在中草药添加剂中的应用研究进展〔J〕.中国饲料,2004(3):20-21.
〔4〕肖培根.新编中药志:卷1〔M〕.北京:化学工业出版社,2001:962-974.
〔5〕范秀容,李广武,沈萍.微生物学实验〔M〕.北京:高等教育出版社,1989:260-269.
〔6〕李绍兰,周斌,杨丽媛,等.真菌DNA提取方法的改良〔J〕.云南大学学报(自然科学版),2002,24(6):471-472.
〔7〕THOMPSON J D,GIBSON T J,PLEWNIAK F,et al.The Clastal X Windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools〔J〕.Nucleic Acids Research,1997(24):4876-4882.
〔8〕JEANNMOUGIN F,THOMPSON J D,GOUY M,et al.Multiple sequence alignment with Clustal X〔J〕.Trends Biochemistry Science,1998(23):403-405.
〔9〕KUMAR S,TAMURA K,JAKOBSEN I B,et al.MEGA2:Molecualr revolutionary genetics analysis software 〔J〕.Bioinformatics,2001(17):1244-1245.
〔10〕COMERON J M.A method for estimating the numbers of synonymous and nonsynonymous substitutions per site〔J〕.Journal of Molecular Evolution,1995(41):1152-1159.
〔11〕李绍平,李萍,季晖,等.天然与发酵培养冬虫夏草中核苷类成分的含量及其变化〔J〕.药学学报,2001,36(6):436.
〔12〕戴芳澜.真菌的形态和分类〔M〕.北京:科学出版社,1987:1-352.
〔13〕魏景超.真菌鉴定手册〔M〕.上海:上海科学技术出版社,1979:1-780.
〔14〕金文姗,谈钰元,陈有根,等.高效液相色谱法测定不同产地葛根中葛根素、大豆苷及大豆苷元的含量〔J〕.中国中药杂志,2003,28(1):49-51.
〔15〕张蕾,朱蓉贞,潘扬,等.不同品种及产地的葛根中葛根素含量的比较〔J〕.中国中药杂志,1995,20(7):399-400.
〔16〕谢明杰,陆敏,邹翠霞,等.大豆异黄酮的抑菌作用〔J〕.大豆科学,2004,23(2):101-105.
〔17〕井乐刚,张永忠,田璐.大豆异黄酮抑菌活性的研究〔J〕.哈尔滨师范大学自然科学学报,2004,20(1):79-81.

