氮掺杂的二氧化钛可见光催化降解水中含氮污染物的研究
张 瑶,李利辉,严 亚
(大理大学药学与化学学院,云南大理 671000)
随着社会的发展,环境污染越来越严重。来自生活污水和工农业废水的氮、磷进入水体,引发水体的富营养化,给工农业生产带来了巨大的损失,严重威胁着人类的健康与发展。在众多污水处理技术中,光催化氧化技术因其氧化能力强、无二次污染、耗能低、操作简单等优点而受到国内外研究者的广泛重视,成为污水处理的有效方法,有着广阔的应用前景〔1-5〕。目前,在多相光催化反应所使用的半导体催化剂中,二氧化钛(TiO2)以其无毒、催化活性高、氧化能力强、稳定性好最为常用。然而,由于TiO2的禁带较宽(Eg=3.2 eV),只有在波长较短的紫外光(波长<387 nm)照射下才能产生光生电子-空穴对,而这部分光能(300~400 nm)仅占到达地面上太阳光能的3%~5%左右,太阳能利用率很低〔3-6〕。为了提高TiO2对太阳能的利用率,研究者们采用多种方法对其进行改性。现有研究表明氮掺杂到TiO2中可显著提高TiO2的可见光催化活性〔6-8〕,但对氮掺杂二氧化钛(N-TiO2)的进一步应用研究较少。
在前期工作中,我们比较了不同氮源制备的N-TiO2的可见光催化活性,发现以硫脲为氮源,通过水热法制备的N-TiO2具有较高的可见光活性。因此,本研究选择硫脲为氮源,钛酸四丁酯为钛源,通过水热法制备不同掺氮量的N-TiO2,并在可见光照射下,以乙酰甲胺磷为含氮模型污染物,考察最佳配比的N-TiO2样品对水环境中的含氮污染物的可见光降解活性。
1 实验部分
1.1 试剂 冰醋酸和无水乙醇(天津市瑞金特化学品有限公司);硫脲和硝酸钾(天津市风船化学试剂科技有限公司);钛酸丁酯和过硫酸钾(国药集团化学试剂有限公司);浓硫酸(云南杨林工业开发区汕镇药业有限公司);罗丹明B(上海试剂三厂)。以上试剂除钛酸丁酯和罗丹明B为化学纯外,其余均为分析纯,所有试剂均直接使用,未作进一步处理。实验用水为去离子水。
1.2 仪器 N-TiO2的物相通过Rigaku D/Max 2550 VB/PC型X射线粉末衍射仪(XRD)测定;形貌采用JEOLJEM-2100F型场发射透射电子显微镜(FETEM)观察;降解产物的吸收光谱(UV-vis)和样品的固体紫外-可见漫反射谱(UV-vis DRS)采用北京普析TU-1901型紫外可见分光光度计(带积分球)测量;样品的荧光光谱通过日本Shimadzu RF-5301PC荧光分光光度计测量。
1.3 N-TiO2的制备 将8.5 mL的钛酸丁酯和8 mL无水乙醇混合,再加入硫脲,搅拌。待硫脲溶解后滴加3滴浓硫酸,强力搅拌下将168 mL冰醋酸加入,继续强力搅拌0.5 h。将所得混合液转入100 mL具有聚四氟乙烯内衬的高压反应釜内,加热反应釜至120°C并保温2 h,随后再升温至150°C晶化1 h。自然冷却至室温后,将所得混合物离心后弃去上层清液,剩余的固体物质用蒸馏水洗涤6~8次。经洗涤后的固体转入培养皿中,在电热鼓风干燥箱中于140 °C烘干,即得N-TiO2样品。
1.4 N-TiO2的可见光催化活性测试 采用1 000 W卤钨灯作为光源,装入有冷凝水夹套的石英管中以除去红外光,用滤光片滤去波长小于420 nm的光。光源距反应器中心为15 cm。具体测试过程如下:取50 mL 1.0×10-5mol/L的罗丹明B水溶液置于100 mL的石英烧杯中,加入0.090 g催化剂粉末,在暗处避光搅拌30 min,使催化剂和罗丹明B溶液达到吸附-脱附平衡。然后开启光源进行光催化反应。180 min后取反应液约5 mL进行离心分离,取其上层清液测其吸收光谱,罗丹明B的降解率通过公式(1)进行计算。
其中,D为降解率,A0为罗丹明B在最大吸收波长554 nm处的初始吸光度,A为罗丹明B经可见光催化降解后在554 nm处的吸光度。
1.5 N-TiO2对含氮污染物的可见光降解活性测定取25 mL预先配制好的浓度为1.50 mg/L的乙酰甲胺磷溶液于50 mL的烧杯中,加入0.150 4 g 1.0%N-TiO2,在1 000 W卤钨灯下进行可见光催化4 h,离心分离两次后取上层清液7 mL,采用过硫酸钾氧化-紫外分光光度法〔9〕,测定总氮含量。
2 结果与讨论
2.1 XRD分析 图1是所制备样品的XRD衍射谱图。为便于比较,锐钛矿TiO2的标准谱图(JCPDS Card File No.84-1286)也列于其中,见图1a。从图1b可观察到4个峰,其2θ值分别为25.4°、38.2°、47.9°和54.4°。和图1a相比,可确认这4个衍射峰对应于体心四方相锐钛矿TiO2的(101)、(004)、(200)和(105)晶面,未观察到金红石相TiO2的存在。和图1b相比,在1.0%N-TiO2的XRD衍射谱图中(图1c)仅出现锐钛矿TiO2的(101)、(004)、(200)、(105)晶面,且衍射峰明显窄化,表明氮的掺杂未改变TiO2的晶型,但增加了TiO2的结晶度。总之,XRD的测试结果表明:水热法制备的TiO2为体心四方相锐钛矿型结构,氮的掺杂并未改变TiO2的晶相结构,但使TiO2的结晶度增大。
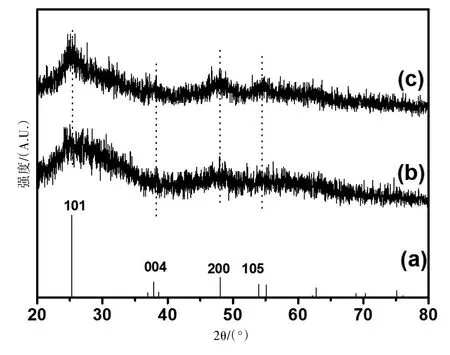
图1 样品的XRD衍射谱图
2.2 TEM分析 图2为所制备样品的TEM照片。由图2a可观察到未掺杂的TiO2为不规则的粒子,大量粒子团聚在一起,分散性很差,粒子大小不均,团聚体平均粒径约为70 nm。TiO2的晶格条纹(图2b)的存在表明所制备的TiO2粒子在纳米尺寸范围,晶面间距约为0.35 nm,对应于锐钛矿相TiO2的(101)晶面〔10〕。当氮掺杂到TiO2中后,由图2c可观察到N-TiO2的分散性较TiO2好,形貌、粒径也较均匀,团聚体平均粒径约为85 nm。图2d中(101)晶面间距约为0.34 nm。TEM的测试结果表明所制备的样品为锐钛矿型TiO2纳米粒子,氮的掺杂使TiO2的分散性更好,粒径更均匀。

图2 样品的TEM照片
2.3 N-TiO2的可见光催化活性 不同掺氮量的N-TiO2对罗丹明B的降解效率见图3。
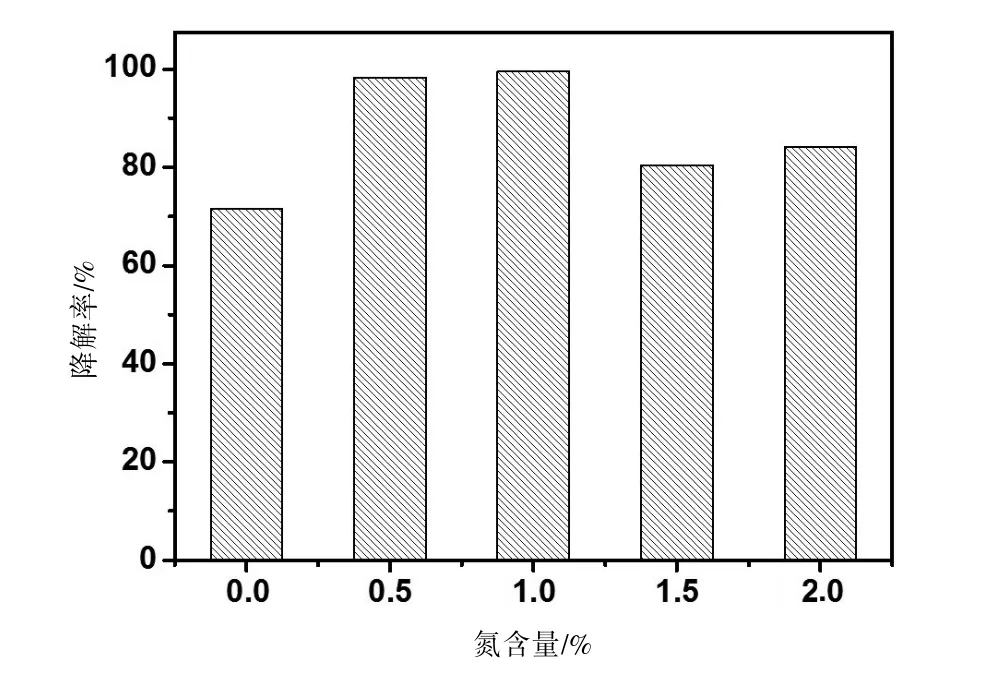
图3 不同掺氮量的N-TiO2对罗丹明B的降解效率(t=180 min)
为探讨氮的引入对TiO2的可见光催化活性的影响,我们测试了所制备样品的固体紫外-可见漫反射吸收谱(图4)和荧光光谱(图5)。
由图4可知:与TiO2的固体紫外-可见漫反射吸收谱相比(图4a),当氮的掺杂量为0.5%时,N-TiO2的吸收带边发生明显的红移,但420~850 nm范围的吸收却弱于TiO2(图4b);继续增加氮的掺杂量到1.0%时,N-TiO2的吸收带边相对于TiO2也发生了红移,而420~850 nm范围的吸收和TiO2相当(图4c);当氮的掺杂量增加到1.5%时(图4d),N-TiO2的吸收带边和1.0%N-TiO2的吸收带边相当,但420~850 nm范围的吸收却弱于TiO2;当氮的掺杂量到2.0%时(图4e),N-TiO2的吸收带边和420~850 nm范围的吸收都弱于TiO2。这一结果表明适量的氮掺杂到TiO2中以后,可使TiO2的带隙变窄,可见光响应增强,而过量的氮的引入,会减弱TiO2对可见光的吸收。
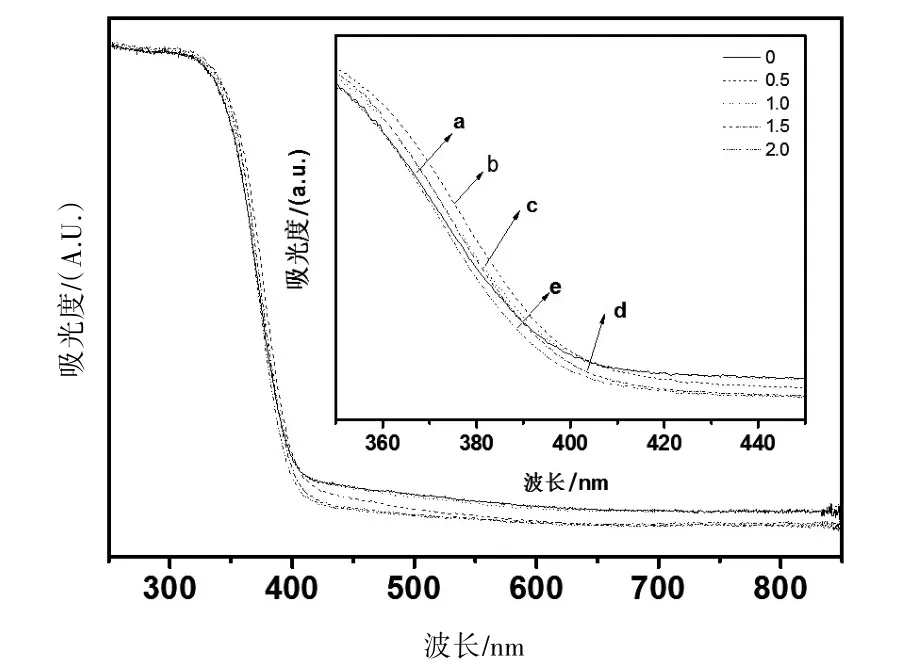
图4 N-TiO2的固体紫外-可见漫反射吸收谱
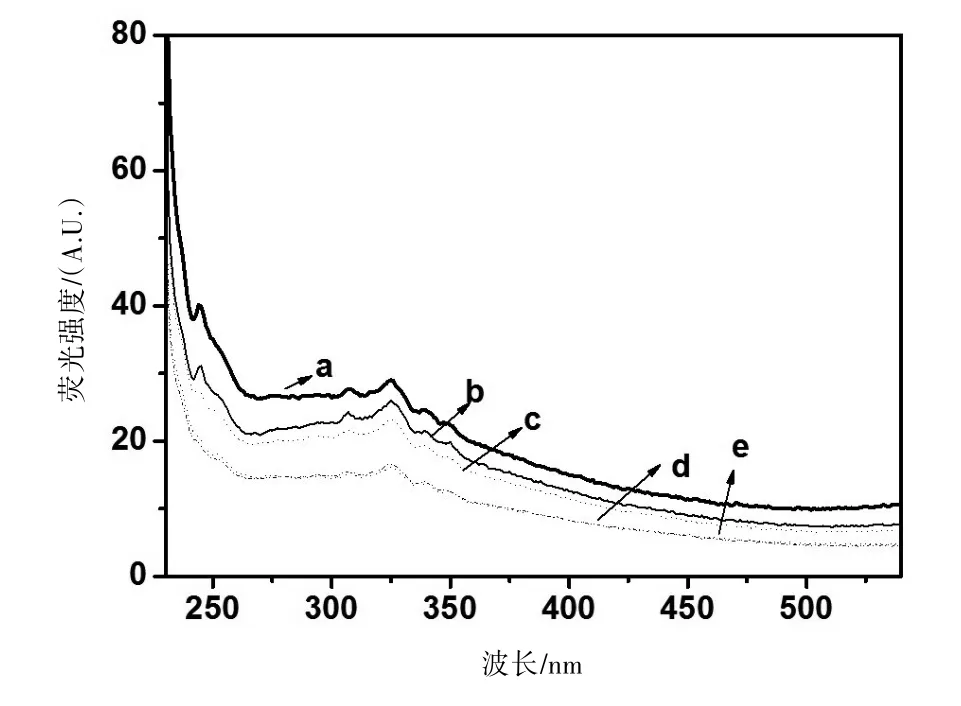
图5 N-TiO2的荧光光谱
从图5可观察到,掺氮后所得的N-TiO2样品,其荧光强度明显低于TiO2纳米粒子,并且随着氮的掺杂量的增加,N-TiO2的荧光强度逐渐降低,当氮的掺杂量达1.5%时,N-TiO2的荧光强度降至最低,继续增加氮的掺杂量到2%,N-TiO2的荧光强度不再改变。这一结果表明氮掺杂到TiO2的晶格后,延长了光生电子-空穴对的寿命,从而降低了电子-空穴对的复合机率。
以上实验结果表明,氮掺入到TiO2中后,一方面使TiO2的带隙变窄,可见光响应增强,另一方面,延长了光生电子-空穴对的寿命,降低了电子-空穴对的复合机率,因而适量氮的引入,可显著提高TiO2的可见光催化活性。
2.4 N-TiO2对水溶液中含氮污染物的降解 图6为总氮测定的工作曲线。
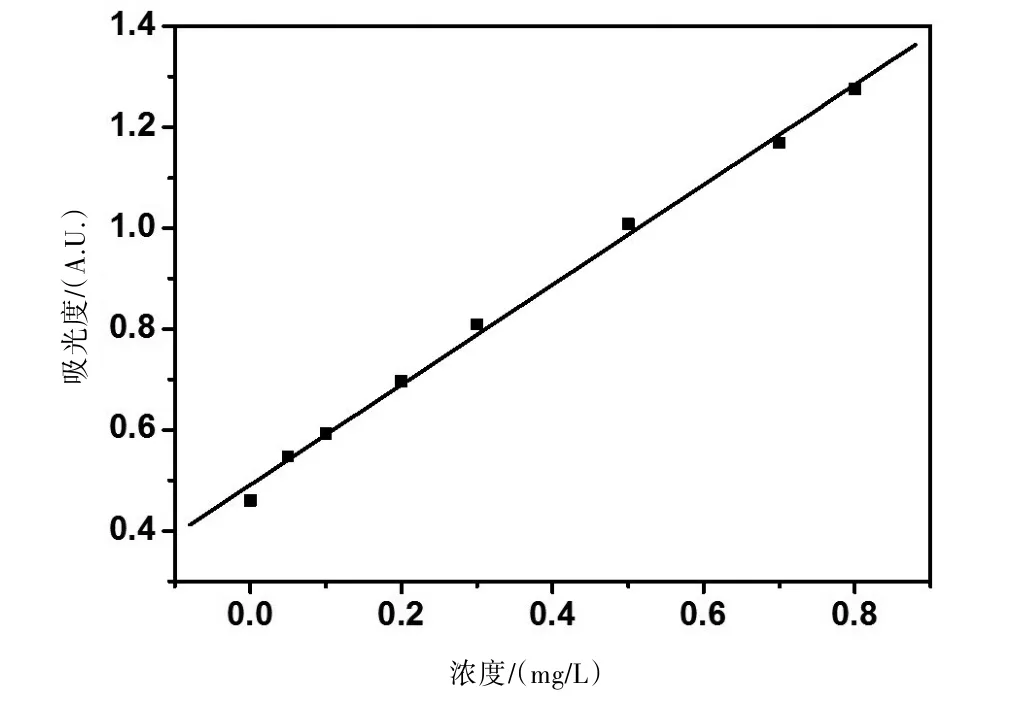
图6 测定总氮的工作曲线
线性拟合方程为:A=0.99c+0.49,R=0.998。
在TU-1901型紫外可见分光光度计上测定出吸光度A后,带入方程可求得浓度c,进而计算出总氮含量m,如表1所示。
由表1可知:可见光催化之后,水样中的总氮有明显的降解。根据《地表水环境质量标准》(GB3838-2002):Ⅳ类水总氮含量为1.5 mg/L,Ⅱ类水总氮含量为0.5 mg/L,因此,本实验中所制备的1.0%N-TiO2光催化剂,能在可见光下把Ⅳ类水降解至近Ⅱ类水。若降解时间进一步延长,催化剂用量进一步加大,总氮含量还可进一步降低。
3 结论
采用水热法,以硫脲为氮源,制备出氮含量不同的N-TiO2光催化剂。氮的引入,未改变TiO2的晶相结构,但使得TiO2的结晶度增大,分散性更好,粒径更均匀。适量氮掺杂到TiO2中时,可使TiO2的带隙变窄,可见光响应增强,同时,延长光生电子-空穴对的寿命,降低电子-空穴对的复合机率,因而可以在一定程度上提高TiO2的可见光催化活性。掺杂氮量为1.0%左右时,样品的可见光催化活性最高。1.0%N-TiO2可以使Ⅳ类水质的总氮含量降解至接近Ⅱ类水质。因此,N-TiO2能在可见光下对水中的含氮污染物进行有效降解,有望用于处理水环境中的含氮污染物。
〔1〕MARIO S.Photocatalysis and environment:trends and applications(Nato Science Series C:Mathematical and Physical Sciences)〔M〕.Dordrecht/Boston/London:Kluwer Academic Publishers,1988.
〔2〕CHONG M N,JIN B C,CHRISTOPHER W K,et al.Recent developments in photocatalytic water treatment technology:a review〔J〕.Water Research,2010,44(10):2997-3027.
〔3〕LEE S Y,PARK S J.TiO2photocatalyst for water treatment applications〔J〕.Journal of Industrial and Engineering Chemistry,2013,19(6):1761-1769.
〔4〕DONG H R,ZENG G M,TANG L,et al.An overview on limitations of TiO2-based particles for photocatalytic degradation of organic pollutants and the corresponding countermeasures〔J〕.Water Research,2015,79:128-146.
〔5〕RAMIREZ R J,ARELLANO C A P,VARIA J C,et al.Visible light-induced photocatalytic elimination of organic pollutants by TiO2:a review〔J〕.Current Organic Chemistry,2015,19(6):540-555.
〔6〕ZHANG W,JIA B P,WANG Q Z,et al.Visible-light sensitization of TiO2photocatalysts via wet chemical N-doping for the degradation of dissolved organic compounds in wastewater treatment:a review〔J〕.Journal of Nanoparticle Research,2015,17(5):221(1-12).
〔7〕DEVI L G,KAVITHA R.A review on nonmetal ion doped titania for the photocatalytic degradation of organic pollutants under UV/solar light:Role of photogenerated charge carrier dynamics in enhancing the activity〔J〕.Applied Catalysis B-Environmental,2013,140(8):559-587.
〔8〕胡裕龙,刘宏芳,郭兴蓬.氮掺杂二氧化钛光催化剂的研究进展〔J〕.硅酸盐学报,2010,38(3):535-541.
〔9〕国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法〔M〕.4版.北京:中国环境科学出版社,2002:254-257.
〔10〕YANG X,XU L L,YU X D,et al.One-step preparation of silver and indium oxide co-doped TiO2photocatalyst for the degradation of rhodamine B〔J〕.Catalysis Communications,2008,9(6):1224-1229.

