DL-赖氨酸-β-环糊精/碳纳米管修饰电极的制备与应用研究
赵志伟 申贵隽谷灵燕
(大连大学环境与化学工程学院,辽宁大连116622)
DL-赖氨酸-β-环糊精/碳纳米管修饰电极的制备与应用研究
赵志伟 申贵隽*谷灵燕
(大连大学环境与化学工程学院,辽宁大连116622)
对DL-赖氨酸-β-环糊精/碳纳米管修饰金电极的制备与应用进行了研究,建立了一种新的测定DL-赖氨酸的电化学分析方法。用循环伏安法研究了该修饰电极的选择性和灵敏度以及DL-赖氨酸在修饰电极上的氧化还原特性,结果表明该修饰电极对DL-赖氨酸具有显著的催化还原和选择作用。在pH=5.6的磷酸盐缓冲溶液中,还原峰电流与DL-赖氨酸浓度在5~100mg/L范围内呈良好的线性关系,最低检出限为0.1mg/L。方法操作简便,可用于药剂中DL-赖氨酸含量的测定。
β-环糊精;多壁碳纳米管;修饰电极;DL-赖氨酸
0 前言
赖氨酸(Lysine)是人体必需氨基酸之一,在食物中含量甚低,加工过程中极易破坏,又不能在体内合成,但是它不仅是合成体内蛋白不可缺少的成分,而且还参与体内的能量代谢等过程,因此广泛应用于食品、饲料和医药工业。
目前,测定赖氨酸的方法有DBL法[1]、茚三酮比色法[2]、近红外光谱分析法[3]、FDNB法[4]、胍基反应法[5]、荧光分析法[6]、染料法[7]、分光光度法[9]、毛细管电泳法[10]等,但是这些方法大多涉及贵重的仪器和复杂的操作,并且灵敏度不高,使用受到限制,而电化学方法操作简单,快速,成本低廉,并且能够克服这些缺点,可以被应用于赖氨酸的测定。但是,未修饰的电极对赖氨酸的选择性和灵敏度差,并且反应缓慢[10],因此,通过电聚合的方法将具有空腔结构的β-环糊精[11-12]和DL-赖氨酸共同修饰于电极表面,然后把具有导电催化效应的羧基化多壁碳纳米微管滴涂到电极表面,定量测定药剂中的赖氨酸含量。这种修饰电极制作简单,并有良好的稳定性和重现性,测定结果较为理想,与未修饰的金电极相比较,它具有选择性好、灵敏度高、线性范围宽等优点。
1 实验部分
1.1 仪器和试剂
CHI600C电化学工作站(上海辰华仪器公司);三电极系统:金电极(天津艾达恒晟科技发展有公司)或修饰电极为工作电极,参比电极为饱和甘汞电极(天津市兰力科化学电子高技术有限公司),对电极为铂电极(天津艾达恒晟科技发展有限公司);KQ-100DB型数控超声波清洗器(昆山市超声仪器有限公司);离心沉淀机80-1型(上海机械手术厂);pHB-1型酸度计(上海宇隆仪器有限公司);FA1604型分析天平(上海雷韵试验仪器制造有限公司)。
多壁碳纳米管(纯度>95%,Φ8~15nm,中国科学院成都有机化学研究所);β-环糊精(天津市盛铭宝商贸有限公司);DL-赖氨酸(中国惠兴生化有限公司);磷酸二氢钠-磷酸氢二钠(PBS缓冲溶液,自制)。赖氨肌醇维B口服溶液(济川药业股份有限公司);所有试剂均为分析纯,实验用水为去离子水。
1.2 修饰电极的制备
1.2.1 金电极预处理
将金电极在金相砂纸上打磨,然后在麂皮垫上依次用1.0,0.3和0.05μm的Al2O3粉末抛光,依次用无水乙醇和水充分超声清洗。将处理后的电极置于1.0mol/L的H2SO4溶液中,以50mV/s扫描速度,在-0.2~+1.6V电位区间用循环伏安法(CV)扫描直至稳定[13]。将电极取出后用去离子水冲洗干净,然后将清洗完毕的电极保存在去离子水中备用。
1.2.2 DL-赖氨酸-β-环糊精/多壁碳纳米管修饰电极的制备
将5mLβ-CD(5×10-3mol/L),5mL DL-lys(100mg/L)和5mL H2SO4(0.5mol/L)混合到一起超声反应15min,然后以金电极为基体电极,在此介质中,溶液静置条件下。以100mV/s的扫描速度,-0.6~1.0V电位范围之间,通过循环伏安法扫描20圈至CV曲线稳定,然后取出电极,经去离子水淋洗电极表面,在红外灯下干燥。
采用V(HNO3)∶V(HCl)=1∶3回流12h的方法将MWNTs羧基化,用NaOH(0.01mol/L)洗至pH值为近中性时止,离心后干燥。称取5.0mg预处理过的MWNTs于5.0mL DMF(N,N-二甲基甲酰胺)中超声分散30min,最后得到稳定的黑色分散液。取适量滴在DL-赖氨酸-β-环糊精修饰电极的表面,红外灯下烘干即制得DL-lys-β-CD/MWNTs修饰电极,放在PBS缓冲溶液中保存,待用。
1.2.3 对比修饰电极制备
将5mL DL-赖氨酸(100mg/L),5mL去离子水和5mL H2SO4(0.5mol/L)混合到一起超声反应15min,其它实验步骤同1.2.2,即得到DL-lys/MWNTs修饰电极;将5mLβ-CD(5×10-3mol/L),5mL去离子水和5mL H2SO4(0.5mol/L)混合到一起超声反应15min,其它实验步骤同1.2.2,即得到β-CD/MWNTs修饰电极。
2 结果与讨论
2.1 电聚合膜的循环伏安法表征
以为探针分子,分别测定了裸金电极,β-CD/MWNTs修饰电极,DL-Lys/MWNTs修饰电极、MWNTs修饰电极,DL-Lys-β-CD/MWNTs修饰电极的循环伏安图(图1)。图1中,K3[Fe(CN)6]探针分子在裸金电极上的氧化峰与还原峰对称性良好,具有良好的可逆性,而在DL-Lys-β-CD/MWNTs修饰电极(曲线e)上的氧化峰正移,峰型变宽,峰电流显著减小,甚至还原峰消失,探针分子在修饰电极上的可逆性严重减弱。可能由于修饰电极表面β-CD和氨基酸形成的包络物分子含-COOR基团,具有较高的负电荷密度,因此这种静电排斥抵制铁氰化钾到达修饰电极的表面,从而阻止其在电极表面的电子传递。这表明,DL-Lys-β-CD/MWNTs修饰电极表面的电活性物质增加[11],电极表面已经形成了一定覆盖率的膜层,抑制了K3[Fe(CN)6]探针分子向金电极表面的扩散,可以证明电极的修饰结果较好[14-15]。此外,曲线e与b,c,d相比较,曲线b,c,d三者几乎相同,并且与曲线a的峰电流相差不大,这说明只有DL-Lys,β-CD和MWNTs共同修饰于金电极表面时,才会有较好的修饰效果。
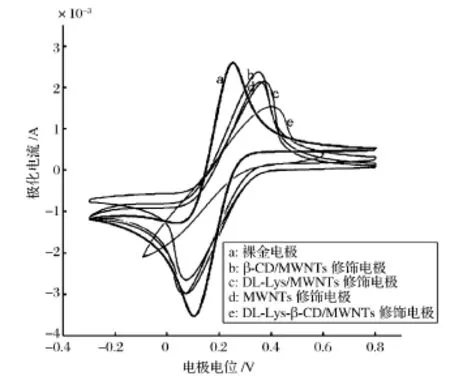
图1 不同电极在铁氰化钾中的循环伏安响应曲线Figure 1 Cyclic voltammograms of different electrodes in Potassium ferricyanide solution.
2.2 DL-Lys-β-CD/MWNTs修饰电极的电化学性能2.2.1 灵敏度
将裸金电极和不同的修饰电极,以50mV/s的扫描速度,在-0.8~1.0V电位范围之间,用循环伏安法扫描20mg/L的DL-lys,结果如图2所示。图3为DL-lys在修饰电极表面可能发生的氧化还原反应。图2中,该修饰电极的氧化峰电流很小,是由于在酸性介质中H+对DL-lys的氧化反应起到了抑制作用,金电极优先失去了电子[16];还原峰产生较大的峰电流是因为DL-lys在电极表面发生了加氢的还原反应,生成了醛基化合物。同时,DL-Lys-β-CD/MWNTs修饰电极的峰电流的绝对值最大,较裸金电极高出两个数量级,较其它修饰电极高出两倍左右,说明该修饰电极具有较好的灵敏度。此外,与曲线a相比,曲线b,c,d相差不多,表明该修饰电极灵敏度提高是由于DL-Lys和β-CD的共同作用,而不是因为DL-lys和β-CD的单独作用或电极在酸性介质中循环扫描活化的影响。

图2 不同修饰电极在DL-赖氨酸中的循环伏安图Figure 2 Cyclic voltammograms of different modified electrodes in DL-lysine solution.
2.2.2 选择性
以DL-Lys-β-CD/MWNTs修饰电极,分别在PBS缓冲底液、DL-赖氨酸(20mg/L)、L-色氨酸、DL苯丙氨酸和DL-谷氨酸介质中,以50mV/s的扫速,在-0.6~1.0V电位范围内用循环伏安法扫描,结果如图4所示。图4中,与缓冲溶液峰电流相近的依次是DL-谷氨酸,DL-苯丙氨酸,L-色氨酸和DL-赖氨酸,同时,赖氨酸与其它氨基酸的峰电位相差0.08V左右。氨基酸的峰电流与缓冲溶液越接近,表明修饰电极对该种氨基酸的响应值越差,并且它们之间的峰电位有明显的区别,证明了DL-Lysβ-CD/MWNTs修饰电极对DL-赖氨酸具有良好的选择性。

图3 DL-lys在修饰电极上的化学反应Figure 3 Chemical reactions of DL-lys on the modified electrodes.
2.3 实验条件优化
在pH=4.8~6.4范围内改变底液的pH值,测定DL-Lys-β-CD/MWNTs修饰电极上20mg/L的DL-lys的峰电流。DL-lys的还原峰电流绝对值大小在pH=4.8~6.4范围内先增大后减小,在pH=5.6时达到最大,故选择pH=5.6的PBS为最佳底液。在20~160mV/s范围内改变扫描速率进行实验,100mV/s时峰电流的绝对值最大,故实验选择100mV/s的扫描速率。用DL-Lys和β-CD修饰电极,扫描次数为20时,峰电流的绝对值最大,故选择实验的最佳扫描次数为20次。

图4 修饰电极在不同氨基酸中的循环伏安图Figure 4 The cyclic voltammogram of modified electrode in the different amino acids solutions.
2.4 工作曲线、重线性和稳定性
在最佳实验条件下,用循环伏安法对不同浓度的DL-赖氨酸标准溶液进行了定量测定,浓度在5~100mg/L范围内的线性关系为I(μA)=0.734 2C-335.08,相关系数Y=0.966 8,最低检出限为0.1mg/L,如图5所示。图5中,峰电位随着DL-lys浓度的增加而增大,这个实验结果与能斯特方程反映的规律完全一致。
用DL-Lys-β-CD/MWNTs修饰电极对20mg/L的DL-赖氨酸标准溶液连续测定10次,测定结果的相对标准偏差(RSD)为2.5%,说明该修饰电极重现性良好。
DL-Lys-β-CD/MWNTs修饰电极在室温、空气流通的条件下保存14d,对DL-lys标准溶液响应电流基本不变,说明该电极具有较好的稳定性。
2.5 样品分析及加标回收实验
在最佳实验条件下,对赖氨肌醇维b12口服液经稀释处理后得到50mg/L的样品溶液,用修饰好的电极连续测定3次,并在样品中加入DL-赖氨酸标准溶液进行加标回收实验,结果见表1。实验结果表明,该修饰电极对DL-赖氨酸的测定,具有较好的准确度和精密度。

图5 DL-lys标准溶液的循环伏安图与标准曲线Figure 5 The cyclic voltammograms of DL-lys standard solutions and standard curve.

表1 样品测定及回收率实验Table 1 Determination of the sample and results of recovery test /(mg·L-1)
3 结论
论文研究了DL-赖氨酸在DL-赖氨酸-β-环糊精/碳纳米管修饰电极上的电化学行为。由于环糊精与DL-赖氨酸之间强烈的相互作用,共同修饰于电极表面后,增加了对DL-赖氨酸的响应,而且多壁碳纳米管具有大的比表面积以及较多的活性位点,能够提高DL-赖氨酸检测的灵敏度,使得DL-赖氨酸在DL-lys-β-CD/MWNTs修饰金电极上显示了很好的氧化还原活性。修饰电极具有选择性好、灵敏度高、电化学稳定性好和抗干扰能力强等优点,表现出优越的导电性能。该修饰电极可用于测定药剂中的DL-赖氨酸,并将具有较好的应用前景。
[1]罗伟胜,甄海,黄炽林,等.以DBL法作为GQA-31型谷物品质分析仪定标方法测定稻米的赖氨酸含量[J].氨基酸杂志,1991,17(3):42-44.
[2]刘飞飞,李群,于岚.茚三酮比色法定量检测赖氨酸条件的研究[J].中国食品添加剂,2010,21(5):223-225,234.
[3]孙通,徐惠荣,应义斌 .近红外光谱分析技术在农产品/食品品质在线无损检测中的应用研究进展[J].光谱学与光谱分析,2009,29(1):122-126.
[4]Carpenter K J.The estimation of the available lysine in animal-protein foods[J].Biochemical Journal,1960,77(3):604.
[5]Blom L,Hendricks P,Caris J.Determination of available lysine in foods[J].Analytical biochemistry,1967,21(3):382-400.
[6]Goodno C C,Swaisgood H E,Catignani G L.A fluorimetric assay for available lysine in proteins[J].Analytical Biochemistry,1981,115(1):203-211.
[7]Perl I M,Szakács M P,Kvágó,et al.Stoichiometric dye-binding procedure for the determination of the reactive lysine content of soya bean protein[J].Food chemistry,1985,16(2):163-174.
[8]邱光葵,薛茂杰 .赖氨酸的快速分光光度测定[J].分析化学,1989,17(10):906-908.
[9]王力,冯珍鸽,骆聪婷,等.毛细管电泳-电化学发光分离检测饮料中L-赖氨酸[J].中国食品学报,2011,11(4):224-228.
[10]刘有芹,颜芸,沈含熙 .化学修饰电极的研究及其分析应用[J].化学研究与应用,2006,18(4):337-343.
[11]侯晓兰,申贵隽,刘倩,等.β-环糊精/碳纳米管修饰电极上盐酸异丙嗪的电化学行为研究[J].分析科学学报,2011,27(5):603-606.
[12]王宗花,刘军,颜流水,等 .羧基化碳纳米管嵌入石墨修饰电极对多巴胺和抗坏血酸的电催化[J].分析化学,2002,30(9):1053-1057.
[13]杨秋霞,李国宝,张颖.维生素B_1自组装膜修饰金电极对多巴胺、尿酸的电催化作用[J].分析化学,2009,37(7):1004-1008.
[14]Green T A,Quickenden T I.Calorimetric studies of highly loaded deuterides and hydrides of palladium[J].Journal of Electroanalytical Chemistry,1995,389(1):91-103.
[15]Green T A,Quickenden T I.Electrolytic preparation of highly loaded deuterides of palladium[J].Journal of Electroanalytical Chemistry,1994,368(1):121-131.
[16]孙凯,孙登明 .黄嘌呤和尿酸在修饰电极上的电化学行为及测定研究[J].分析化学,2014,42(7):991-996.
Preparation and Application of DL-lysine-β-cyclodextrin/Carbon Nanotube Modified Electrode
ZHAO Zhiwei,SHEN Guijun*,GU Lingyan
(College of Environmental and Chemical Engineering,Dalian University,Dalian,Liaoning116622,China)
A DL-lysine-β-cyclodextrin/carbon nanotube modified gold electrode was prepared and its application was studied.Based on this,a new electrochemical analysis method was developed for the determination of DL-lysine.The selectivity and sensitivity of the modified electrodes and the oxidation reduction properties of DL-lysine on the modified electrodes were investigated by cyclic voltammetry.The results showed that the modified electrodes exhibited significant catalytic reduction and selectivity for DL-lysine.A good linear relationship between the reductive peak current and the concentration of DL-lysine in the range of 5~100mg/L was obtained in phosphate buffer solution with pH=5.6,and the detection limit was 0.1mg/L.The method is simple and can be used for the determination of DL-lysine content in medicament.
β-cyclodextrin;multiwall carbon nanotubes;modified electrode;DL-lysine
O657.1;TH832
:A
:2095-1035(2015)01-0070-05
2014-09-24
:2014-11-13
大连市科技计划项目(2012E15-8F169)资助
赵志伟,男,学生。E-mail:18042656813@163.com
*通信作者:申贵隽,男,教授,硕士生导师,主要从事电分析化学分析方面研究。E-mail:sgj0501@163.com
10.3969/j.issn.2095-1035.2015.01.020

