短芒披碱草异位保护群体的表型多样性研究
顾晓燕,郭志慧,张新全,周凯,周朝杰,符开欣,刘新,马啸
(四川农业大学动物科技学院草业科学系,四川 雅安 625014)
短芒披碱草异位保护群体的表型多样性研究
顾晓燕,郭志慧,张新全,周凯,周朝杰,符开欣,刘新,马啸*
(四川农业大学动物科技学院草业科学系,四川 雅安 625014)
为揭示采集自川西北高原的短芒披碱草野生异位保存群体的表型变异规律,采用变异系数、巢式方差分析、主成分分析、聚类等方法,对川西北短芒披碱草种质资源共7个居群84个单株的32种表型性状进行多样性分析。结果表明,短芒披碱草表型性状在种群间和种群内存在极其丰富的多样性,种群间表型分化系数均值为41.66%,小于种群内变异(58.33%);茎秆、叶片、花序、小穗、颖片和内外稃的表型分化系数均值分别为55.92%,63.18%,38.62%,43.73%,31.45%和33.08%。穗部性状的稳定性较高。除第一颖长和外稃脉数外,其余性状与各地理生态因子间的相关性均不显著。利用群体间欧氏距离进行的UPGMA聚类分析结果表明,7个短芒披碱草野生群体可以划分为4类。Mantel相关分析表明地理距离与种群表型距离(欧氏距离)间相关不显著(r=0.334,P=0.083)。
短芒披碱草;川西北高原;表型多样性
披碱草属(Elymus)是禾本科(Poaceae)小麦族(Triticeae)中最大和分布最广泛的属,全世界共有150多个种,广泛分布于温带地区[1]。短芒披碱草(Elymusbreviaristatus)为丛生型多年生禾草,是由StYH基因组构成(2n=6x=42)的异源六倍体物种[2]。它属于青藏高原乡土性的草种,主要分布在海拔3000~3600 m的川西北高原和青海省的部分地区,抗逆性强、饲草品质优良,已经用于人工草地建植及野生草地改良[3-5]。由于分布范围狭窄及生境条件日趋恶化,短芒披碱草已经被列为国家Ⅱ级重点保护野生植物[6]。
遗传多样性可以在表型、染色体、等位酶、DNA等多个层次进行研究[7]。表型多样性作为遗传多样性研究的重要线索,是指特定群体在其分布区域内不同环境下的表型变异,是由遗传多样性与环境多样性综合作用才体现出来的。尽管已有大量的研究是通过分子标记对植物种质资源的遗传多样性进行分析,但由于表型多样性具有观测直观以及测量简单等特点,因而仍是种质资源研究的最基本方法和途径。表型多样性的研究是通过有效采用遗传上较为稳定且不易受环境影响的性状以及合理的数学统计,进而来揭示群体的遗传规律及变异大小,有助于更好地理解物种适应机制,最终为群体的保护提供理论支持[8-9]。
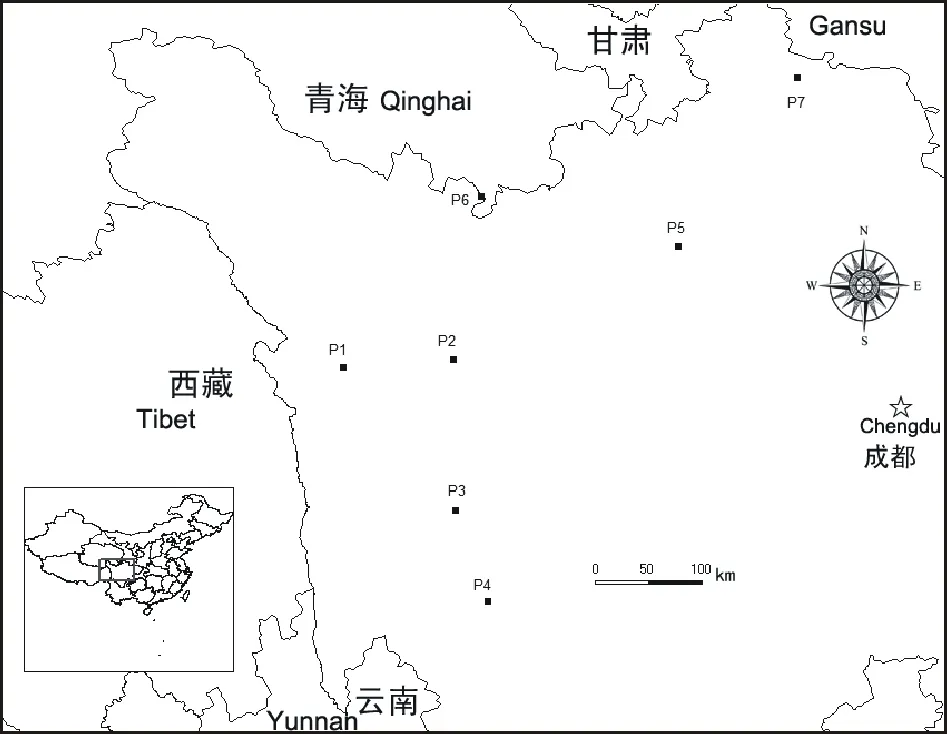
图1 供试短芒披碱草群体的来源Fig.1 Locations of the E. breviaristatus populations used in this study
短芒披碱草(E.breviaristatus)作为国家二级保护植物,国内外与其有关的遗传背景研究几乎未见报道。利用表型性状对披碱草属及其近缘物种的表型多样性研究已有不少报道[10-18]。袁庆华等[12]发现我国北方老芒麦(E.sibiricus)野生种质间在形态和农艺性状上差异明显,生物多样性丰富。严学兵等[15]认为穗形状等14个形态指标可用于国产披碱草属植物的系统分类。德英等[16]发现我国披碱草属牧草种质在穗部性状上居群内变异度占主导。Erickson等[17]认为北美粉绿披碱草(E.glaucus)不同种质间的固定表型变异与地理来源和生境存在高度相关。Mizianty[18]分析了波兰本地的犬草(E.caninus)种群的形态变异,发现每小穗的小花数可以区分两种形态类型(“pauciflorum”和“caninus”)。本研究的目的是通过分析川西北高原不同地理来源的短芒披碱草种群的表型多样性,为其种质资源保存、优异种质挖掘以及为后续分子遗传多样性的研究奠定基础。
1 材料与方法
1.1 试验材料
试验材料为四川农业大学2011年采集自四川甘孜州和阿坝州的短芒披碱草居群材料(表1,图1)。采集时按每株取一单穗单独保存,单穗所在的株丛间距不低于5 m。每个居群采集10~20个单株(单穗)。2012年每穗取单粒种子至培养箱,待其发芽成苗后移栽至四川省草原科学研究院红原牧草育种基地内。

表1 供试短芒披碱草野生种群的地理、生态信息
1.2 表型性状的选取和测定方法
2013年7-9月观测单株的形态性状并记录。在植株成熟期选取了32个反映植株表型特征的性状(7项茎部形态学指标和25项穗部形态学指标)进行表型性状的测定,具体指标详见表2。并求出均值、标准差以及材料间变异系数CV(%)。每个群体观测12株,每个单株随机取3个分蘖枝进行重复观测。其中株高用卷尺测量植株从地面到植株最高处距离,茎部形态指标以及花序长用直尺测量,测量精度为0.1 cm,其余指标均用游标卡尺测量最长处和最宽处,作为其长度和宽度,测量精度为0.01 cm。

表2 形态学性状
PH: Plant height; CL: Culm lengh; NN: Number of nodes; LL: Flag leaf length; LW: Flag leaf width; LL2: Length of second leaf from the culm apex; LW2: Width of second leaf from the culm apex; SL: Spike length; SN: Number of nodes; SKN2: Number of spikelets on node-second from the spike apex; SKNM: Number of spikelet on node-at middle part of spike; SKNL: Number of spikelet on node-lowest; ILM: Internode length in the middle part of spike; SKL2: Length of spikelet-at the node from the spike apex; FSK2: Number of florets per spikelet-at the node from the spike apex; SKLM: Length of spikelet-at middle part of spike; FSKM: Number of florets per spikelet-at middle part of spike; SKLL: Length of spikelet-lowest; FSKL: Number of florets per spikelet-lowest; LGL: Length of lower glume; LGW: Width of lower glume; LGAL: Length of the awn of lower glume;VLG: Numer of veins of lower glume; UGL: Length of upper glume; UGW: Width of upper glume; UGAL: Length of the awn of upper glume; LML: Length of lemma; LMW: Width of lemma; LMAL: Length of the awn of lemma; NVLM: Number of veins of lemma; PL: Length of palea; PW: Width of palea. 下同The same below.
1.3 数据统计分析
对7个群体不同单株的短芒披碱草各性状的变异程度和显著性按巢式设计进行方差分析,比较短芒披碱草群体间和群体内的差异,其线性模型[19]为:
Yijk=μ+Si+T(i)j+ε(ij)k
式中,Yijk为第i个小群体第j个单株第k个观测值;μ为总平均值;Si为第i个小群体的效应值;T(i)j为群体内第i个小群体第j个单株的效应值;ε(ij)k为试验随机误差。
表型分化系数(Vst)是与遗传分化系数(Gst)相对应的参数,其主要是用于反映群体间表型分化程度[19]。按照下列公式计算表型分化系数:

用SPSS 13.0计算性状均值、标准差、变异系数(CV)以及分析表型性状之间和表型性状与生态环境因子的相关性。用变异系数表示性状值离散程度;巢式方差分析由软件DPS v13.5计算群体间的欧氏距离,并进行类平均法(UPGMA)聚类[20]。基于Mantel检验分析群体间的欧氏距离与地理距离的相关性[21]。
2 结果与分析
2.1 短芒披碱草群体间形态变异特征
由32个性状的均值比较(表3)可以看出,短芒披碱草的形态特征在群体间存在差异。比较群体间均值发现,花序中部穗节小穗数(SKNM)等5个穗部性状均以Pop1居群最大;茎节数(NN)、第1叶宽(LW)、第2叶宽(LW2)和花序长(SL)等2个穗部性状均以Pop4最大;剩余性状均以Pop2、Pop5、Pop6居群最大,而且这3个居群的大部分性状均值都较大。花序顶起第2穗节的小穗数(SKN2)和小穗长(SKL2)以Pop1居群最小;茎节数(NN)和外稃芒长(LMAL)以Pop2最小;花序底部穗节小穗数(SKNL)等3个穗部性状以Pop4最小;其他性状均以Pop3和Pop7居群最小,而且这2个居群的大部分性状均值都较小。由此可见,说明各个性状在不同群体内表现出的多样性程度因环境不同而有差异。
本试验采用巢式方差分析,研究川西北高原短芒披碱草在群体间和群体内的表型多样性及差异显著性。由表4得出,短芒披碱草的32个表型性状,在群体间有6个穗部性状差异不显著,其余性状均为极显著。第1叶宽(LW)F值最大(25.903);在群体内有4个穗部性状差异不显著,其余性状都达显著或极显著,外稃宽(LMW)F值最大(3.053)。可见,短芒披碱草表型性状在群体间和群体内都存在广泛差异,性状可能受环境影响较大。
2.2 短芒披碱草群体内形态变异特征
对短芒披碱草群体内和群体间的形态性状变异系数进行计算(表5),各表型性状的变异大小不同,通过比较发现,在群体内以第1颖芒长(LGAL)的变异度最大,以外稃长(LML)的变异度最小;而在群体间以第1颖脉数(VLG)的变异度最大,以花序顶起第2穗节小穗长(SKL2)的变异度最小。说明与其他性状相比较,外稃性状的稳定性较高,而第1颖的稳定性最差。各群体间形态特征的平均变异系数从大到小依次为:Pop3>Pop2>Pop6>Pop5>Pop7>Pop4>Pop1,Pop3的变异系数(24.55%)最大,说明其表型多样性较丰富;Pop1的变异系数(15.00%)最小,表明其表型多样性较低。从表2~5可以看出,以株高(PH)为例,其最大变异系数出现在Pop6中,而最小值在Pop3中,说明32个居群的最大或最小变异系数分布在不同的群体中。并且从表5可以看出,群体内和群体间变异系数的均值分别为18.02%和14.09%,表明短芒披碱草群体内表型多样性高于群体间。
2.3 短芒披碱草野生群体间表型分化
按巢式设计方差分量比组成了各方差分量占总变异的比例, 用种群间方差分量占总变异(即种群间种群内方差分量之和)的百分比表示种群间的表型分化系数。从表6可以看出,32个表型的分化系数的变异幅度为2.74%~95.05%,这说明了短芒披碱草的种群内表型变异大于种群间表型变异。进一步计算茎秆、叶片、花序、小穗、颖片和内外稃的表型分化系数均值分别为55.92%,63.18%,38.62%,43.73%,31.45%和33.08%, 从而可以看出颖片和稃片最为稳定, 这与变异系数分析的结果类似。茎秆和叶片相关的性状平均表型分化系数均超过50%, 说明这两类性状以种群间变异为主,而穗部性状则以种群内变异为主。由茎秆、叶片和穗部等32个表型性状的平均值可以看出,种群间的方差分量占总变异的17.32%,种群内是22.14%,随机误差是60.54%。32个表型性状的平均表型分化系数是41.66%,说明川西北短芒披碱草野生种群表型变异在种群间的贡献占41.66%, 种群内的贡献占58.33%,表明短芒披碱草野生种群表型性状在种群内的多样性大于种群间的多样性。
2.4 短芒披碱草居群表型性状与生态环境因子的相关性
将短芒披碱草的32个表型性状与取样地的地理生态因子进行偏相关分析与检验。在所有性状中,除第1颖长(LGL)和外稃脉数(NVLM)外,其余性状与各地理生态因子的相关性均未达到显著水平。第1颖长与海拔呈显著负相关(r=-0.916);外稃脉数与海拔呈显著负相关(r=-0.906);外稃脉数还与年降水量呈显著正相关(r=0.929)、与年均温度呈极显著负相关(r=-0.967),表明外稃脉数同时受到海拔、年降水量以及年均温度的综合影响。

表3 短芒披碱草居群的形态性状均值和标准差

表4 短芒披碱草野生种群间和种群内的表型性状方差分析
2.5 主成分分析
本试验对短芒披碱草的32个形态学性状进行主成分分析,获得了所有性状的特征值、累积贡献率等参数 (表7)。结果发现,前4个主成分方差累计贡献率高达89.27%,能代表原来32个性状指标所包含的大部分变异信息,其中第1主成分占总变异的比率为34.52%,对其影响最大的性状是花序中部穗节小穗小花数 (FSKM)、花序中部节间长 (ILM)和花序长(SL);第2主成分占26.08%,对其影响最大的性状是第2颖长 (UGL)、花序底部穗节小穗数 (SKNL)和第2颖宽(UGW);第3主成分占18.22%,对其影响最大的性状是外稃长(LML);第4主成分占10.45%,影响最大的性状为第1颖宽(LGW),均为正向标。以上分析说明前4个主成分主要都反映了穗部性状的信息。

表5 短芒披碱草各表型性状的变异系数
2.6 聚类分析
基于居群间32个性状的欧氏平均距离,采用非加权配对算术平均法(UPGMA)对短芒披碱草7个群体的表型性状进行聚类分析,构建聚类图(图2)。分析表型性状聚类图后发现,7个自然居群聚成了4支,其中Pop1和Pop7首先聚成了一支,来自理塘的Pop3和Pop4聚在一起,Pop2单独聚成一支。经Mantel矩阵相关性分析,地理距离与种群表型距离(欧氏距离)间相关不显著,相关系数为r=0.334,P=0.083(图3)。

表6 短芒披碱草表型性状的方差分量及表型分化系数
3 讨论
3.1 群体间和群体内的表型变异特征
表型变异研究是遗传多样性研究的先导[22]。袁庆华等[12]对采集自我国西北地区的21份野生老芒麦居群进行表型多样性研究,结果表明居群间各表型具有显著差异,表型性状受生境条件和空间距离的双重影响。严学兵等[14-15]和鄢家俊等[13]研究也发现不同地理来源的老芒麦种质具有丰富的表型多样性。披碱草属植物的演化十分复杂,在长期演化及生境变化的过程中,各物种基因库形成于不同的自然选择压力,导致物种的演化式样存在巨大差别,并且可以体现在种内不同居群间的形态分化上[23]。本研究虽然短芒披碱草野生种群的规模远小于一般披碱草属物种,但其表型多样性依然十分丰富,各性状在群体间和群体内存在着广泛变异,这可能是自身遗传因素和环境因子共同作用的结果。短芒披碱草与老芒麦除芒的长短可以区分外,其他形态特征比较相似[3,24],本研究采集得到的短芒披碱草标本外稃芒长均值为4.51 mm,这符合中国植物志中的记录(2~5 mm),而且供试标本具有披碱草属中的典型小颖组的特征,即花序较密集、下垂,颖长2.1~3.8 mm,外稃芒3.0~5.5 mm;内稃稍长于外稃,先端渐急等特征[25]。

表7 前4个主成分的特征值、变异贡献率和各形态性状的特征向量

图2 基于欧氏距离的UPGMA聚类图Fig.2 UPGMA dendrogram based on Euclidean distance showing relationships among 7 populations of E. breviaristatus
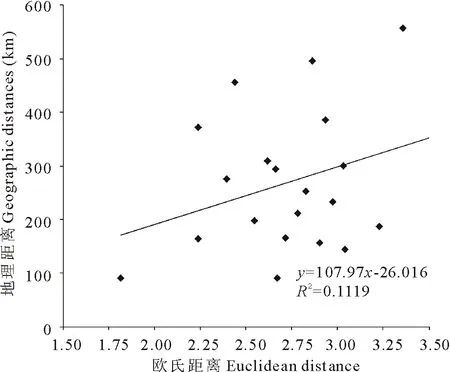
图3 短芒披碱草居群间欧氏距离和地理距离的矩阵相关性Fig.3 The correlations matrix between Euclidean distance and geographic distances among 7 populations of E. breviaristatus
变异系数可以在消除量纲的情况下间接反映不同群体在不同性状上的变异程度。严学兵等[14-15]发现披碱草属各形态指标在种内的变异系数变化很大。王海清等[26]比较分析4种披碱草属植物18个野生居群的形态特征,结果表明同一居群内或不同居群间的变异程度不均衡。本研究发现同一性状的变异系数在不同群体间存在较大差异,各群体间平均变异系数从大到小依次为:Pop3>Pop2>Pop6>Pop5>Pop7>Pop4>Pop1。各形态性状的变异系数对不同群体差别很大,而且同一群体内不同性状之间的变异度也比较高。一般而言,物种分布区广,则其群体间变异较大,物种分布区小,则变异较小,因为物种会由于生境广、种类繁多、物种间激烈竞争以及迫于环境的选择压力较易发生变异[16]。本研究发现,供试材料在大部分形态性状方面均出现了较大的变异,变异系数均大于10%,其中变异相对较小(<15%)的是株高(PH)、茎秆长(CL)、茎节数(NN)、第2叶长(LL2)、花序长(SL)、花序节数(SN)、花序中部穗节小穗数(SKNM)、花序顶起第2穗节小穗数(SKN2)、花序中部和底部穗节小穗长(SKLM、SKLL)、第1颖宽(LGW)、第2颖长(UGL)、内稃长和宽(PL、PW)这14个性状,而外稃长(LML)的变异度最小(9.65%)。这表明在评价短芒披碱草种质时,只有在大量材料中才可能筛选出具有植株高大、叶片宽大、种子产量高等性状的优异育种材料。
不同来源地植物群体间由于环境的选择压力不同以及地理隔离使得群体间基因交流较少,各群体就会逐渐形成相对比较稳定的表型特征;同时,植物群体的遗传分化造成各群体内优势基因型频率不同,这进一步维持或强化了表型性状在群体间的不同程度的差异[27]。本研究中,短芒披碱草种群的平均表型分化系数为41.66%,即群体内多样性高于群体间,表型变异以群体内为主。群体内的多样性程度大于群体间往往是植物对不同环境选择适应的结果[8-10]。鄢家俊等[13]对川西北高原野生老芒麦居群的15个穗部性状进行了基于香农指数的多样性分析,结果表明居群间变异仅为30.69%。德英等[16]对采集自我国的105个野生披碱草属居群的14个穗部形态指标进行多样性研究,结果表明居群间表型分化系数为27.89%。与老芒麦及其他披碱草属物种相比较,短芒披碱草居群间的表型分化系数较高。Hamrick 和Godt[28]统计了165个属、449个种自花授粉植物的遗传多样性水平,认为自花授粉物种的遗传变异主要发生在居群之间,而异花授粉物种则相反。由此我们可以认为短芒披碱草可能是存在较高异交率混合繁育系统物种,群体内变异程度较高。植物群体间变异的意义较群体内大,因为群体间的变异是经过不同环境自然选择的结果,能真正反映地理或生态环境对种群变异的影响以及群体对环境的适应性[17,29]。
3.2 表型变异与生态地理因子的关系以及聚类、主成分分析
表型多样性是对遗传多样性在形态水平上进行的探讨,其反映的是群体遗传变异及其对环境压力适应的能力。本研究发现,短芒披碱草表型性状与取样地的地理生态因子的相关度不高,仅第一颖长(LGL)和外稃脉数(NVLM)受海拔、年降水量以及年均温度的影响。而严学兵等[14]认为披碱草属植物形态特征除受遗传决定外,受海拔和降水等生长环境的影响也很大。这可能与本研究中的供试材料生境参数差异不大有关。
各群体依据欧氏平均距离值再基于UPGMA法聚类,可以划分成4支,但地理距离与欧氏距离的相关性不高,地理距离较远的Pop1和Pop7聚成一支,这两个居群有较突出的特征,如其植株矮小,叶片较短,穗较小;Pop5和Pop6聚成一支,突出特征如植株高大,叶片宽大,茎秆粗,穗状花序较粗等;Pop2单独聚成一支,其具有叶片长,小穗小花数多,第2颖长等较突出的特点。来自理塘的Pop3和Pop4也聚在一起,这可能与其生境的相似性有关。对植物分类形态指标进行主成分分析,可以消除常见形态指标间的线性化[20]。本研究中前4个主成分主要反映了穗部性状的信息。由此可见,穗部形态是引起表型变异的主要性状,并且这些性状主要反映的是与牧草种子产量和分类相关的指标特征。因此,对短芒披碱草种质的表型性状进行主成分分析,可为其形态类型鉴定和优良种质选育提供依据。
3.3 种质资源保护策略
丰富的种质资源是植物育种学研究的重要基础,其中表型在鉴定植物种属间亲缘关系和种群生物学分析中发挥了重要作用。本研究发现川西北短芒披碱草居群内的表型多样性较为丰富,是优良种源和单株选择的基础,因此在进行种质采集时应该以居群为单位,对现有种群生境进行就地保护,在每个居群中收集尽可能多单株的种子,尽量涵盖该居群的基因库,最大程度地保护短芒披碱草的遗传多样性。另外,短芒披碱草为具有较高异交率的自花授粉植物,筛选出优异种质并且进一步进行自交纯化,利用系统选育法培育表现优异的纯系或利用其作亲本进行杂交育种,选育适合用于青藏高原地区的优良牧草品种。
[1] Lve A. Conspectus of the Triticeae. Feddes Repertorium, 1984, 95: 425-521.
[2] Zhou Y H, Zheng Y L, Yang J L,etal.Phylogenetic relationships among tenElymusspecies based on random amplified polymorphic DNA. Acta Phytotaxonomica Sinica, 1999, 37(5): 425-432.
[3] Zhang T L, Su X, Cai L B. Reduction onElymussinosubmuticusbased on the external morphology and micromorphological characteristics of leaf blades. Acta Botanica Boreali-Occidentalia Sinica, 2008, 28(7): 1333-1338.
[4] Du Y H, Zhou X L, Wang J F. Study on the growth performance of four gramineous forages in alpine area. Pratacultural Science, 2010, 27(8): 166-168.
[5] Shi J J, Ma Y S, Dong Q M,etal.The selection experiment of fine forages in ‘black soil type’ degraded grasslands. Acta Agrestia Sinica, 2007, 15(6): 543-549, 555.
[6] Zhang Q Y, He X J. Conservation of rare and endangered plants in Sichuan. Journal of Wuhan Botanical Research, 2002, 20(5):387-394.
[7] Jin Y, Lu B R. Sampling strategy for genetic diversity. Biodiversity Science, 2003, 11:155-161.
[8] Zhang R L, Jia Y, Zhang Q X. Phenotypic variation of natural populations ofPrimuladenticulatassp.sinodenticulata. Biodiversity Science, 2008, 16(4): 362-368.
[9] Li P P, Meng H L, Chen J W,etal.Phenotypic diversity in populations of germplasm resources ofRodgersiasambucifoliaand related species. Acta Ecologica Sinica, 2012, 32(24):7747-7756.
[10] Lan B X, Li L H, Wang H. Genetic diversity ofAgropyronmongolicumKeng populations. Scientia Agricultura Sinica, 2005, 38(3): 468-473.
[11] Shi Y W, Gao A N, Liu J G,etal. Diversity of morphological traits inRoegneriasinicavar.mediaKeng populations of Triticeae. Journal of Plant Genetic Resources, 2009, 10(4): 547-552.
[12] Yuan Q H, Zhang J Y, Zhang W S,etal. Biodiversity of native populations ofElymusdahuricusandElymussibiricus. Acta Prataculturae Sinica, 2003, 12(5): 44-49.
[13] Yan J J, Bai S Q, Ma X,etal.Ear character diversity of native populations ofElymussibiricusin the northwest plateau of Sichuan province. Acta Prataculturae Sinica, 2007, 16(6): 99-106.
[14] Yan X B, Wang K, Wang C Z,etal. Morphological differentiation and taxonomic module construction forElymusL. plants. Acta Agrestia Sinica, 2009, 17(3): 274-281.
[15] Yan X B, Zhou H, Wang K,etal. Morphological diversities of the different species ofElymusspp. and their principal component analysis. Acta Agrestia Sinica, 2005, 13(2):111-116.
[16] De Y, Mu H B, Liu X L,etal. Morphological diversity of plant ear among 8 wildElymusspp.. Pratacultural Science, 2011, 28(9): 1623-1631.
[17] Erickson V J, Mandel N L, Sorensen F C. Landscape patterns of phenotypic variation and population structuring in a selfing grass,Elymusglaucus(blue wildrye). Canadian Journal of Botany, 2004, 82: 1776-1789.
[18] Mizianty M. Variability and structure of natural populations ofElymuscaninus(L.) L. based on morphology. Plant Systematics and Evolution, 2005, 251: 199-216.
[19] Ge S, Wang M X, Chen Y W. An analysis of population genetic structure of masson pine by isozyme technique. Scientia Silvae Sinicae, 1988, 24(11): 399-409.
[20] Tang Q Y, Zhang C X. Data processing system (DPS) software with experimental design, statistical analysis and data mining developed for use in entomological research. Insect Science, 2013, 20(2): 254-260.
[21] Mantel N. The detection of disease clustering and a generalized regression approach. Cancer Research, 1967, 27(2): 209-220.
[22] Huang C Q, Liu G D, Bai C J,etal. A study on the morphological diversity of 475 accessions ofCynodondactylon. Acta Prataculturae Sinica, 2012, 21(4): 33-42.
[23] Yang R W, Zhou Y H, Zheng Y L. Comparison of morphology and esterase isozyme among typespecies ofElymus,RoegneriaandHystrix(Poaceae: Triticeae). Journal of Sichuan Agricultural University, 2000, 18(4): 291-295.
[24] Lu H S, Xu Z, Ma Y B. Morphological identification and cluster analysis of spike-drooping germplasmofElymus. Journal of Yunnan Agricultural University (Natural Science), 2008, 23(2): 150-157.
[25] Su X, Liu Y P, Wu X M. Biosystematic relationships and leaf anatomical characteristics of three sects’ plants inElymus(Poaceae). Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(6): 1148-1154.
[26] Wang H Q, Xu Z, Qi J. A comparative study on morphological variation of four species inElymusL.. Chinese Journal of Grassland, 2009, 31(3): 30-35.
[27] Chen L, Yang X G, Song N P,etal.A study on variations in leaf trait of 35 plants in the arid region of middle Ningxia, China. Acta Prataculturae Sinica, 2014, 23(1): 41-49.
[28] Hamrick J L, Godt M J W. Conservation genetics of endemic plant species[A]. In: Avise J C, Hamrick J L. Conservation Genetics, Case Histories from Nature[M]. New York: Chapman and Hall, 1996.
[29] Daniel L H, Andrew G C. Principles of Population Genetics, Fourth Edition[M]. Sunderland, MA: Sinauer Associates, Inc., 2007.
参考文献:
[2] 周永红, 郑有良, 杨俊良, 等. 10种披碱草属植物的RAPD分析及其系统学意义. 植物分类学报, 1999, 37(5): 425-432.
[3] 张同林, 苏旭, 蔡联炳. 根据形态和叶片微形态特征讨论无芒披碱草的归并. 西北植物学报, 2008, 28(7): 1333-1338.
[4] 杜玉红, 周学丽, 王建锋. 高寒地区4种禾本科牧草的生产特性比较. 草业科学, 2010, 27(8): 166-168.
[5] 施建军, 马玉寿, 董全民, 等. “黑土型”退化草地优良牧草筛选试验. 草地学报, 2007, 15(6): 543-549, 555.
[6] 张桥英, 何兴金. 四川省珍稀濒危植物及其保护. 武汉植物学研究, 2002, 20(5): 387-394.
[7] 金燕, 卢宝荣. 遗传多样性的取样策略. 生物多样性, 2003, 11: 155-161.
[8] 张睿鹂, 贾茵, 张启翔. 滇北球花报春天然群体表型变异研究. 生物多样性, 2008, 16(4): 362-368.
[9] 李萍萍, 孟衡玲, 陈军文, 等. 云南岩陀及其近缘种质资源群体表型多样性. 生态学报, 2012, 32(24): 7747-7756.
[10] 兰保祥, 李立会, 王辉. 蒙古冰草居群遗传多样性研究. 中国农业科学, 2005, 38(3): 468-473.
[11] 史冀伟, 高爱农, 刘津刚, 等. 小麦族中间鹅观草不同居群的形态多样性分析. 植物遗传资源学报, 2009, 10(4): 547-552.
[12] 袁庆华, 张吉宇, 张文淑, 等. 披碱草和老芒麦野生居群生物多样性研究. 草业学报, 2003, 12(5): 44-49.
[13] 鄢家俊, 白史且, 马啸, 等. 川西北高原野生老芒麦居群穗部形态多样性研究. 草业学报, 2007, 16(6): 99-106.
[14] 严学兵, 王堃, 王成章, 等. 不同披碱草属植物的形态分化和分类功能的构建. 草地学报, 2009,17(3): 274-281.
[15] 严学兵, 周禾, 王堃, 等. 披碱草属植物形态多样性及其主成分分析. 草地学报, 2005,13(2): 111-116.
[16] 德英, 穆怀彬, 刘新亮, 等. 披碱草属8种野生牧草居群穗部形态多样性. 草业科学, 2011, 28(9): 1623-1631.
[19] 葛颂, 王明庥, 陈岳武. 用同工酶研究马尾松群体的遗传结构. 林业科学, 1988, 24(11): 399-409.
[22] 黄春琼, 刘国道, 白昌军, 等. 475份狗牙根种质资源形态多样性的研究. 草业学报, 2012, 21(4): 33-42.
[23] 杨瑞武, 周永红, 郑有良. 披碱草属、鹅观草属和猬草属模式种的形态学变异和酯酶同工酶分析. 四川农业大学学报, 2000, 18(4): 291-295.
[24] 卢红双, 徐柱, 马玉宝. 披碱草属穗型下垂类种质的形态学鉴定及其聚类分析. 云南农业大学学报, 2008, 23(2): 150-157.
[25] 苏旭, 刘玉萍, 吴学明. 披碱草属3组植物叶片解剖特征及其系统关系. 西北植物学报, 2012, 32(6): 1148-1154.
[26] 王海清, 徐柱, 祁娟. 披碱草属四种植物主要形态特征的变异性比较. 中国草地学报, 2009, 31(3): 30-35.
[27] 陈林, 杨新国, 宋乃平, 等. 宁夏中部干旱带主要植物叶性状变异特征研究. 草业学报, 2014, 23(1): 41-49.
Phenotypic variations in seven ex-situ conservation populations ofElymusbreviaristatus
GU Xiao-Yan, GUO Zhi-Hui, ZHANG Xin-Quan, ZHOU Kai, ZHOU Chao-Jie, FU Kai-Xin, LIU Xin, MA Xiao*
TheCollegeofAnimalScienceandTechnology,SichuanAgriculturalUniversity,Ya’an625014,China
This paper reports on research undertaken to reveal phenotypic variations and variation patterns in seven ex-situ conservation populations ofElymusbreviaristatusfrom the northwestern Sichuan Plateau. 32 phenotypic traits for 84 individuals were investigated using the methods of nested analysis of variance, coefficient of variation, principal coordinate (PCO) analysis and cluster analysis. There were significant differences in morphological characteristics within and between the populations ofE.breviaristatus. The mean phenotypic differentiation coefficient (VST) between populations was 41.66%, which was less than that within populations (58.33%). The averageVSTof culm, leaf, spike, spikelet, glume, lemma and palea were 55.9%, 63.2%, 38.6%, 43.7%, 31.5% and 33.1%, respectively. The stability of traits related to spike was higher than that of other traits. There were no significant correlations between the tested traits and eco-geographical factors except LGL (length of lower glume) and NVLM (number of veins of lemma). The results of UPGMA cluster analysis by Euclidean distance showed that the seven populations could be divided into four groups. Euclidean distance had no correlation with geographic distance between the collection sites based on the Mantel test (r=0.334,P=0.083).
Elymusbreviaristatus; the northwestern Sichuan Plateau; phenotypic diversity
10.11686/cyxb20150517
http://cyxb.lzu.edu.cn
2014-05-16;改回日期:2014-08-15
国家科技支撑计划项目(2012BAD13B06,2011BAD17B03)和四川省科技支撑计划(2011SZ0162, 2013ZC1635)资助。
顾晓燕(1989-),女,甘肃兰州人,硕士。E-mail: mobei_ttxs@126.com *通讯作者Corresponding author. E-mail:maroar@126.com
顾晓燕, 郭志慧, 张新全, 周凯, 周朝杰, 符开欣, 刘新, 马啸. 短芒披碱草异位保护群体的表型多样性研究.草业学报, 2015, 24(5): 141-152.
Gu X Y, Guo Z H, Zhang X Q, Zhou K, Zhou C J, Fu K X, Liu X, Ma X. Phenotypic variations in seven ex-situ conservation populations ofElymusbreviaristatus. Acta Prataculturae Sinica, 2015, 24(5): 141-152.

