硅对NaCl胁迫下甜瓜种子萌发及幼苗生长的影响
王玉萍,王映霞,白向利,王小青,张峰,3*
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃省干旱生境作物学重点实验室,甘肃农业大学,甘肃 兰州730070;2.甘肃农业大学园艺学院,甘肃 兰州730070;3.甘肃农业大学生命科学技术学院,甘肃 兰州730070)
硅对NaCl胁迫下甜瓜种子萌发及幼苗生长的影响
王玉萍1,2,王映霞2,白向利1,王小青1,张峰1,3*
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃省干旱生境作物学重点实验室,甘肃农业大学,甘肃 兰州730070;2.甘肃农业大学园艺学院,甘肃 兰州730070;3.甘肃农业大学生命科学技术学院,甘肃 兰州730070)
为明确硅(silicon,Si)对盐胁迫的缓解作用,以“雪梨一号”和“朗秦银蜜”两个耐盐性不同的甜瓜品种为材料,在125 mmol/L NaCl胁迫下,研究了不同浓度外源Si对甜瓜种子萌发和幼苗生长的影响。结果表明,NaCl胁迫显著抑制了甜瓜种子萌发,0.50~1.00 mmol/L外源Si处理较对照能显著提高种子的发芽率、发芽势、发芽指数、α-淀粉酶活性及吸水率,其中两个品种的种子均以0.75 mmol/L外源Si处理效果最好;NaCl胁迫下,0.25~1.00 mmol/L外源Si处理后,甜瓜幼苗的株高、叶面积、叶绿素含量、地上部分干重和根系干重较对照显著提高,其中“朗秦银蜜”和“雪梨一号”幼苗分别以0.50和0.75 mmol/L外源Si处理效果最好。研究表明,0.25~1.00 mmol/L外源Si能促进NaCl胁迫下种子吸水和α-淀粉酶活性的提高来促进种子萌发,通过提高NaCl胁迫下幼苗叶绿素含量维持较高的光合能力促进幼苗生长,缓解盐胁迫对甜瓜种子和幼苗的伤害,外源Si浓度超过1.25 mmol/L时对盐胁迫没有缓解效应。
硅;NaCl胁迫;种子萌发;幼苗生长;甜瓜
受全球气候变化和人口不断增长的影响,土壤盐渍化和次生盐渍化问题在全球范围内广泛存在,已成为限制农业生产的重要因素。甜瓜(Cucumismelo)为葫芦科,一年蔓生草本植物,是西部地区的优势特色产业,对地方经济的发展具有重要支持作用。甜瓜根系较浅,具有喜肥不耐肥的特点,容易发生盐害,影响甜瓜正常的生长发育、产量及品质。随着园艺作物设施栽培面积的迅速扩大,高复种指数及不合理的施肥导致的温室土壤的次生盐渍化也已成为国内外设施栽培中普遍存在的问题,严重制约设施栽培的可持续和高效发展[1]。甜瓜是设施栽培的重要蔬菜之一,设施土壤次生盐渍化的发生常会抑制其生长发育,导致产量和品质下降。因此,研究甜瓜耐盐机理,选育甜瓜耐盐品种具有重要的理论和实践意义。
目前尽管在甜瓜耐盐性方面已有一些报道,多集中在盐胁迫下的生理响应方面[2-4]。硅(silicon,Si)是大多数高等植物生长的有益元素,Si能提高植物光合速率和干物质的积累,促进植物的生长发育[5]。有研究表明,外源Si能提高作物对非生物胁迫和生物胁迫的耐受性[6],适量加Si可显著提高作物的抗盐性,降低盐害,提高产量[7]。然而,近年来国内关于Si提高植物耐盐性的研究多见于大麦(Hordeumvulgare)[7],黄瓜(Cucumissativus)[8]、玉米(Zeamays)[9]幼苗和烟草(Nicotianatabacum)[10]悬浮细胞,而利用外源Si诱导甜瓜种子及幼苗耐盐性的研究鲜见报道。
种子萌发、出苗以及幼苗等生活史的早期阶段对盐胁迫尤其敏感[11],因此,研究植物种子和幼苗阶段的盐响应状况进行抗盐方式优化对于增强植物抗性,提高产量具有重要意义。为明确Si对甜瓜耐盐性的生理机制,本试验通过对两个不同甜瓜品种的种子萌发和幼苗生长两个阶段进行NaCl胁迫处理,分析不同浓度梯度的外源Si处理对种子萌发及幼苗生长指标的影响,探讨 Si诱导甜瓜耐盐响应的生理机制,为合理利用Si解决甜瓜栽培中的盐害问题和甜瓜耐盐机理研究提供科学依据,同时为甜瓜的设施栽培提供理论参考和技术依据。
1 材料与方法
1.1 试验材料
试验于2012年4-7月进行。试验甜瓜品种为“朗秦银蜜”和“雪梨一号”。
1.2 试验方法
1.2.1 不同浓度NaCl对甜瓜种子萌发率的影响 预试验NaCl共设置6个浓度梯度,分别为0(蒸馏水对照),50,100,150,200和250 mmol/L。选取2个不同盐敏感性的甜瓜品种籽粒饱满、大小一致的种子(种子在蒸馏水中的初始发芽率均达100%),用10%(V/V)次氯酸溶液消毒15 min,去离子水洗净晾干。在50~55℃的水浴中浸种15~20 min,期间不断搅拌,然后使水温降到20~25℃后继续浸种8~12 h后蒸馏水冲洗。采用纸上发芽床法[12],在洗净烘干的12 cm玻璃培养皿中铺2层滤纸,将处理溶液分别加入培养皿中,至滤纸饱和,然后整齐排入50粒浸种后的种子,加盖。在27℃的恒温培养箱内暗萌发。每个处理重复3次。用称重法补充蒸发的水分,保持溶液的浓度恒定。每日观察并记录发芽种子数(以种子“露白”后胚根伸出种皮2 mm作为萌发标准),记录7 d。
1.2.2 Si对NaCl胁迫下甜瓜种子萌发的影响 试验共设置6个处理:以预试验所选择的125 mmol/L的NaCl作为盐胁迫处理浓度,并设置5个Si溶液处理浓度0.25,0.50,0.75,1.00和1.25 mmol/L(T1、T2、T3、T4、T5),以不加Si的125 mmol/L NaCl溶液处理作为对照(CK)。所用的Si源为K2SiO3·nH2O(化学纯),为平衡由于添加K2SiO3所引起的各处理间钾离子浓度的差异,加入相应量的K2SO4溶液以保持各处理之间离子浓度的一致,防止因K+浓度差异导致种子渗透压出现差异。经消毒和温汤浸种后的种子分别用上述处理液浸种24 h,将种子分别摆放在12 cm铺有双层滤纸的洁净培养皿中,每皿50粒,滤纸用相对应的溶液完全浸湿饱和,每个处理重复3次。在27℃的恒温培养箱中,每天光照12 h。培养期间每24 h更换浸湿过的滤纸,以维持处理溶液中盐浓度和Si浓度不变。每日观察并记录萌发种子数,记录7 d,测定并计算种子萌发相关指标。
1.2.3 Si对NaCl胁迫下甜瓜幼苗生长的影响 选取籽粒饱满大小均匀的种子,种子浸种催芽后播种于盛有蛭石和珍珠岩混合基质的塑料盆(16 cm×12 cm×10 cm)中,基质为蛭石∶珍珠岩=3∶1(V/V),萌发后每隔4~5 d浇1/2Hoagland 营养液,培养基质的相对湿度75%左右,温度控制在23℃/18℃左右,放到光照充足的地方,光周期为12 h/d。每个处理播种10盆,每盆播种2粒种子。幼苗破心时选择长势一致的植株定苗1株。
试验共设6个处理:以蒸馏水处理作为对照(CK),外源硅的处理浓度分别设置为0.25,0.50,0.75,1.00和1.25 mmol/L(T1,T2,T3,T4,T5)。所用的硅源为K2SiO3·nH2O(化学纯),加硅处理中由K2SiO3所引入的钾量从配制Hoagland 营养液所用的KNO3中扣除,由此而引起的NO3-损失用稀HNO3补偿[7]。待幼苗长到3 叶1心时,挑选长势均匀的幼苗进行胁迫处理,每个处理浇足量125 mmol/L NaCl处理溶液,间隔4 d后浇足量浓度的Si (K2SiO3·nH2O) 溶液进行初始处理,2 d后叶面喷施Si (K2SiO3·nH2O)溶液强化处理,确保基质Si浓度在最小的范围内波动。每隔3 d浇1次营养液,胁迫处理15 d后测定相关形态和生理指标。
1.3 指标测定
1.3.1 种子萌发指标 种子萌发第4天测定发芽势,第7天测定萌发率和发芽指数。ɑ淀粉酶活性测定参照李合生[13]的方法。
萌发率(%)=(7 d内萌发种子总粒数/供试种子总粒数)×100
发芽指数GI=∑Gt/Dt
发芽势(%)=(4 d 内发芽的种子粒数/供试种子总粒数)×100
式中,Gt为7 d的萌发数,Dt为相应萌发天数。
种子吸水率的测定:处理前、处理后在48 h分别取50粒种子称重(精确度为0.001 g),重复3次。
种子吸水率(%)=[(W2-W1)/W1]×100
式中,W1为处理前50粒种子自然风干重(g);W2为50粒种子吸水后重量(g)。
1.3.2 形态生理指标 株高测定:用直尺测量甜瓜幼苗子叶节到生长点之间的距离。每品种每处理取样5株,取其平均值,3次重复。叶面积测定:用方格纸计数法测量第3片真叶展开叶面积。每品种每处理取样5株,取其平均值,3次重复。干重测定:将各处理幼苗从营养钵中小心取出,先用自来水冲洗其根部附着的蛭石,再用蒸馏水冲洗3次,用滤纸吸干表面水分,将鲜样品材料置105℃下杀青30 min,剪开幼苗的地上部分和根系,在75℃烘干至恒重,称干重(植株地上部分和根系部分)。每品种每处理取样5株,取其平均值,3次重复。叶绿素含量的测定参照李合生[13]的方法,取幼苗生长点下第2片完全展开的真叶,避开叶脉打孔,测定叶绿素a、叶绿素b含量。
1.4 数据统计分析
所有指标测定重复3次,结果以平均值±标准误(means±SD)表示,采用Origin 8.0软件对数据进行处理, SPSS 16.0统计软件进行方差分析,Duncan法进行差异显著性多重比较(P<0.05)。
2 结果与分析
2.1 不同浓度NaCl对两个品种甜瓜种子萌发的影响
不同浓度的NaCl处理对两个品种甜瓜种子的萌发有不同影响(图1)。在50 mmol/L NaCl处理下,“雪梨一号”和“朗秦银蜜”两个品种甜瓜的种子萌发率较对照有增加的趋势,但是当NaCl浓度大于50 mmol/L时,随处理NaCl浓度的增加,两个品种种子的萌发率呈下降趋势。在对照、50和250 mmol/L的NaCl处理下两个品种的种子萌发率相差不大,当NaCl浓度为100~200 mmol/L时,相同浓度胁迫处理下“雪梨一号”的种子萌发率比“朗秦银蜜”的萌发率高10%~20%左右,表明两个甜瓜品种 “雪梨一号”耐盐性比“朗秦银蜜” 强。当“朗秦银蜜”和“雪梨一号”的种子萌发率分别降为对照的50%时,NaCl的胁迫处理浓度分别为100和150 mmol/L,因此选择125 mmol/L的NaCl作为“朗秦银蜜”和“雪梨一号”的盐胁迫处理浓度。

图1 不同浓度NaCl对甜瓜种子萌发率的影响Fig.1 Effect of different concentration of NaCl on melon seed germination rate 图中标不同字母者表示差异显著(P<0.05),下同。Different letters in the legends mean the significant differences at P<0.05,the same below.
2.2 Si对NaCl胁迫下甜瓜种子萌发的影响
不同浓度的Si处理对NaCl胁迫下甜瓜的种子萌发有一定影响。随Si处理浓度增加,种子萌发相关指标呈先增加后降低的趋势(表1)。与对照相比,0.25~0.75 mmol/L的Si处理可明显提高两个甜瓜品种的种子萌发率、发芽势和发芽指数,其中以0.75 mmol/L的Si处理效果最佳,“雪梨一号”的萌发率、发芽势、发芽指数和α-淀粉酶活性分别较对照提高23.9%,29.9%,30.3%和31.1%,差异显著(P<0.05),“朗秦银蜜”的萌发率、发芽势和发芽指数分别较对照提高29.9%,40.5%,37.7%和35.5%,差异显著(P<0.05)。1.00和1.25 mmol/L的Si处理下2个品种的种子萌发各项指标均较对照明显降低。结果表明,0.50~0.75 mmol/L的Si处理可以有效地缓解NaCl胁迫对甜瓜种子萌发的抑制作用,以0.75 mmol/L的作用效果最佳,Si浓度小于0.25或者为1.00 mmol/L时,缓解效果降低,超过1.00 mmol/L时不具有缓解作用,且浓度越高抑制效果越明显。

表1 Si对NaCl胁迫下甜瓜种子萌发的影响
注:同列不同字母表示同一品种不同处理间差异显著(P<0.05)。下同。
Note: Different letters in the same column mean significant differences among treatments at 0.05 level. The same below.
2.3 Si对NaCl胁迫下甜瓜种子吸水的影响
种子吸水率的大小一般影响种子的萌发速率,处理后48 h测定种子的吸水率,结果显示,不同处理下种子的吸水率较对照均增加,其中“雪梨一号”以0.75 mmol/L的Si处理较对照增幅最大,差异显著(P<0.05),而0.50 mmol/L的Si处理对“朗秦银蜜”的作用效果最佳,与对照差异显著(P<0.05)(图2)。结果表明,外源Si处理对NaCl胁迫下“雪梨一号”和“朗秦银蜜”的种子吸水均有促进作用,当Si浓度分别为0.75和0.50 mmol/L时,“雪梨一号”和“朗秦银蜜”的种子吸水率均显著高于对照(P<0.05)。外源Si在一定程度上能缓解NaCl胁迫对甜瓜种子吸水的抑制作用,促进萌发。
2.4 Si对NaCl胁迫下甜瓜幼苗株高的影响
不同浓度的Si处理对NaCl胁迫下甜瓜幼苗株高有不同影响,总体上随Si浓度的增加表现出先升后降的趋势(图3)。Si为0.25~1.00 mmol/L处理下两个品种幼苗的株高较对照明显增加。对于“雪梨一号”,0.75 mmol/L的Si处理效果最佳,株高与对照相比增幅最大,差异显著(P<0.05),缓解NaCl胁迫的作用最明显,而Si大于0.75 mmol/L 时,幼苗株高逐渐降低。对于“朗秦银蜜”,0.50 mmol/L的Si处理株高较对照增幅最大,差异显著(P<0.05),Si 浓度为1.25 mmol/L时,幼苗株高显著低于对照(P<0.05),对胁迫无缓解作用。以上结果表明,Si对幼苗NaCl胁迫的缓解效果与浓度和品种有关,不同品种的最佳作用浓度也不同。0.50~0.75 mmol/L的Si对NaCl胁迫的缓解作用明显,0.75 mmol/L时作用降低,超过1.00 mmol/L时没有缓解作用。

图2 Si对NaCl胁迫下甜瓜种子吸水率的影响Fig.2 Effect of exogenous silicon on melon seeds water absorption under NaCl stress
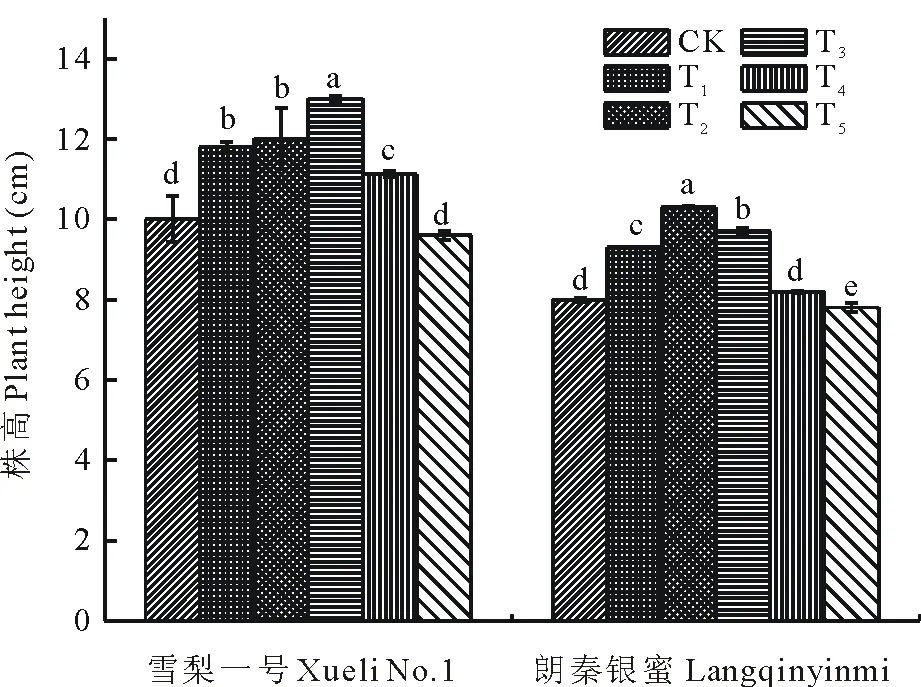
图3 Si对NaCl胁迫下甜瓜幼苗株高的影响Fig.3 Effect of exogenous silicon on plant height of melon seedlings under NaCl stress
2.5 Si对NaCl胁迫下甜瓜幼苗叶面积的影响
NaCl胁迫下,甜瓜幼苗的叶面积随Si处理浓度的增加表现出先升后降的趋势(图4)。与对照相比,0.25~1.00 mmol/L的Si处理可明显提高两个品种幼苗的叶面积。“雪梨一号”以0.75 mmol/L的Si处理效果最佳,叶面积较对照增幅最大,差异显著(P<0.05),对NaCl胁迫的缓解作用最明显,而1.25 mmol/L的Si处理叶面积明显低于对照(P<0.05),对胁迫不但没有缓解作用反而加剧胁迫。“朗秦银密”以0.50 mmol/L的Si处理效果最好,叶面积较对照增幅最大,差异显著(P<0.05),1.00 mmol/L的Si处理与对照无显著差异,而1.25 mmol/L的Si处理叶面积较对照显著降低(P<0.05),胁迫加剧。以上结果表明,Si对幼苗NaCl胁迫的缓解效果与浓度有关,不同品种的最佳作用浓度也不同。对于“雪梨一号”,0.75 mmol/L的Si处理效果最佳,而“朗秦银密”为0.50 mmol/L的Si处理效果为最佳。总体来看,0.25~0.75 mmol/L的Si对NaCl胁迫的缓解作用明显,超过0.75 mmol/L时缓解作用降低,1.25 mmol/L时没有作用,反而加剧胁迫。
2.6 Si对NaCl胁迫下甜瓜幼苗地上部分干重的影响
NaCl胁迫下,幼苗地上部分干重随Si浓度的增加呈先升后降的趋势(图5)。“雪梨一号”幼苗当Si 浓度为0.25~1.00 mmol/L时,地上部分干重较对照明显增加,差异显著(P<0.05),其中以0.50 mmol/L的处理效果最佳,而1.25 mmol/L的Si处理时干重较对照降低显著(P<0.05)。对于“朗秦银密”幼苗,0.25~0.75 mmol/L的Si对地上部分干重较对照增加显著(P<0.05),以0.50 mmol/L的处理效果最好,Si浓度大于1.00 mmol/L时,干重较对照降低显著(P<0.05),胁迫加剧。结果表明,低浓度的Si促进地上部分茎叶对营养的吸收,缓解NaCl胁迫,有壮苗作用。Si为0.25~0.75 mmol/L时,对NaCl胁迫下幼苗的生长有促进作用,0.50 mmol/L时对两个品种甜瓜幼苗地上部分干重的促进作用最明显,对胁迫的缓解作用最佳,Si浓度大于1.00 mmol/L时,缓解胁迫的作用降低,甚至加剧胁迫。

图4 Si对NaCl胁迫下甜瓜幼苗叶面积的影响Fig.4 Effect of exogenous silicon on leaf area of melon seedlings under NaCl stress

图5 Si对NaCl胁迫下甜瓜幼苗地上部分干重的影响Fig.5 Effect of exogenous silicon on shoot dry weight of shoot of melon seedlings NaCl stress

图6 Si对NaCl胁迫下甜瓜幼苗地下部分干重的影响Fig.6 Effect of exogenous silicon on root dry weight of melon seedlings under NaCl stress
2.7 Si对NaCl胁迫下甜瓜幼苗根系干重的影响
一定浓度的Si处理能提高幼苗根系的生长,幼苗根系干重随Si处理浓度的增加呈先升后降的趋势(图4)。与对照相比,0.25~1.00 mmol/L的Si处理均能明显增加幼苗根系干重。其中“雪梨一号”以0.75 mmol/L的Si处理效果最佳,而0.50 mmol/L 的Si对“朗秦银密”的处理效果最好,根系干重较对照增幅最大,差异显著(P<0.05)。“雪梨一号”幼苗Si 处理浓度为1.25 mmol/L时,与对照差异不显著(P>0.05),对根系干物质积累没有促进作用。“朗秦银密”幼苗0.25~1.00 mmol/L 的Si各处理间差异明显,均显著高于对照(P<0.05)。Si对NaCl胁迫下“雪梨一号”幼苗的缓解作用要强于“朗秦银密”,不同品种Si的最佳作用浓度不同,这可能与品种特性有关。以上结果表明,0.25~1.00 mmol/L的Si对NaCl胁迫下甜瓜幼苗的生长有明显的缓解作用,超过1.00 mmol/L时则无缓解作用。外源Si对NaCl胁迫的缓解作用因品种而异。
2.8 Si对NaCl胁迫下甜瓜幼苗叶片叶绿素含量的影响
叶绿素在光合作用中植物对光能的吸收、传递和转换过程中起着关键的作用。不同浓度的Si处理对NaCl胁迫下幼苗叶片叶绿素a、叶绿素b和叶绿素(a+b)含量有不同的影响(表2)。与对照相比,0.25~0.75 mmol/L的Si处理均能明显提高两个品种幼苗叶绿素a、叶绿素b和叶绿素(a+b)含量,以0.50 mmol/L的处理效果最佳,差异显著(P<0.05)。对于“雪梨一号”,1.00 mmol/L的Si处理后各指标与对照差异不显著,1.25 mmol/L的处理各指标较对照降低;而“朗秦银密”,各浓度处理下的上述各指标均稍高于对照,1.25 mmol/L的Si处理与对照无明显差异。说明0.25~1.00 mmol/L的Si能有效地缓解甜瓜幼苗的NaCl胁迫,提高叶绿素含量,增强光合作用,促进幼苗的生长发育。当Si浓度大于1.25 mmol/L时,对胁迫无缓解作用。
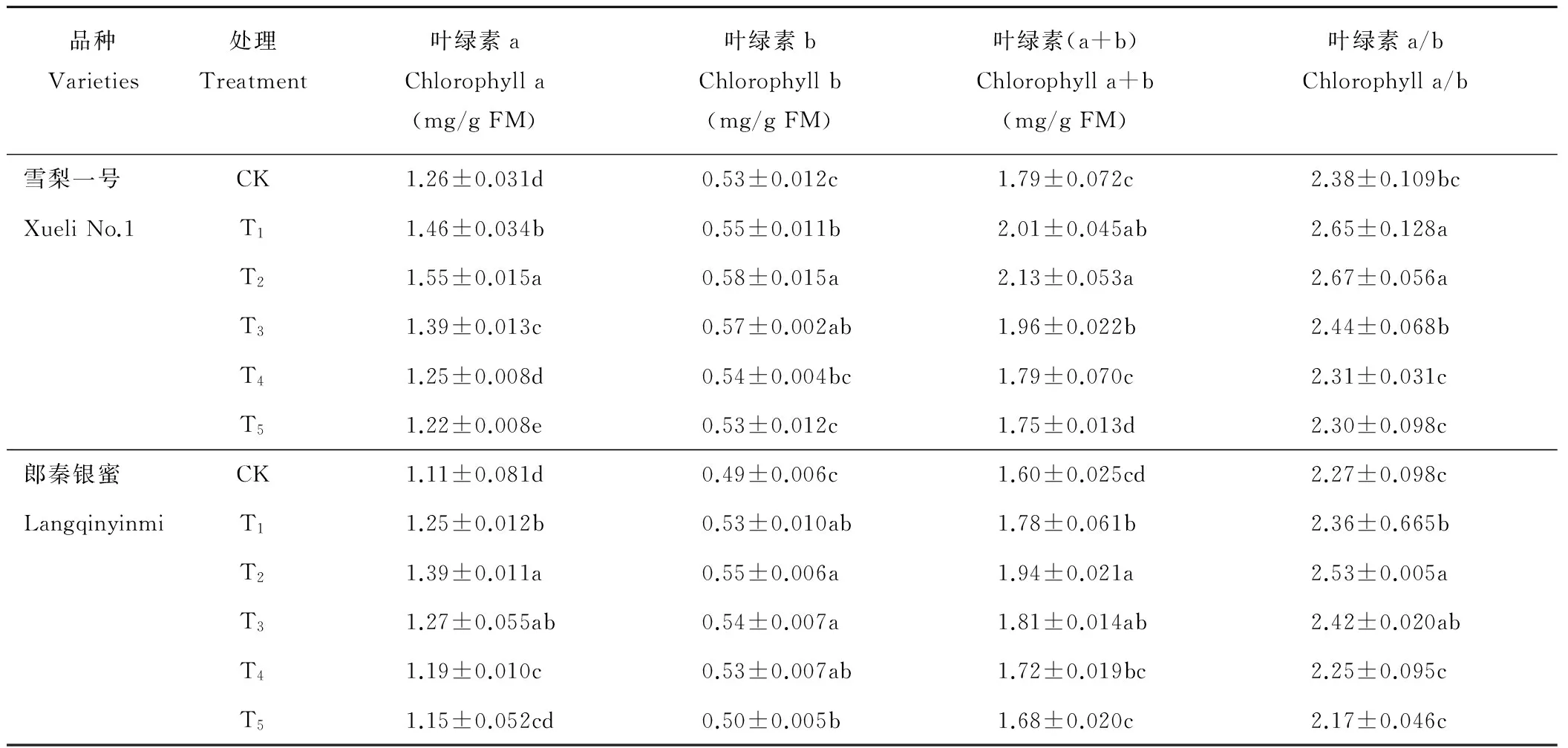
表2 Si对NaCl胁迫下甜瓜幼苗叶片叶绿素含量的影响
3 讨论
盐胁迫损害植物细胞正常的代谢过程,对种子的萌发有不利影响。种子萌发率与种子活力是一致的[14],本试验发现,小于50 mmol/L的NaCl处理对甜瓜种子萌发有促进作用,而当NaCl浓度大于50 mmol/L时随处理浓度的升高种子萌发率降低,说明高浓度NaCl对种子活力有抑制作用。两个甜瓜品种“朗秦银蜜”和“雪梨一号”的盐胁迫临界浓度分别为100和150 mmol/L,说明“雪梨一号”耐盐性强于“朗秦银蜜”。当NaCl浓度达到250 mmol/L时两甜瓜品种的种子萌发率均接近0,种子活力基本丧失。NaCl对甜瓜种子萌发的影响表现为低浓度促进,高浓度抑制,这种现象可能与低盐促进细胞膜渗透调节有关,也可能是低浓度盐中的无机离子对呼吸酶有一定的激活作用,而高浓度盐会产生渗透胁迫和离子胁迫,抑制种子内部生理生化反应的重建以及膜透性增加等而抑制种子萌发[15]。
高浓度盐会造成种子萌发率、发芽势、发芽指数降低[12]。Si能提高盐胁迫下玉米种子的淀粉酶、蛋白酶、脂肪酶的活性,促进呼吸代谢提高种子的萌发率[15]。Si有利于盐胁迫下水稻(Oryzasativa)种子的萌发[16]。本研究通过预备试验,选取2个不同品种盐临界浓度之间的125 mmol/L的NaCl进行胁迫处理,通过不同浓度的Si处理,结果表明0.50~0.75 mmol/L的Si处理较对照能显著提高NaCl胁迫下2个品种的种子萌发率、发芽势、发芽指数、吸水率和α-淀粉酶活性,以0.50 mmol/L的作用效果最佳,而Si浓度大于1.00 mmol/L时对胁迫的缓解作用降低,甚至有加重胁迫的作用(表1,图2)。说明Si能通过促进种子的吸水和提高α-淀粉酶的活性来促进种子萌发,缓解盐对甜瓜种子萌发的抑制作用。这与戚乐磊等[15]对盐胁迫下水稻种子萌发的研究结果一致。低浓度的外源Si显著提高了甜瓜种子萌发的相关指标,可能是Si附着于种皮上,调节了细胞壁的孔隙度,减少了盐分进入胚的过程,从而减轻了盐对种胚的伤害作用,提高种子活力[15]。而高浓度的Si对NaCl胁迫的缓解作用降低,甚至有加重胁迫作用,可能与高浓度的Si产生的渗透胁迫有关,有待进一步研究。
生物量是植物对盐胁迫反应的综合体现,也是植物耐盐性的直接指标[17]。研究表明,Si能提高盐胁迫下大麦根系的吸收能力,促进幼苗生物量增加[18-19]。Si能提高水稻[5]、小麦(Triticumaestivum)[19]和黄瓜幼苗[20]的抗盐能力和干物质的积累。本试验结果表明,与对照相比,0.25~1.00 mmol/L的Si能显著提高NaCl胁迫下2个不同盐敏感甜瓜品种幼苗的株高、叶面积指数、幼苗地上部分与根系干重及叶绿素含量,而Si浓度大于1.00 mmol/L时对幼苗的生长起抑制作用,幼苗的地上部分与根系干物质的积累降低,可能与Si干扰正常的物质代谢和能量代谢,并消耗一定的生物能有关。叶绿素含量是反映植物光合能力的一个重要参数,光合性能的好坏最终将影响作物的生长、产量和品质[21]。本试验结果表明,适宜浓度的Si能明显提高NaCl胁迫下甜瓜叶绿素含量,说明Si可以显著缓解NaCl胁迫下叶绿素的降解,有利于幼苗在胁迫下维持正常的光合作用,增强幼苗对胁迫的耐受能力,这可能是Si促使盐胁迫下幼苗生物量增加的一个重要因素。因此,Si对甜瓜幼苗NaCl胁迫的缓解作用与浓度和品种有关,0.25~0.75 mmol/L的低浓度作用明显,超过0.75 mmol/L时对胁迫的缓解作用降低,1.00 mmol/L以上对NaCl胁迫没有缓解作用,甚至加剧胁迫。“朗秦银蜜”和“雪梨一号”幼苗分别以0.50和0.75 mmol/L外源Si处理效果最好。
综上所述,适当浓度的外源Si(0.25~1.00 mmol/L)对增强甜瓜种子萌芽期及幼苗期的耐盐性具有一定的作用,可提高盐胁迫下种子的萌发率、发芽势、发芽指数和α-淀粉酶活性,促进种子吸水,利于种子萌发。外源Si可提高盐胁迫下甜瓜幼苗的叶绿素含量,茎叶及根系干物质积累,有利于幼苗的生长发育并增强其抗逆性,减轻盐害。
[1] Guo W Z, Liu S F, Li D R,etal. Mechanism of soil salinization in protected cultivation. Soils, 2004, 36(1): 25-29.
[2] Chen Y G, Zhang M, Wang D L,etal. Effects of NaCl stress on characteristics of seedling physiology in melon. Journal of Anhui Agriculture Science, 2009, 37(8): 3390-3392.
[3] Zhang Y X, Liu F, Kang E X,etal. Study on ion absorption of muskmelon seedlings under NaCl stress. Plant Nutrition and Fertilizer Science, 2008, 14(3): 533-539.
[4] Chen N L, Ma G J, Zhang Y X,etal. Responses of seed germination and seedling growth of muskmelon to NaCl stress. Journal of Desert Research, 2006, 26(5): 814-819.
[5] Manju M, Naresh C. Silicon effects on nodule growth, dry matter production and mineral nutrition of cowpea (Vignaunguiculata). Journal of Plant Nutrition Soil Science, 2008, 171: 835-840.
[6] Gao D, Chen J N, Cai K Z,etal. Distribution and absorption of silicon in plant and its role in plant disease resistance under environmental stress. Acta Ecologica Sinica, 2010, 30(10): 2747-2749.
[7] Liang Y C, Ding R X, Liu Q,etal. Effects of silicon on salt tolerance of barley and its mechanism. Scientia Agricultura Sinica, 1999, 32(6): 75-83.
[8] Han X R, Hou Y H, Jiang L L,etal. Effects of silicon on cucumber seeding growth and plant nutrition under salt stress. Chinese Journal of Soil Science, 2006, 37(6): 1162-1165.
[9] Shu L Z, Liu Y H. Effects of silicon on growth of maize seedlings under salt stress. Agro-environmental Protection, 2001, 20(1): 38-40.
[10] Fang J Y, Wang H, Zhang F S. Effect of silicon on tobacco suspension cells under salt stress and related mechanism. Acta Agronomica Sinica, 2003, 29(4): 610-614.
[11] Zhang J N, Liu K. Mechanism for plants detecting the optimum time and place to germinate. Acta Pratuculturae Sinica, 2014, 23(1): 328-338.
[12] Wang Y P, Dong W, Zhang X,etal. Effects of salicylic acid on seed germination and physiological characters of cauliflower seedling under salt stress. Acta Prataculturae Sinica, 2012, 21(1): 213-219.
[13] Li H S. The Principle and Technology of Plant Physiology and Biochemistry Experiment[M]. Beijing: Higher Education Press, 2000.
[14] Zheng G H. Seed Phsiology[M]. Beijing: Science Press, 2004.
[15] Qi L L, Chen Y, Jia H X. Effects of organic and inorganic silicon on the germination of rice seeds under salt stress. Journal of Gansu Agriculture University, 2002, 37(3): 272-278.
[16] Zhang W Q, Huang Y Z, Zhao L J,etal. Effects of silicon on the germination of si mutant rice and wild rice seeds under salt stress. Asian Journal of Ecotoxicology, 2009, (6): 868-872.
[17] Lu Y, Lei J Q, Zeng F J,etal. Effect of salt treatments on the growth and ecophysiological characteristics ofHaloxylonammodendron. Acta Pratuculturae Sinica, 2014, 23(3): 152-159.
[18] Liang Y C, Chen Q, Liu Q. Exogenous silicon increase antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley (HordeumvulgareL.). Journal of Plant Physiology, 2003, 160: 1157-1164.
[19] Liang Y C, Ding R X. Effect of silicon on ion distribution in barley root and the relationship with the salt tolerance of barley. Science in China (Series C), 2002, 32(2): 113-121.
[20] Qian Q Q, Zai W S, Zhu Z J,etal. Effects of exogenous silicon on active oxygen scavenging systems in chlo-roplasts of cucumber (CucumissativusL.) seedlings under salt stress. Journal of Plant Physiology and Molecular Biology, 2006, 32(1): 107-112.
[21] Wei G Q, Zhu Z J, Fang X Z,etal. The effects of NaCl stress on plant growth, chlorophyll fluorescence characteristics and active oxygen metabolism in seedlings of two cucumber cultivars. Scientia Agricultura Sinica, 2004, 37(11): 1754-1759.
参考文献:
[1] 郭文忠, 刘声锋, 李丁仁, 等. 设施蔬菜土壤次生盐渍化发生机理的研究现状与展望.土壤, 2004, 36(1): 25-29.
[2] 陈友根, 章敏, 王冬良, 等. 甜瓜幼苗对NaCl胁迫伤害的生理响应.安徽农业科学, 2009, 37(8): 3390-3392.
[3] 张玉鑫, 刘芳, 康恩祥, 等. NaCl胁迫下甜瓜幼苗离子吸收特性研究.植物营养与肥料学报, 2008, 14(3): 533-539.
[4] 陈年来, 马国军, 张玉鑫, 等. 甜瓜种子萌发和幼苗生长对NaCl胁迫的响应.中国沙漠, 2006, 26(5): 814-819.
[6] 高丹, 陈基宁, 蔡昆争, 等. 硅在植物体内的分布和吸收及其在病害逆境胁迫中的抗作用.生态学报, 2010, 30(10): 2747-2749.
[7] 梁永超, 丁瑞兴, 刘谦, 等. 硅肥对大麦耐盐性的影响及其机制. 中国农业科学, 1999, 32(6): 75-83.
[8] 韩晓日, 侯玉慧, 姜琳琳, 等. 硅对盐胁迫下黄瓜幼苗生长和矿质元素吸收的影响.土壤学报, 2006, 37(6): 1162-1165.
[9] 束良佐, 刘英慧. 硅对盐胁迫下玉米幼苗生长的影响.农业环境保护, 2001, 20(1): 38-40.
[10] 房江育, 王贺, 张福锁. 硅对盐胁迫烟草悬浮细胞的影响.作物学报, 2003, 29(4): 610-614.
[11] 张佳宁, 刘坤. 植物调节萌发时间和萌发地点的机制.草业学报, 2014, 23(1): 328-338.
[12] 王玉萍, 董雯, 张鑫, 等. 水杨酸对盐胁迫下花椰菜种子萌发及幼苗生理特性的影响.草业学报, 2012, 21(1): 213-219.
[13] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[14] 郑光华. 种子生理[M]. 北京: 科学出版社, 2004.
[15] 戚乐磊, 陈阳, 贾恢先. 盐胁迫下有机及无机硅对水稻种子萌发的影响.甘肃农业大学学报, 2002, 37(3): 272-278.
[16] 张文强, 黄益宗, 招礼军, 等. 盐胁迫下外源硅对硅突变体与野生型水稻种子萌发的影响.生态毒理学报, 2009, (6): 868-872.
[17] 鲁艳, 雷加强, 曾凡江, 等. NaCl处理对梭梭生长及生理生态特征的影响.草业学报, 2014, 23(3): 152-159.
[19] 梁永超, 丁瑞兴. 硅对大麦根系中离子的微域分布的影响及其与大麦耐盐性的关系.中国科学(C辑), 2002, 32(2): 113-121.
[20] 钱琼秋, 宰文珊, 朱祝军, 等. 外源硅对盐胁迫下黄瓜幼苗叶绿体活性氧清除系统的影响. 植物生理与分子生物学学报, 2006, 32(1): 107-112.
[21] 魏国强, 朱祝军, 方学智, 等. NaCl胁迫对不同品种黄瓜幼苗生长、叶绿素荧光特性和活性氧代谢的影响.中国农业科学, 2004, 37(11): 1754-1759.
Effects of exogenous silicon on melon seed germination and the growth of seedlings under NaCl stress
WANG Yu-Ping1,2, WANG Ying-Xia2, BAI Xiang-Li1, WANG Xiao-Qing1, ZHANG Feng1,3*
1.GansuKeyLaboratoryofCropGenetic&GermplasmEnhancement,GansuKeyLaboratoryofAridlandCropScience,GansuAgriculturalUniversity,Lanzhou730070,China; 2.CollegeofHorticulture,GansuAgriculturalUniversity,Lanzhou730070,China; 3.CollegeofLifeScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China
The effects of exogenous silicon on the growth of melon under salt stress were investigated. Seedlings of two melon cultivars (Xueli No.1 and Longqinyinmi) with different salt tolerance were grown with 125 mmol/L NaCl stress Exposure to 125 mmol/L NaCl stress significantly inhibited melon seed germination. Compared with control, treatments with 0.5-1.0 mmol/L exogenous silicon significantly increased seed germination rate, germination energy, germination index, alpha-amylase activity and water absorption and the treatment with 0.75 mmol/L exogenous silicon performed best. In addition, melon seedlings with 0.25-1.00 mmol/L silicon exposed to 125 mmol/L NaCl had significantly increased plant height, leaf area, chlorophyll content, shoot dry weight and root dry weight, compared to controls. Treatment with 0.50 mmol/L was optimal for Longqinyinmi, while 0.75 mmol/L gave best results for Xueli No.1. These results indicate that exogenous silicon concentration from 0.50 mmol/L to 0.75 mmol/L can promote melon seed germination by enhancing alpha-amylase activity and water absorption, and promote seedling growth by increasing chlorophyll content and photosynthesis capacity under salt stress. When the silicon concentration was more than 1.25 mmol/L, there was no effect on the seed germination and growth of seedlings under salt stress.
silicon; NaCl stress; seed germination; seedlings growth; melon
10.11686/cyxb20150513
http://cyxb.lzu.edu.cn
2014-05-16;改回日期:2014-08-26
国家自然科学基金项目(31060063,31260094),甘肃省自然科学基金项目(0803RJZA051)和甘肃省财政厅项目资助。
王玉萍(1974-),女,甘肃天水人,副教授,博士。E-mail: wangyp@gsau.edu.cn *通讯作者Corresponding author. E-mail: zhangf@gsau.edu.cn
王玉萍, 王映霞, 白向利, 王小青, 张峰. 硅对NaCl胁迫下甜瓜种子萌发及幼苗生长的影响. 草业学报, 2015, 24(5): 108-116.
Wang Y P, Wang Y X, Bai X L, Wang X Q, Zhang F. Effects of exogenous silicon on melon seed germination and the growth of seedlings under NaCl stress. Acta Prataculturae Sinica, 2015, 24(5): 108-116.

