枣根际解磷细菌的分离筛选及16S rDNA鉴定
郭艺鹏,王海儒,孙林琦,张晶晶,韩 超,秦韵婷,李建贵
(1.新疆农业大学林业研究所,新疆乌鲁木齐830052;2.新疆农业大学,新疆红枣工程技术研究中心,新疆乌鲁木齐830052)
磷是植物营养中的三大要素之一,又是植物体内有机化合物的重要组成成分,对其生长发育都起着不可忽视的作用[1-3],中国有74% 的耕地土壤缺磷,土壤中95%的磷为无效形式,为了实现高产,每年都向土壤中反复施加大量可溶性磷肥,然而,由于土壤的固定等作用,作物对施入的磷肥当季利用效率只有5% ~10%,大部分与土壤中的Ca2+,Fe2+,Fe3+,A13+结合形成难溶性磷酸盐。土壤中存在大量具有解磷能力的微生物,能够将难溶性的磷酸盐如磷矿粉转化为水溶性磷,提高土壤中的可溶性磷含量,从而改善植物磷素营养,提高作物产量[4-5]。新疆独特的气候条件和土壤类型,造就其土壤微生物资源及解磷微生物也有其特性。因此,从新疆红枣根际土壤中分离、筛选高效溶磷细菌,研究高效微生物菌肥,对调节土壤磷素的供需矛盾,促进新疆红枣产业的可持续发展具有重要意义。本试验从新疆红枣主产区的18个根际土壤样品筛选解磷细菌,研究其对无机磷和有机磷的降解能力,获得了20个代表性解磷菌株,并对其进行鉴定和分类,为今后研究新疆红枣专用微生物肥料奠定基础。
1 材料与方法
1.1 试验材料
原始土样采自新疆和田、喀什、阿克苏、库尔勒和吐鲁番等红枣主产区的4 a生和8 a生骏枣及灰枣枣园。采样时,铲去表土,深挖10~20 cm,将根际土壤连同枣树根一同装入无菌袋,编号。
1.2 培养基的配制
细菌分离采用牛肉膏蛋白胨培养基:牛肉膏3.0 g,蛋白胨 10.0 g,NaCl 5.0 g,琼脂 18.0 g,pH值为 7.0 ~7.2,蒸馏水 1 000 mL。
磷酸三钙无机磷培养基(Ca3(PO4)2):葡萄糖10.0 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.03 g,MnSO41.0 g,Ca3(PO4)25.0 g,Agar 15.0 ~ 18.0 g,蒸馏水1 000 mL,pH 值为 7.0~7.5。该培养基的液体培养基中,不加琼脂。
蒙金娜有机磷培养基(PVK):葡萄糖10.0 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O0.03 g,MnSO41.0 g,CaCO35.0 g,卵磷脂 2 g,Agar 15.0 ~18.0 g,蒸馏水1 000 mL,pH值为 7.0~7.5。该培养基的液体培养基中,不加琼脂。
1.3 解磷细菌的分离及筛选
1.3.1 分离 无菌条件下取枣根及黏附其上的根际土壤称量后,溶于装有90 mL无菌水的三角瓶中配成10-1稀释液,28℃,170 r·min-1,振荡 30 min,使微生物充分的分散。取1 mL稀释液加入到9 mL无菌水中混匀配成10-2的稀释液,然后将10-2的稀释液取1 mL加入9 mL的无菌水中混匀,即为10-3的稀释液,以此类推,制备 10-4,10-5,10-6等的一系列稀释液。
用移液器吸取100 μL样品稀释液,将稀释液分别涂布于无机磷培养基和卵磷脂培养基上,解有机磷细菌在28℃ 培养 3 d,解无机磷细菌培养7 d,分别记录具有混浊圈和透明圈的菌落个数,并挑取单菌落进行纯化培养。
纯化培养时,将有代表性的单菌落分别接种到牛肉膏蛋白胨斜面上及其液体培养基中培养1~2 d,斜面培养物在4℃保存,液体培养物加甘油(终体积分数为20%),保存在-20℃备用。
1.3.2 平板初筛 取分离出的代表性菌株活化24 h后制成菌悬液,培养至对数生长期,用打孔器在卵磷脂平板和磷灰石平板上打孔,每板3个,每孔接种30 μL,重复3个平板,28℃培养24 h后,观察有无溶磷圈,并根据在平板上形成的混浊圈(或透明圈)直径,比较其解磷能力的大小[6]。
1.3.3 摇瓶复筛 取代表性菌株接种于50 mL牛肉膏蛋白胨培养液中,于30℃,170 r·min-1培养24 h;取2 mL菌液分别接种于灭菌的磷酸三钙无机磷和蒙金娜有机磷液体培养基中,以不接菌为对照,3 次重复,30 ℃,170 r·min-1培养 6 d,测定有效磷的含量和 pH[7]。数据使用 DPS软件进行LSD法多重比较。
1.4 16S rDNA序列测定与系统发育分析
1.4.1 16S rDNA的 PCR扩增反应 根据细菌16S rDNA的保守序列,合成一对细菌特异性引物(通用引物):27 F(5’-AGAGTTTGATCATGGCTCAG-3’)和 1492 R(5’-GGTTACCTTACGACTT-3’)。PCR 反 应 体 系 为 50 μL:5 μL 10 × buffer;1.0 μL 10 mmol·L-1dNTPs;10 mmol·L-1引物27 F 和1492 R 各1 μL;2.0 μL 细菌基因组 DNA;2U TaqDNA聚合酶。PCR扩增条件:94℃,3 min;94 ℃,1 min;52℃,1 min;72 ℃1 min,30 个循环;72℃,10 min,PCR反应产物4℃保存。反应结束后取5 μL反应产物,在1% 琼脂糖凝胶中电泳,分析PCR产物电泳结果[8]。将PCR扩增产物送至上海生工生物工程技术服务有限公司进行测序。将所得序列与GenBank数据库中序列进行Blast分析比对,鉴定其种属,并上传所得序列。
1.4.2 系统发育树的构建 采用 CLUSTALX 1.83软件进行序列比对,用MEGA 5.0软件以邻近法构建系统发育树,Bootstrap值为1 000。
2 结果与分析
2.1 初筛
采用磷酸三钙无机磷和蒙金娜有机磷培养基分离和田、喀什、阿克苏、库尔勒和吐鲁番等地区18个根际土样品的解磷细菌,共计获得176个菌株,其中从磷酸三钙无机磷培养基分离得到79个,从蒙金娜有机磷培养基分离得到97个。
将分离得到的菌株纯化培养后接种到磷灰石板和卵黄板上,培养24 h后,有63个菌株产生了明显的溶磷圈,有76个菌株溶磷圈不够明显,剩下的菌株则没有发现溶磷圈。从63个菌株中又进一步验证初筛出了解磷能力稳定的20个代表性菌株,结果如表1所示。

表1 表1不同解磷菌株在固体Ca3(PO4)2和PVK培养基上的溶磷情况Table 1 The clear halos of different PSMs on Ca3(PO4)2and PVK agar medium
由表1可知,初筛出的菌株,有17个在以磷酸三钙为磷源的磷灰石板上形成透明圈,15个在以卵磷脂为磷源的卵黄板上形成混着圈,这些菌株具有解磷能力,可以溶解菌落周围的磷酸三钙或卵磷脂,且解磷能力越大,透明圈或混着圈越大,有7个菌株解无机磷能力较强,D/d >2,其中 P12,P16,P193个菌株D/d>3;有13个菌株解有磷能力较强,D/d>2,其中 P2,P42个菌株 D/d>3;还有一些菌株能够解有机磷和无机磷,如 P3,P4,P11,P19等,只是能力强弱不同。
2.2 复筛
将初筛选出的 20个菌株于 30℃,170 r·min-1培养24 h,分别取2 mL菌液接种于灭菌的磷酸三钙无机磷和蒙金娜有机磷液体培养基中,以不接菌为对照,3次重复,30℃,170 r·min-1培养6 d,测定有效磷的含量和pH值。
将20个解磷菌株对磷酸三钙的解磷量和培养液的pH值进行分析,结果如表2所示。初筛出来的20个菌株对磷酸三钙均有不同程度的降解能力,其中P7,P13的能力最强,解磷量达到300 mg·L-1以上,P6的解磷能力也较强,但稳定性相对较差[解磷量为(159.35 ±94.50)mg·L-1]。同时,培养6 d后,培养液的pH值呈下降的趋势,pH值下降了0.45~1.79。将解磷量与培养液pH值进行相关性分析,得出菌株解磷量与培养液pH值的相关系数 r=-0.84,P <0.01,达到极显著水平,回归分析后得出,Y=815.183-122.005 4 X。
将20个解磷菌株对蒙金娜培养基中卵磷脂的解磷量和培养液pH值进行分析,从表2中可以看出,仅有少数几个菌株对卵磷脂有较强的解磷能力,P3,P7,P9与对照间差异显著,P9菌株稳定性较弱,P4,P6,P8,P16,P19也有一定的解磷能力,但与对照间无显著性差异,培养液的pH值维持在一个较高水平,与对照相比,pH值最大下降了1.17,有8个培养液的pH与对照无显著性差异。将数据进行相关性分析后r=-0.61,P<0.01达到显著水平,回归分析后得出 Y=7.453-0.067 8 X。
通过以上分析得出,P7,P13的解无机磷能力最强,P7,P3解有机磷能力最强,P7能同时降解无机磷和有机磷,效果最佳。
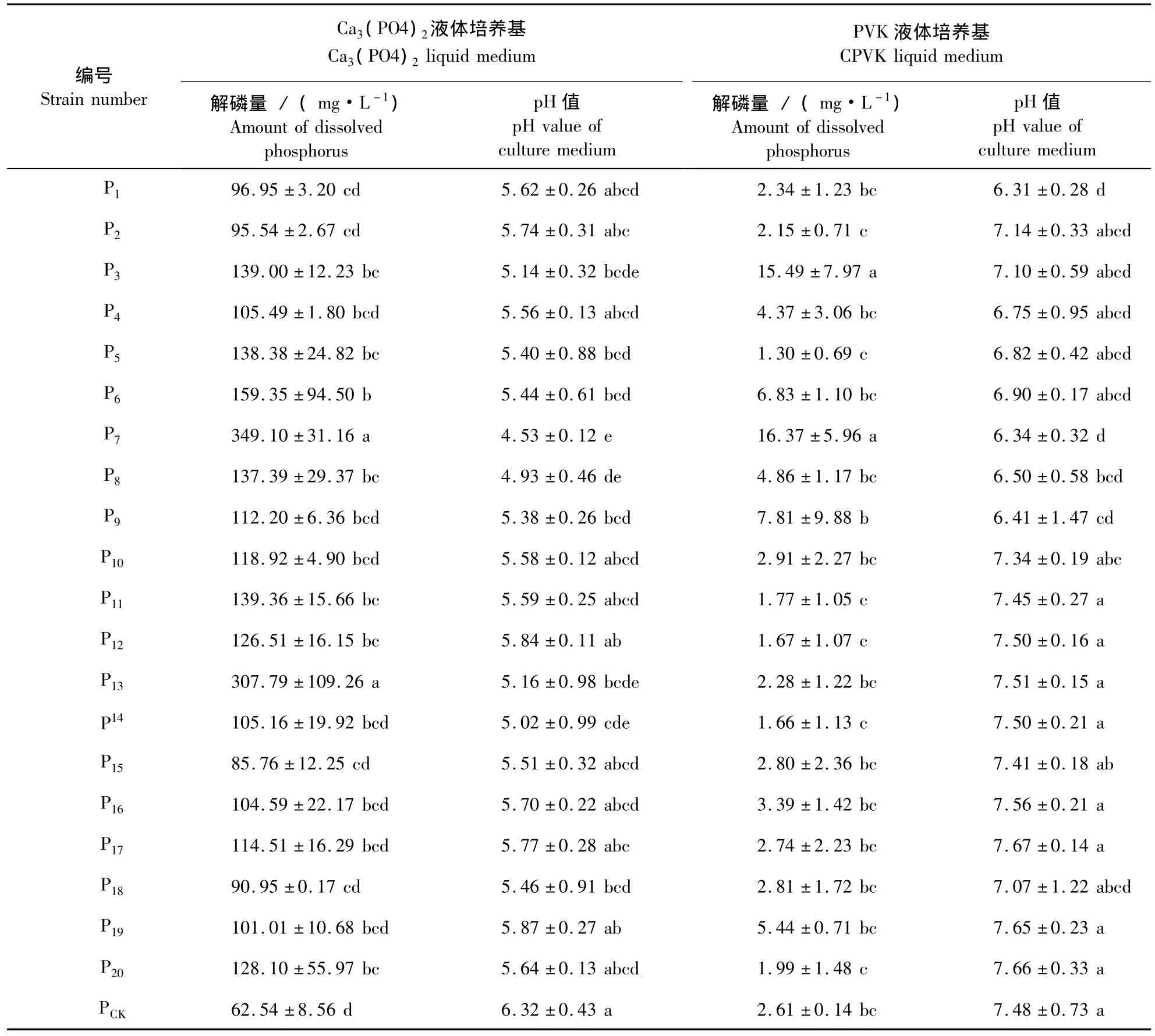
表2 解磷菌株培养6 d后对Ca3(PO4)2和PVK的解磷量及培养后培养液的pHTable 2 Amounts of phosphorus dissolved from Ca3(PO4)2and PVK after liquid cultivation for 6 days and the resulting pH values of media
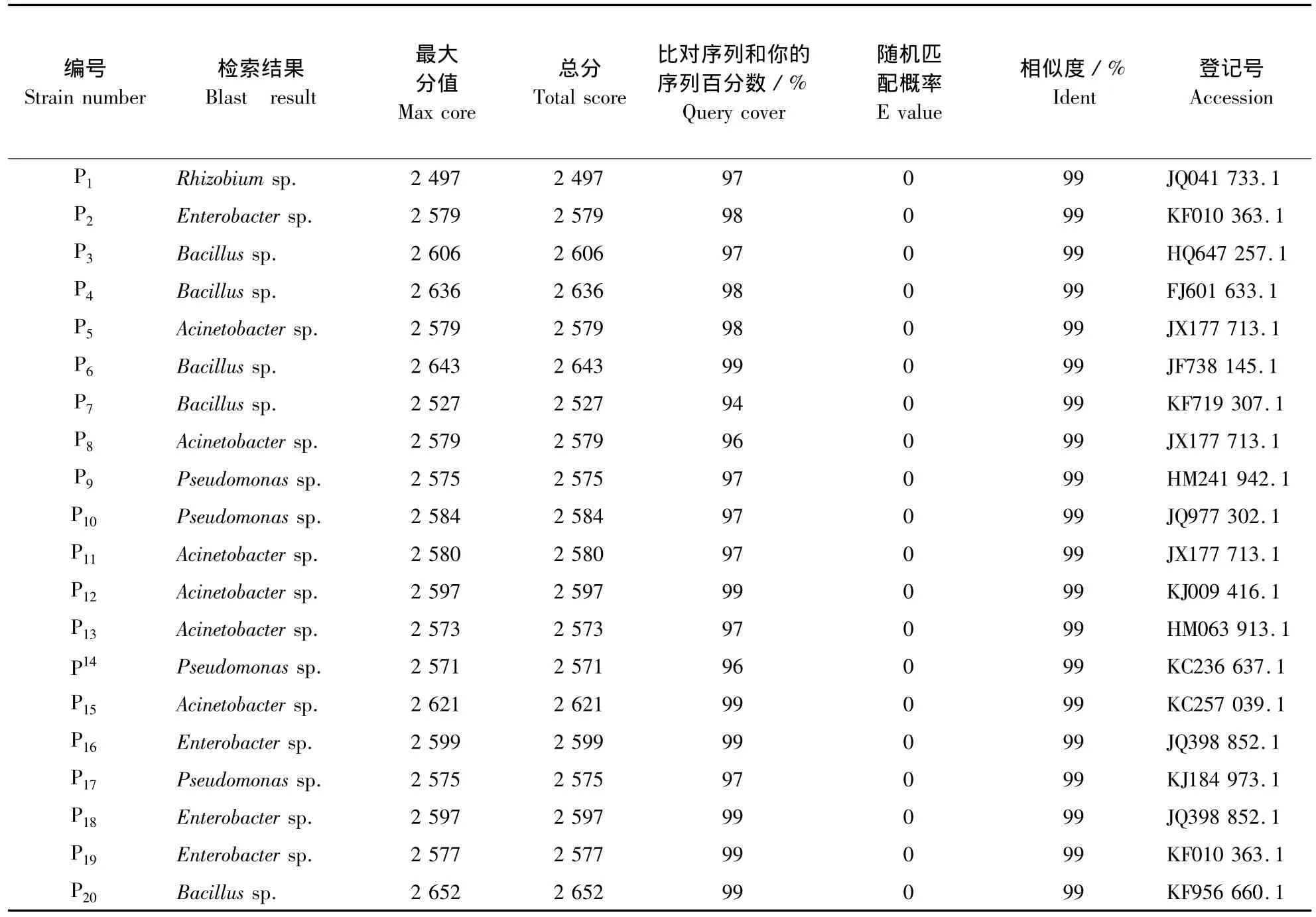
表3 枣解磷细菌16 S rDNA序列的Blast检索结果Table 3 Blastn search results for the 16 S rDNAs of different phosphate-solubilizing bacteria
2.3 16 S rDNA测序和系统发育树分析
以20个代表性菌株的DNA为模板进行PCR扩增,PCR产物测序结果拼接后,与GeneBank数据库中的已有序列进行比对,结果如表3所示:
由表3可知,筛选出的20个菌株主要是Bacillus sp.,Acinetobacter sp.、Pseudomonas sp.、Enterobacter sp.等4个属的细菌,同源性达到99%,以上属的菌株都有过报道[9-11]。
采用CLUSTALX 1.83软件进行序列比对,用MEGA5.0软件以邻近法构建系统发育树,如图1所示,测序的20个菌株序列可以分为4大类,其中 P5,P8,P11,P12,P13,P15为 1 类,与 Acinetobacter sp.(C25JX177 713.1)和 Acinetobacter sp.S3.(MAC.013HM063 913.1)等相似度最高;P4,P6,P7,P20为一类,属于 Bacillus sp.,其中 P7与 Bacillus sp.WP09-2(KF719 307.1)等相似性达99%;P2,P16,P18,P19为 1 类,与 Enterobacter sp.VITNC1(JQ398 852.1)等相似性最高,达99%以上;P9,P10,P14,P17等为1 类,属于 Pseudomonas sp,与 Pseudomonas sp.5 060(KC236 637.1)等相似性达99%,P1与Rhizobium sp.XGL136(JQ041 733.1)相似性达99%,P3与Bacillus subtilis strain F111(HQ647 257.1)相似性达99%。
3 讨论
本试验分离筛选出了具有代表性的20个解磷细菌菌株,主要 4大类,分别是Bacillus sp.,Acinetobacter sp.,Pseudomonas sp.,Enterobacter sp.等。RODRIGUEZ等人[12]研究认为,根际土壤分离的Bacillus sp.和Pseudomonas sp.有较强的解无机磷能力,本试验中解无机磷能力最强的P7属于Bacillus sp.,P13属于 Acinetobacter sp.。解无机磷菌株在培养过程中pH值均有不同程度降低,可能是由于释放了有机酸或者NH+4使培养液中酸度升高造成的。MOLLA等[13]也发现有机磷细菌有多种 ,包括 Bacillus sp.,Pseudomonas sp.,Micrococcaceae-Pribram,Serratia,Proteus等。试验中,解有机磷较强的菌株P3属于Bacillus subtilisstrain F111,P7属于Bacillus sp.,P9属于 Pseudomonas sp.,可见解无机磷和有机磷细菌之间没有明显的界限,解磷细菌在蒙金娜培养基培养过程中,培养液的pH值总体上没有明显的下降,解磷能力较强的菌株P7,P9的pH值相对较低,然而P3的pH值与对照相差不大,研究认为微生物降解有机磷主要是通过土壤微生物分泌的酸性或碱性磷酸酶,将植酸盐、磷脂等有机磷化物水解,转化为简单的无机化合物为植物所吸收利用[14]。本研究认为有些解磷细菌的解磷能力不稳定,在复筛过程中,在解无机磷培养液中P6,P13,P20的磷含量波动较大,如P6在解无机磷过程中的解磷量为(159.35 ± 94.50)mg·L-1,3 次数值之间的差异较大;在解有机磷培养液中P3,P7,P9的磷含量的变化情况也是如此,如P9在解有机磷过程中解磷量(7.81 ±9.88)mg·L-1。
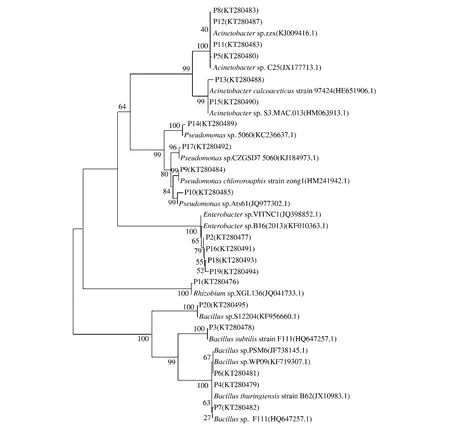
图1 枣解磷细菌的16S rDNA序列为基础的发育树Fig.1 Phylogenetic tree showing the relationship of jujube phosphate-solubilizing bacteria and related strain based on 16 S rDNA sequence
[1] 徐俊兵.扬州市土壤有机质和速效磷钾的分布研究[J].土壤,2004,36(1):99-103.
[2] WANG H,APPAN A,GULLIVER J S.Modeling of phosphorus dynamics in aquatic sediments:II-examination of model performance[J].Water research,2003,37(16):3939-3953.
[3] 赵小蓉,林启美.微生物解磷的研究进展[J].土壤肥料,2001(3):7-11.
[4] ASLANTAS R,ÇAKMAKCI R,SAHIN F.Effect of plant growth promoting rhizobacteria on young apple tree growth and fruit yield under orchard conditions[J].Scientia horticulturae,2007,111(4):371-377.
[5] 徐俊兵.扬州市土壤有机质和速效磷钾的分布研究[J].土壤,2004,36(1):99-103.
[6] 李振高,骆永明,滕 应.土壤与环境微生物研究法[M].北京:中国科学出版社,2008,107-108.
[7] 鲍士旦.土壤农化分析[M].第2版.北京:中国农业出版社,1996:69.
[8] 陈 倩,刘善江,白 杨,等.山西矿区复垦土壤中解磷细菌的筛选及鉴定[J].植物营养与肥料学报,2014(6):1505-1516.
[9] RIVAS R,PEIX A,MATEOS P,et al.Biodiversity of populations of phosphate solubilizing rhizobia that nodulates chickpea in different Spanish soils[J].Plant and Soil,2006 ,287(Suppl 1-2):23-33.
[10] S.SINGH,K.K.KAPOOR.Inoculation with phosphate-solubilizing microorganisms and a vesicular-arbuscular mycorrhizal fungus improves dry matter yield and nutrient uptake by wheat grown in a sandy soil[J].Biology and Fertility of Soils,1999,28(2):139-144.
[11] 李海云,孔维宝,达文燕,等.土壤溶磷微生物研究进展[J].生物学通报,2013(7):1-5.
[12] RODRIGUEZ H ,FRAGA R.Phosphate solubilizing bacteria and their role in plant growth promotion[J].Biotechnology Advances,1999,17,319-33.
[13] MOLLA M A Z,A.A.CHOWDHURY,A.LSLAM,et al.Microbial mineralization of organic phosphate insoil[J].Plant and Soil,1984,78(3):393-399.
[14] 盛 荣,肖和艾,谭周进,等.土壤解磷微生物及其磷素有效性转化机理研究进展[J].土壤通报,2010(6):1505-1510.

