不同提取方法对枣渣黄酮抗氧化活性和得率的影响
王 娜,王栋梁,范会平,石聚领,李 玺,宋一诺,艾志录
(1.好想你枣业股份有限公司,河南郑州451161;2.河南农业大学食品科学技术学院,河南郑州450002;3.郑州春之兰商贸有限公司,河南郑州450002)
红枣是中国的特产果品[1],属于鼠李科枣属植物的成熟果实,是兼具药食功能的滋补佳品[2],含有许多生物活性物质,如环磷酸腺苷、芦丁、多糖、黄酮类化合物等[3]。黄酮类化合物具有镇痛止泻、清除羟自由基、防治溃疡、抗氧化、抑制脂肪酶及抗过敏、抗菌、抗突变、抗癌、抗肿瘤、消炎及保肝等生理活性[4-5],所以红枣不仅具有丰富的营养,而且还有很强的医疗保健功能,常有“每日三枣,长生不老”的美誉[6]。随着科技的发展,红枣的提取工艺及检测方法也有显著性的改善,对红枣中黄酮类化合物的研究也越来越深入。有关红枣黄酮提取方法的研究很多,衡量标准多以黄酮得率为主;但在诸多研究中[7-9]并没有考虑不同提取方法对大枣黄酮抗氧化活性的影响;由于红枣在加工过程中,其皮渣大部分都被当做废物处理掉,并没有得到合理有效的利用,造成资源的浪费和环境的污染。因此,本研究以红枣枣渣为试验原料,研究不同提取工艺对枣渣黄酮的得率和抗氧化活性的影响,旨在得出既能保持枣渣黄酮的抗氧化活性又能提高枣渣黄酮得率的最适宜提取条件。
1 材料与方法
1.1 试验材料及试剂
枣渣,河南省好想你枣业股份有限公司;芦丁标准品,北京维欣仪奥科技发展有限公司;DPPH(1,1-二苯基-2-三硝基苯肼),日本东京化成工业株式会社;ABTS,美国Amresco公司;亚硝酸钠、水杨酸、氢氧化钠、硫酸亚铁、硝酸铝、双氧水、无水乙醇均为分析纯。
1.2 主要仪器与设备
T6新世纪可见紫外分光光度计,北京普析通用仪器有限公司;FA2104A型电子天平,上海精天电子仪器厂;RQ-700B型超声波清洗器,昆山市超声仪器有限公司;N-1100型旋转蒸发仪,上海朗仪器有限公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;MG08S-2B微波试验仪,南京汇研微波系统工程有限公司;冷凝回流装置,北京九二零科技有限公司;水浴锅,北京恒久科学仪器公司。
1.3 试验方法
1.3.1 枣渣黄酮提取方法的选择 根据文献[10]的方法,在此基础上稍作修改进行提取,m(料)∶V(液)=1 g ∶25 mL,提取液抽滤,得到的滤液旋转蒸发浓缩至适量,最后用体积分数70%乙醇定容,此为枣渣总黄酮的提取液。
水浴回流法:放入80℃的水浴锅中,连接好冷凝管,打开水流,冷凝回流2.5 h。
超声波提取法:放入设定温度为80℃的超声波清洗器中,连接好冷凝管,打开水流,冷凝回流2.5 h。
微波提取法:放入温度为50℃,微波功率为200 W的微波炉中提取90 s。
1.3.2 黄酮得率的测定 标准曲线的绘制根据文献[11]的方法进行,在此基础上稍作修改,将具塞试管改用为25 mL容量瓶,在各容量瓶中加入质量分数5%的NaNO2溶液1 mL,加入质量分数10%的Al(NO3)31 mL,加入质量分数4%NaOH 10 mL,然后用蒸馏水定容至25 mL,做空白对照。
1.3.3 枣渣黄酮抗氧化活性的测定
1.3.3.1 枣渣黄酮对·OH清除效果的测定
根据文献[12]的方法进行测定,并作适当修改,取0.6 mL 20 mmol·L-1水杨酸钠于10 mL 试管中,加入 1.5 mmol·L-1FeSO42 mL,加入 2 mL的样品溶液,最后以1.4 mL 6 mmol·L-1H2O2启动反应,迅速混匀,37℃恒温水浴1 h,使用1 cm比色皿,以蒸馏水作空白对照,在510 nm处测其吸光度值,并排除自身吸光度值干扰。样品、底液、空白的吸光度值分别设定为A样、A底、A空,清除率计算公式如下:
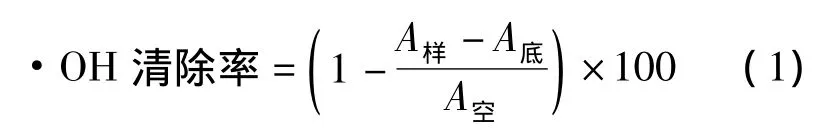
1.3.3.2 枣渣黄酮对 DPPH自由基清除效果的测定
根据文献[13]的方法进行测定,并对加样量适当修改。试验加样量如表1所示。
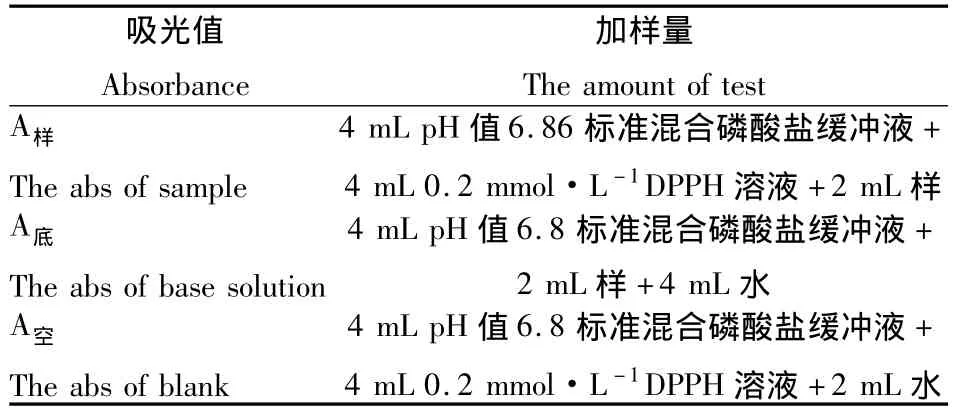
表1 DPPH试验加样量Table 1 The reagent amount of DPPH test
1.3.3.3 枣渣黄酮对 ABTS(2,2-联氮-二(3-乙基-奔并噻唑-6磺酸)二铵盐)自由基清除效果的测定
ABTS自由基工作液的配置参照文献[14],配置 2.45 mmol·L-1的 K2S2O8及 7 mmol·L-1的ABTS自由基,两者以1∶1的比例配比,置于室温、避光条件下12~16 h,配置ABTS自由基工作液,将ABTS自由基母液用无水乙醇稀释,使其在734 nm处的吸光度值为0.700±0.020。试验操作步骤参照文献[15],试验样品加样量如表2所示,室温避光放置6 min,使用1 cm比色皿,以无水乙醇作空白对照,在734 nm处测其吸光度值,并排除自身吸光度值干扰。清除率计算公式按(1)式计算。
1.3.4 微波提取工艺研究及试验设计
1.3.4.1 单因素影响试验
(1)微波提取时间对黄酮得率的影响 将样品放入温度为50℃,微波功率为200 W的微波炉中,分别提取 20、40、60、90、120、180 s后测定吸光度值,用回归方程算出黄酮得率并作图,得出最佳提取时间。

表2 ABTS自由基试验加样量Table 2 The reagent amount of ABTS·test
(2)微波功率对黄酮得率的影响 将样品放入温度为50℃的微波炉中,按最佳时间在150、200、250、300、350、450 W 的微波功率下提取,然后测定吸光度值,用回归方程算出黄酮得率并作图,得出最佳微波功率。
(3)料液比对黄酮得率的影响 将样品放入温度为50℃,在最佳功率,最佳提取时间条件下,按 m(料)∶V(液)为 1∶15、1∶20、1∶25、1∶30、1∶35、1∶40分别提取,然后测定吸光度值,用回归方程算出黄酮得率并作图,得出最佳料液比。
1.3.4.2 响应曲面优化设计
以提取时间(A)、功率(B)、料液比(C)为影响因素,根据前期单因素试验结果,设计本试验自变量因素编码及水平,自变量编码值1、0、-1分别代表自变量的高、中、低水平。黄酮得率为响应值[16-17]。
1.4 数据处理
所有试验数据用 Design-Expert 7.0.0软件,SPSS软件分析。
2 结果与分析
2.1 不同提取方法对枣渣黄酮抗氧化活性和得率的影响
不同提取方法所得枣渣黄酮抗氧化活性和得率见表3。由表3可知,微波提取法所得的黄酮得率均比水浴提取法和超声波提取法获得的黄酮得率高。对OH自由基和ABTS自由基清除率,2种方法呈现显著性差异(P<0.05),微波和水浴提取所得的黄酮对DPPH自由基清除率呈现显著性差异(P<0.05),微波提取与超声波提取所得的黄酮对于DPPH自由基清除率虽没有显著性差异,但微波提取所得黄酮对DPPH自由基清除率高于超声波提取所得黄酮对DPPH自由基清除率,由此可以看出,提取方法的不同,对黄酮的得率和抗氧化活性均有显著性影响,抗氧化活性的差异,可能与提取方法、反应体系等有关系。

表3 不同提取方法对黄酮的抗氧化活性和得率的影响Table 3 different extraction technology of flavonoids on antioxidant activity and yield %
2.2 微波提取对枣渣黄酮抗氧化活性和得率影响的单因素试验
研究表明,微波提取枣渣黄酮时,微波时间、功率及料液比等都会对黄酮的得率和抗氧化活性有一定的影响。为了确定对枣渣黄酮抗氧化活性和得率的关键影响因素,进行单因素试验。
2.2.1 微波时间对枣渣黄酮得率和ABTS自由基清除率的影响 固定微波温度50℃,m(料)∶V(液)为1 g∶25 mL,功率200 W,研究不同微波时间对试验指标的影响。结果如图1所示。
由图1可以看出,当微波时间为90 s时,黄酮的得率及对ABTS自由基清除率达到最高值;而后随着时间的增加,黄酮的得率又呈现减小的趋势,这可能是因为长时间的处理可产生暴沸现象,并且随着微波时间的延长,料液温度增高,枣渣黄酮结构发生破坏[18]。因此选取微波时间为60、90、120 s为优化试验的因素水平。
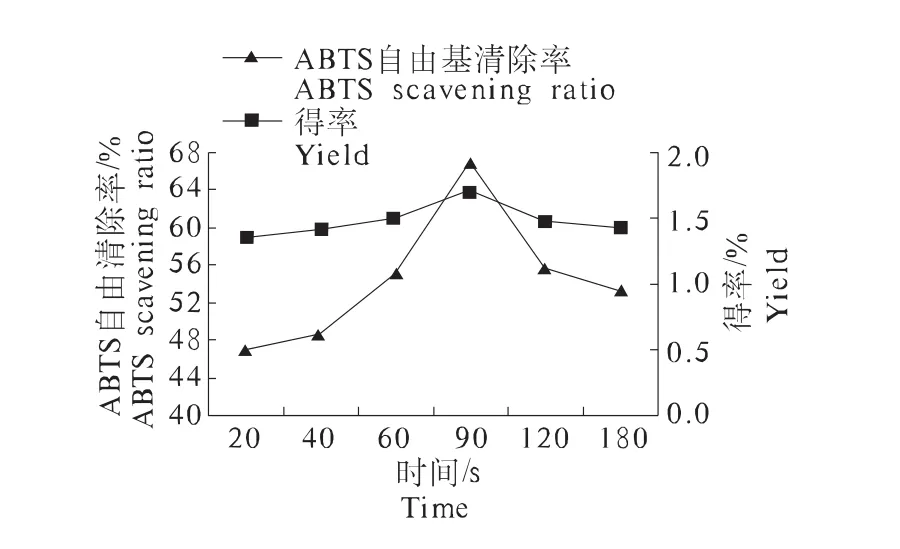
图1 微波时间对枣渣黄酮得率和ABTS自由基清除率的影响Fig.1 Effect of microwave time on jujube residues flavonoids yield and ABTS
2.2.2 微波功率对枣渣黄酮得率和ABTS自由基清除率的影响 由图2可以看出,在功率为250 W的时候,枣渣黄酮的得率及对ABTS自由基清除率相对较高。这可能是因为随着微波功率的增高,加热速率会增大,导致分子的运动速度加快,溶解、扩散渗透的速度也会加快,使枣渣黄酮类化合物较易转移到溶剂中[19],所以枣渣黄酮的得率随着功率的升高也有所升高,但当微波功率过高时,料液温度会升高,影响黄酮结构,进而使黄酮的得率又下降。因此选取微波功率为200、250、300 W为优化试验的因素水平。
2.2.3 料液比对枣渣黄酮得率和ABTS自由基清除率的影响 由图3可以看出,在料液比达到1∶35时,枣渣黄酮的得率达到最高;随着液料比的增大,枣渣黄酮对ABTS自由基清除率呈现增加的趋势;但随着液料比的继续增加,枣渣黄酮的得率又减小,这可能是因为大量溶剂水吸收了温度导致提取温度降低的缘故。因此选取料液比为1∶30、1∶35、1∶40为优化试验的因素水平。
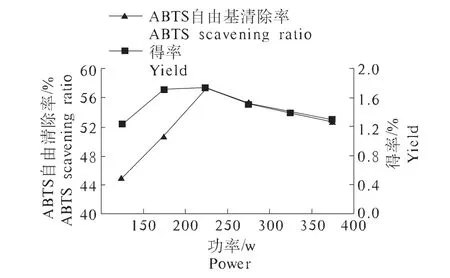
图2 微波功率对枣渣黄酮得率和ABTS自由基清除率的影响Fig.2 Effect of microwave power on jujube residues flavonoids yield and ABTS
2.2.4 不同提取工艺下黄酮得率和ABTS+·清除率相关性分析 由表4可知,在不同微波时间下,枣渣黄酮得率和ABTS自由基清除率之间相关系数是0.89,为高度线性相关;不同微波功率和不同液料比条件下,枣渣黄酮得率和ABTS自由基清除率之间相关系数分别为 0.56、0.59,为中度相关[20],由此以枣渣黄酮得率为指标,研究微波提取枣渣黄酮的最佳工艺。
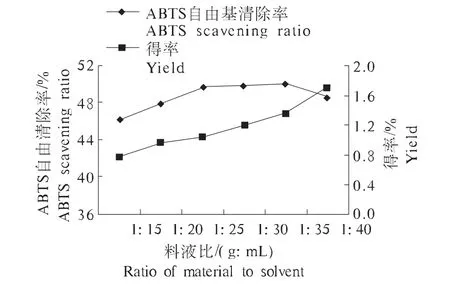
图3 液料比对枣渣黄酮得率和ABTS自由基清除率的影响Fig.3 Effect of ratio of solvent to material on jujube residues flavonoids yield and ABTS
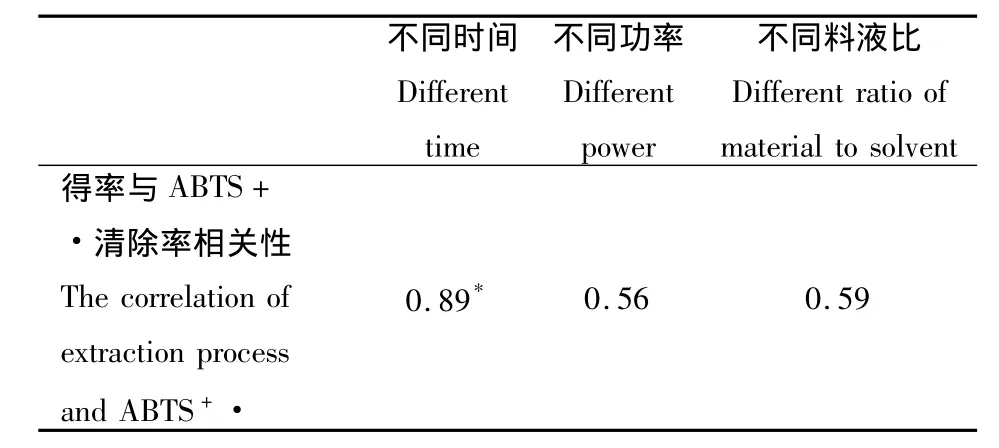
表4 不同提取工艺下黄酮得率与ABTS自由基清除率的相关性Table 4 The correlation of extraction process and ABTS
2.3 Box-Behnken响应面优化试验
在单因素试验基础上,对试验进行了3因素3水平响应面分析。见表5,结果见表6。

表5 中心组和试验Box-Behnken方案设计的因素与水平Table 5 Factors and levels in the Box-Behnken central composite design
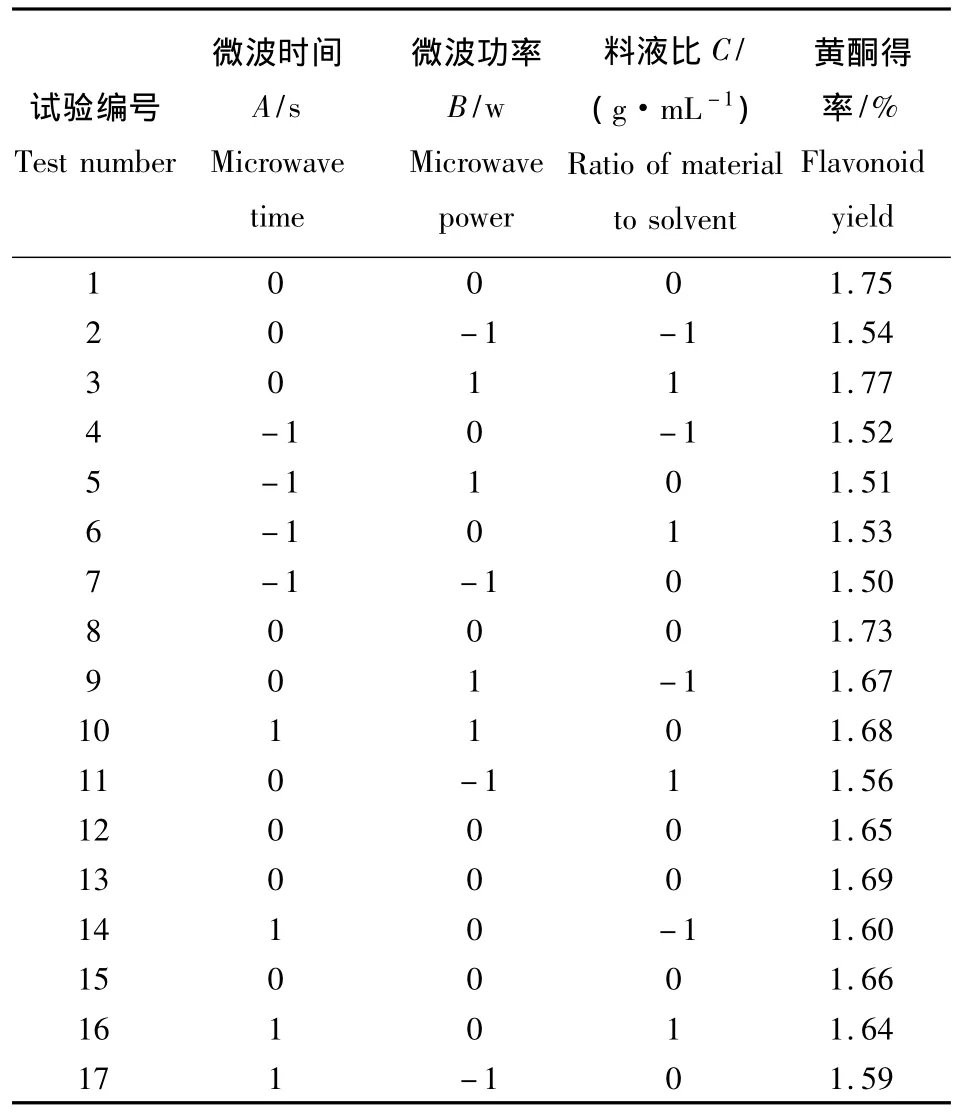
表6 Box-Behnken设计试验方案与试验结果Table 6 Box-Behnken central composite design arrangement and experimental result
利用Design Expert软件中box-behnken方法对表6中的数据进行二次多元回归拟合,得到模型为:
Y=1.70+0.044A+0.068B+0.021C-0.03AB-0.03AC+0.020BC-0.082A2-0.019B2-0.042C2
从回归方程的一次项系数可以看出,3因素影响枣渣黄酮得率的大小顺序为:功率>时间>液料比。对该模型进行显著性和回归模型系数显著性检验,结果见表7。由表7可知,模型P=0.008 6<0.01,表明该试验所选取的回归模型极其显著,失拟项P=0.667 7为不显著以及信噪比为8.840远大于4,而且预测值与试验值之间有较好的相关性(R2=0.901 0=0.773 6),由此可知,回归方程拟合度和可信度均很高,能够很好地对枣渣黄酮的得率进行预测。由表7回归模型系数显著性检验结果可知,模型C项不显著,A、B项显著;交互项 AB、AC、BC 均不显著,二次项 A2极显著,B2、C2项不显著;表明各个影响因素与响应值不是简单的线性关系。
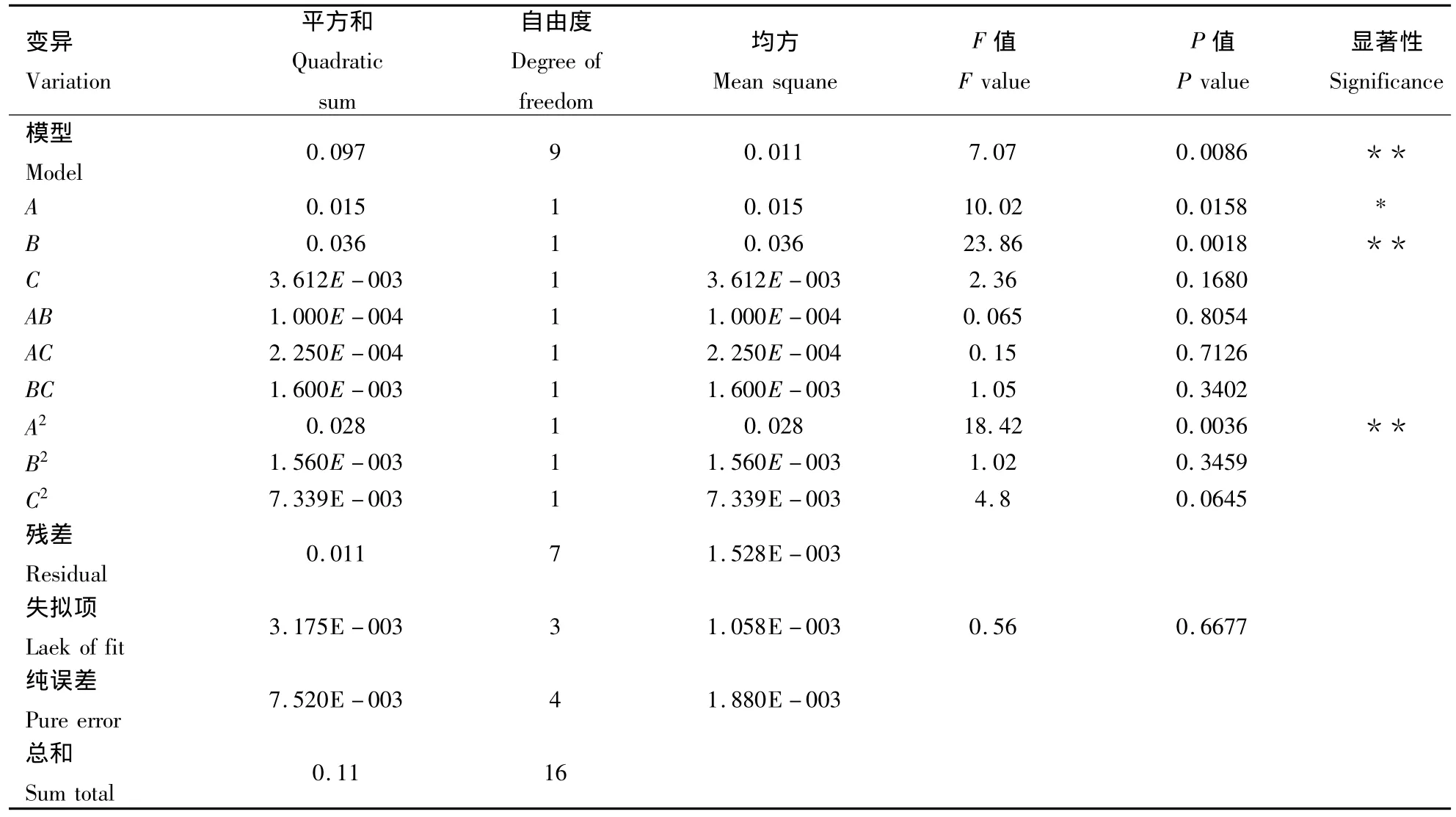
表7 枣渣黄酮得率二次多项模型方差分析表Table 1 Quadratic model variance analysis of the jujube residues flavonoids yield
经过Design Expert 7.0.0软件得到的各因素响应面图,见图4~图6。
由图5~图6可知,当料液比一定时,随着微波功率的上升,枣渣黄酮的得率先增加后减小,但减小趋势不明显;随着微波时间的增加,枣渣黄酮的得率呈现先增加后减小的趋势。当微波功率一定时,随着料液比上升,枣渣黄酮的得率呈现先增加后减小的趋势;随着微波时间的增加,枣渣黄酮的得率也呈现先增加后减小的趋势。当微波时间一定时,随着液料比的上升,枣渣黄酮的得率呈现先增加后减小的趋势;随着微波功率的上升,枣渣黄酮的得率先增加后减小,但减小趋势不明显。以上分析与单因素结果趋于相同。
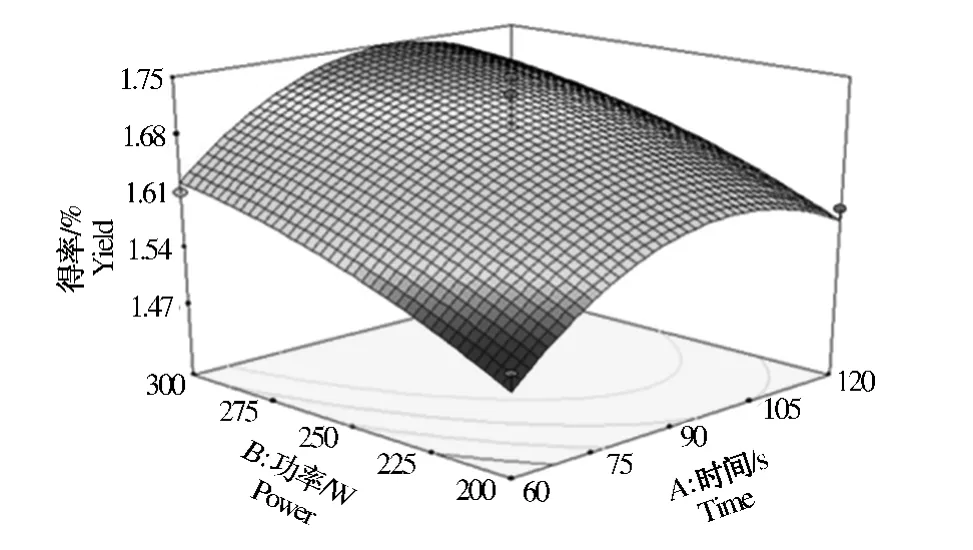
图4 微波功率、时间对枣渣黄酮得率的影响Fig.4 Effect of microwave power and time on jujube residues flavonoids yield
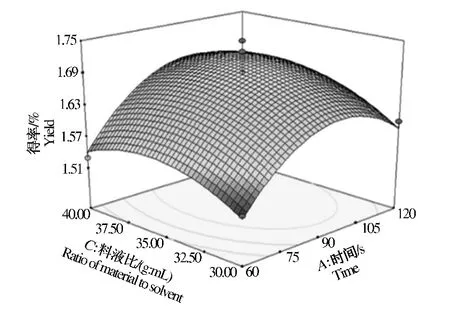
图5 料液比、时间对枣渣黄酮得率的影响Fig.5 Effect of ratio of material to solvent and time on jujube residues flavonoids yield
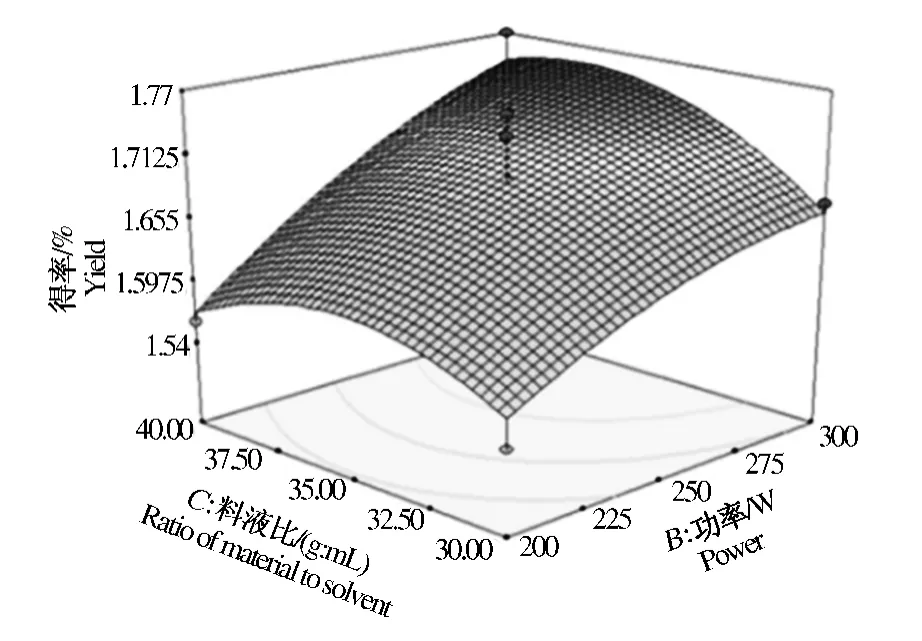
图6 料液比、功率对枣渣黄酮得率的影响Fig.6 Effect of ratio of solvent to material and microwave power on jujube residues flavonoids yield
总体分析,此回归方程拟合试验结果较理想,且呈现较好的显著性,利用Design Expert 7.0.0软件综合分析,微波时间97.82 s,微波功率 300.00 W,料液比 1∶37.58(g∶mL),在此条件下的理论结果黄酮得率为1.760 0%。为了实际操作的方便,将此条件修正为料液比1∶38(g∶mL),微波功率300 W,时间98 s。
2.4 验证试验
为了检验此模型预测的准确性,按照最佳提取条件进行提取,试验重复操作3次。试验结果见表8。试验的平均相对标准偏差为3.13,精密度较好[21],证明本次的试验误差较小,因此,优化得到的微波提取条件参数准确、可靠,具有实用价值。在此试验条件下所得的ABTS自由基清除率为66.09%。
3 结论
提取工艺对枣渣黄酮的得率和抗氧化活性均有影响,尤其抗氧化活性。同水浴提取法、超声波提取法相比,微波提取法黄酮得率和抗氧化活性最高,微波提取法经响应面优化得出最优工艺条件:料液比1∶38(g∶mL),微波功率 300 W,提取时间98 s,黄酮得率为1.8%,ABTS自由基清除率为66.09%。

表8 验证试验结果Table 8 The results of verification testing
[1] 张宝善,陈锦屏,李 强,等.红枣汁的提取方法[J].食品与发酵工业,2003,29(12):67-71.
[2] 赵文亚.红枣皮渣中总黄酮提取工艺的研究[J].中国食品添加剂,2011(3):82-85.
[3] 刘润平.红枣的营养价值及其保健作用[J].中国食物与营养,2009(12):50-52.
[4] 许 钢.苦养麦黄酮提取最佳条件及抗氧化研究[J].中国食品学报,2008,8(3):78-82.
[5] COOK N C,SAMMAN S.Flavonoids-chemistry,metabolism,cardioprotective effects,and dietary sources[J].Joumal of Nutritional Biochemistry,1996,7:66-76.
[6] 李 佳,张永清.大枣化学成分研究概况[J].中国现代中药,2012,13(11):49-51.
[7] 张平平,李 黎,张东东,等.金丝新4号枣果中黄酮类物质提取及纯化工艺的研究[J].2009,25(6):75-79.
[8] 韩 璐,王亚丽,依明尕·哈甫,等.大枣中总黄酮和多糖的提取及含量测定[J].现代仪器,2010(2):34-36.
[9] 霍文兰,刘步明,曹艳萍.陕北红枣总黄酮提取及其抗氧化性研究[J].食品科技,2006(10):45-47.
[10] 陈乃富.蕨菜黄酮类化合物的提取及其抗氧化作用[J].食品与发酵工业,2003,29(11):63-66.
[11] 闵运江,张银萍,高 琼,等.安徽产10种委陵菜植物总黄酮的提取工艺与含量研究[J].食品与发酵工业,2008,34(6):176-179.
[12] 艾志录,王育红,潘治利,等.苹果渣中多酚物质的抗氧化活性研究[J]食品科学,2006,27(12):160-163.
[13] 赵艳红,李建科,李国秀.天然抗氧化物体外活性评价方法的优选与优化[J].食品科学,2008,29(6):64-69.
[14] 潘乔丹,熊圆圆,陈文东,等.扁担藤不同极性成分抗氧化活性研究[J].中国实验方剂学杂志,2013,19(1):232-235.
[15] 彭芍丹,李积华,唐永富,等.菠萝蜜不同部位抗氧化性的研究[J].热带作物学报,2013,34(9):1737-1741.
[16] 田启建,欧阳辉,余 佶,等.超临界萃取杜仲翅果仁油工艺的响应面优化[J].食品与发酵工业,2009,35(6):193-195.
[17] 刘 伟,南光明,李紫薇,等.响应面法优化新疆若羌大枣总黄酮提取工艺及抗氧化活性[J].食品科学,2012,33(22):123-126.
[18] 李凤英,崔蕊静,李春华.采用微波辅助法提取葡萄籽中的原花青素[J].食品与发酵工业,2005,35(1):39-42.
[19] 赵二劳,盖青青,张海容.微波萃取沙棘黄酮的研究[J].食品与发酵工业,2004,30(12):148-150.
[20] 余建英,何旭宏.数据统计分析与spss应用[M].北京:人民邮电出版社,2003:164.
[21] 刘天煦.化验员基础知识[M].北京:化学工业出版社,2003:153.

