术前凝血检测对于评估根治性非小细胞肺癌患者预后的意义
索海进 张华 朱建权 刘俊 王长利
术前凝血检测对于评估根治性非小细胞肺癌患者预后的意义
索海进 张华 朱建权 刘俊 王长利
目的 评估术前常规凝血功能检测水平与非小细胞肺癌(NSCLC)患者行根治性完整切除术后总生存率的相关性。方法 选取2004年1月至2008年12月在天津医科大学肿瘤医院行完全性切除手术的NSCLC患者754例。利用Kruskall-Wallis和Mann-Whitney U检验,评价术前常规凝血检测水平与其他变量的相关性,并且通过单变量和多变量分析确定凝血功能的术前水平和总体生存率之间的关联。结果 所有术前常规凝血检测指标(血浆凝血酶原时间、国际标准化比值、活化部分凝血活酶时间、凝血酶时间、纤维蛋白原、D-二聚体)水平与NSCLC患者T分期及临床分期均存在相关性。单因素分析显示,术前凝血试验中血浆凝血酶原时间(χ2=8.254,P=0.004)和国际标准化比值(χ2=5.4.4,P =0.020)延长,以及异常升高的纤维蛋白原(χ2=9.184,P=0.002)和D-二聚体(χ2=9.184,P=0.002)水平提示预后较差。多变量模型证实术前D-二聚体为NSCLC患者预后的独立因素(OR=1.274,95% CI:1.040~1.559,P=0.019)。结论 术前凝血检测中血浆凝血酶原时间和国际标准化比值延长以及纤维蛋白原和D-二聚体水平升高提示NSCLC患者预后不良,而术前凝血检测中D-二聚体是行根治性手术NSCLC患者的独立预后因素。
癌,非小细胞肺; 预后; D-二聚体
近来,人们进行了大量的生物数据收集以及一些实验研究,认为恶性肿瘤和凝血系统之间存在关联[1]。在恶性肿瘤患者中凝血级联反应被激活[2]。肿瘤细胞能够产生促凝血因子,在炎症介质介导下,这些促凝血因子能直接或间接地激活凝血系统。在一些如含有 K-ras、表皮生长因子受体(epidermal growth factor receptor,EGFR)、人第10号染色体缺失的磷酸酶 (phosphatase and tensin homolog deleted on chromosome ten,PTEN)基因或p53基因表达的致癌事件肿瘤细胞中,可见促凝血因子水平升高以及活性增强,会促进肿瘤侵袭性生长以及血管生成和高凝状态[3]。现在已经认识到肿瘤生物学和凝血过程之间的相关性[4]。通常癌症患者表现出潜在的高凝血状态以及一个或多个凝血指标异常。但在肺癌、胰腺癌和胃肠道恶性肿瘤患者更易于出现高凝状态[5]。一些临床研究以及实验数据已经提示凝血激活促进癌细胞播散[6],且许多研究提示肿瘤诱发的凝血指标异常进一步促进炎症细胞介质的聚集、肿瘤间质细胞生成以及血管生成[7]。所有上述研究表明凝血系统激活的肿瘤侵袭性更强和转移风险更高。在肺癌患者中,纤维蛋白原(fibrinogen,Fbg)、D-二聚体等凝血和纤溶系统标志物水平升高可能与生存率降低有关[8-10]。本研究主要评估术前常规凝血检测水平与其他临床和实验室检查变量之间可能的关联,以及探索完整切除术后非小细胞肺癌(nonsmall cell lung cancer,NSCLC)患者的术前常规凝血检测水平的预后价值。
资料与方法
一、临床资料
选择天津医科大学肿瘤医院在2004年1月1日至2008年12月31日期间所有行肺叶切除术或全肺切除术以及肺门纵隔系统性淋巴结清扫的NSCLC患者,均经病理检查确诊。患者排除标准: (1)行姑息性手术;(2)术前行放射治疗或手术切缘阳性;(3)曾患有血栓性疾病史;(4)伴有其他类型的恶性肿瘤;(5)首次住院期间或术后1个月内死亡;(6)研究期间失访。基于以上排除标准,最终共有754例NSCLC患者被纳入本项研究。患者术后化疗包括长春瑞滨、紫杉醇、吉西他滨加卡铂或顺铂。根据经订正的世界健康组织分类法[11]和第7版TNM分类法确定肺癌的病理诊断和分期[12]。所有患者随访到2012年12月31日为止。
二、方法
采集患者术前2~10 d的空腹静脉血样本,常规凝血测定。采用微粒子酶免疫分析法(免疫分析仪,美国雅培)检测D-二聚体水平;采用CA 7000自动化分析仪(希森美康,日本)检测PT、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)和Fbg水平。
三、统计学分析
采用SPSS 18.0软件进行统计学分析。计数资料用χ2检验,非参数检验Kruskal-Wallis和Mann-Whitney U检验被用来评估其他实验室或临床参数和凝血试验的相关性。总生存期(overall survival,OS)被定义为手术日期和死亡或最后一次随访日期之间的间隔。生存曲线Kaplan-Meier法统计生存率,组间生存率采用log-rank单因素分析以及多因素Cox比例风险回归模型。P<0.05表示差异有统计学意义。
结果
一、一般病例资料
观察对象的临床和实验室检查的参数范围见表1,各项凝血指标的正常值、中位值或频数和变化情况见表2。其中651例患者行肺叶切除术+区域淋巴结清扫术。研究人群的病理分期分布:Ⅰ:325;Ⅱ:156;ⅢA:273。整个观察人群的年龄为24~82岁,平均58岁;随访期1~99个月,平均44.2个月,中位数44.0个月。整个研究人群的5年生存率为47.9%。
二、凝血功能指标和各项变量之间的相关性
表3总结了凝血功能指标和其他变量之间的相关性。性别与凝血试验中PT、APTT和Fbg有显著的相关性(χ2=10.276,P=0.009;χ2=4.300,P=0.018;χ2=19.426,P<0.001)。男性肺癌患者凝血功能异常,NSCLC病理类型与凝血因子 PT、INR、APTT、Fbg、D-二聚体、血小板(platelet,PLT)计数具有相关性(χ2=15.277,P<0.001;χ2=14.207,P=0.001;χ2=17.410,P<0.001;χ2=70.680,P<0.001; χ2=10.480,P=0.003;χ2=14.465,P<0.001),鳞癌患者表现出更多凝血功能异常。肿瘤大体位置与PT、INR、APTT、TT、Fbg及PLT呈显著相关(χ2= 4.244,P=0.034;χ2=5.012,P=0.01;χ2=2.681,P =0.032;χ2=3.639,P=0.004;χ2=25.581,P<0.001;χ2=5.180,P<0.001),提示中央型肿瘤有更多激活的凝血级联。T分期与 PT、INR、APTT、TT、Fbg、D-二聚体及PLT相关,(χ2=36.927,P=0.001;χ2=39.135,P<0.001;χ2=33.285,P<0.001; χ2=15.326,P=0.001;χ2=75.777,P<0.001;χ2= 17.747,P=0.001;χ2=33.256,P<0.001)。相似地,病理分期与PT、INR、APTT、TT、Fbg、D-二聚体及PLT也显著相关(χ2=11.310,P<0.001;χ2= 9.488,P<0.001;χ2=12.626,P<0.001;χ2= 7.675,P<0.001;χ2=26.714,P<0.001;χ2= 6.299,P=0.002;χ2=16.639,P=0.003)。而淋巴结转移仅与INR呈显著正相关(χ2=1.122,P=0.045)。
患者5年生存率单因素分析结果见表4。PT>10.6 s患者有显著差生存率(χ2=8.254,P=0.004,图1A)。同样,INR延长影响预后且有统计学意义(χ2=5.404,P=0.020,图1B)。相比那些低于中位值患者相比,高于Fbg中位值的患者显示预后更差(χ2=9.184,P=0.002,图1C)。D-二聚体水平异常升高强烈的预示预后较差(P=0.002,图1D)。病理分期(OR=1.787,95%CI:1.581~2.020,P<0.001)和D-二聚体(OR=1.274,95%CI:1.040~1.559,P=0.019)在多因素分析中具有统计学意义。
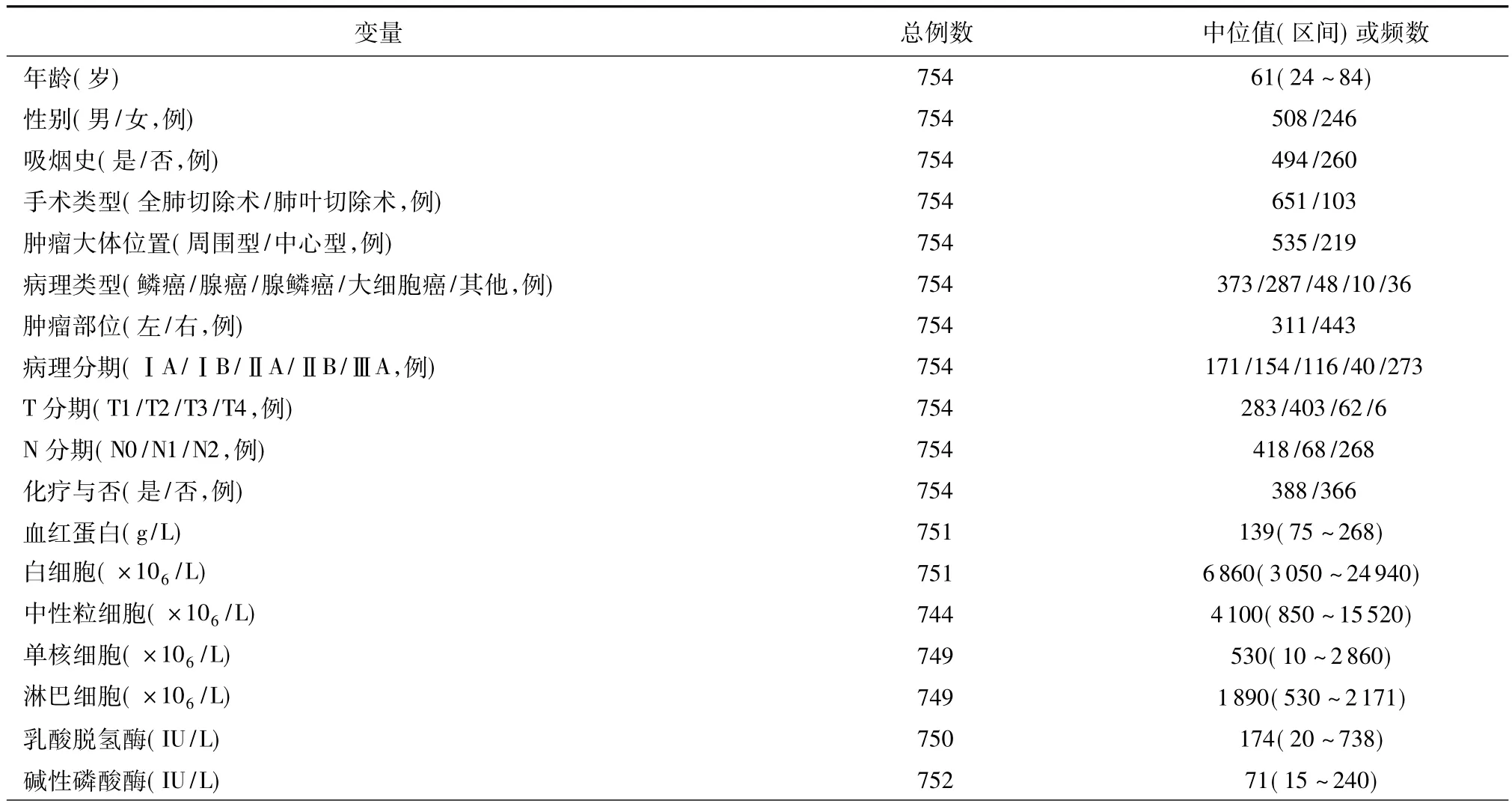
表1 非小细胞肺癌患者临床病理学以及血液学特征
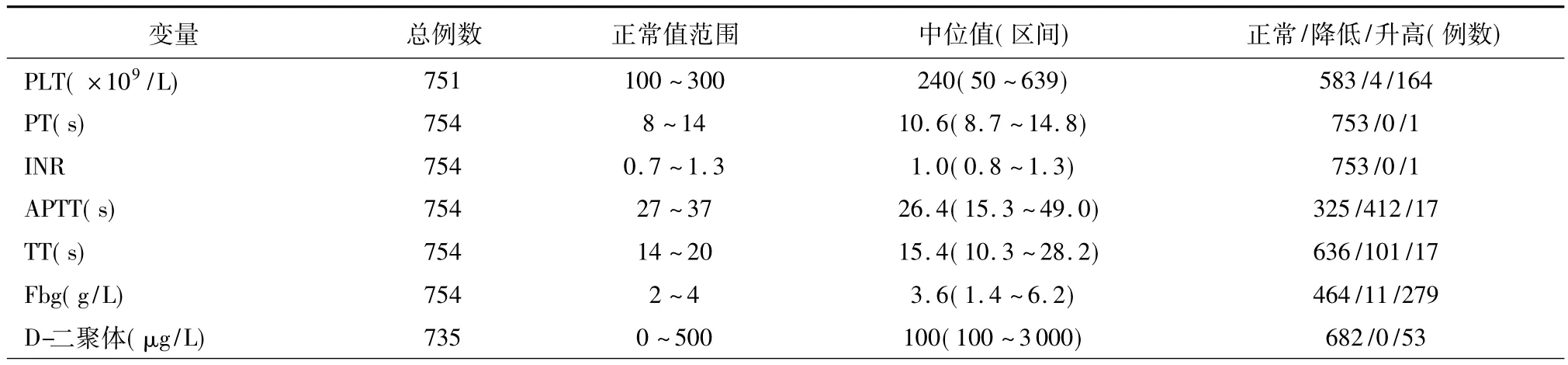
表2 非小细胞肺癌患者各项凝血指标的临床病理学特征

表3 非小细胞肺癌患者凝血功能指标与各项变量之间的相关性(中位值)

(续表3)
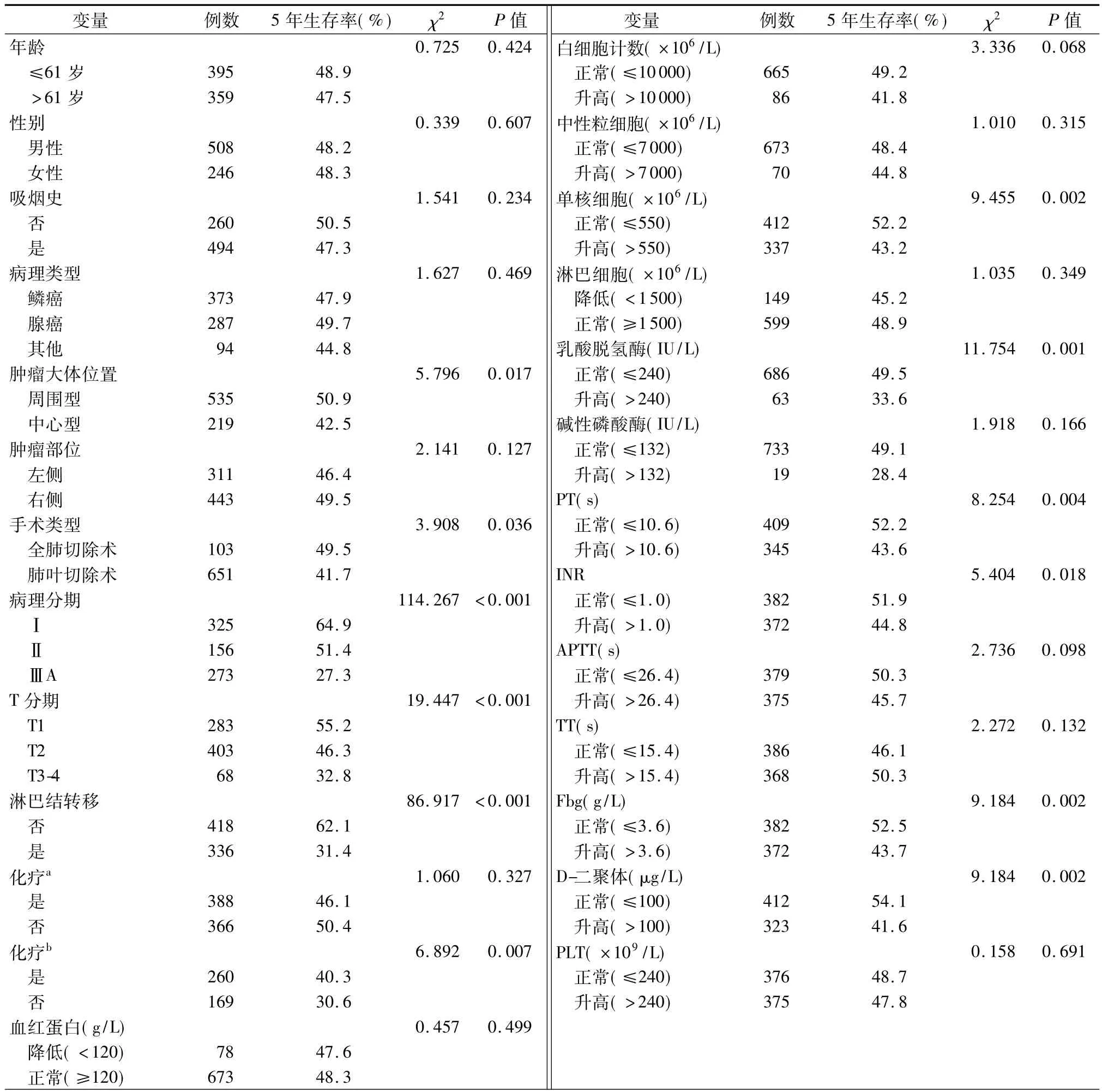
表4 NSCLC患者的5年生存率单因素分析
注:a表示病理分期Ⅰ-ⅢA;b表示病理分期Ⅱ~ⅢA;PT表示凝血酶原时间;INR表示国际标准化比值;APTT表示活化部分凝血活酶时间; TT表示凝血酶时间;Fbg表示纤维蛋白原;PLT表示血小板计数
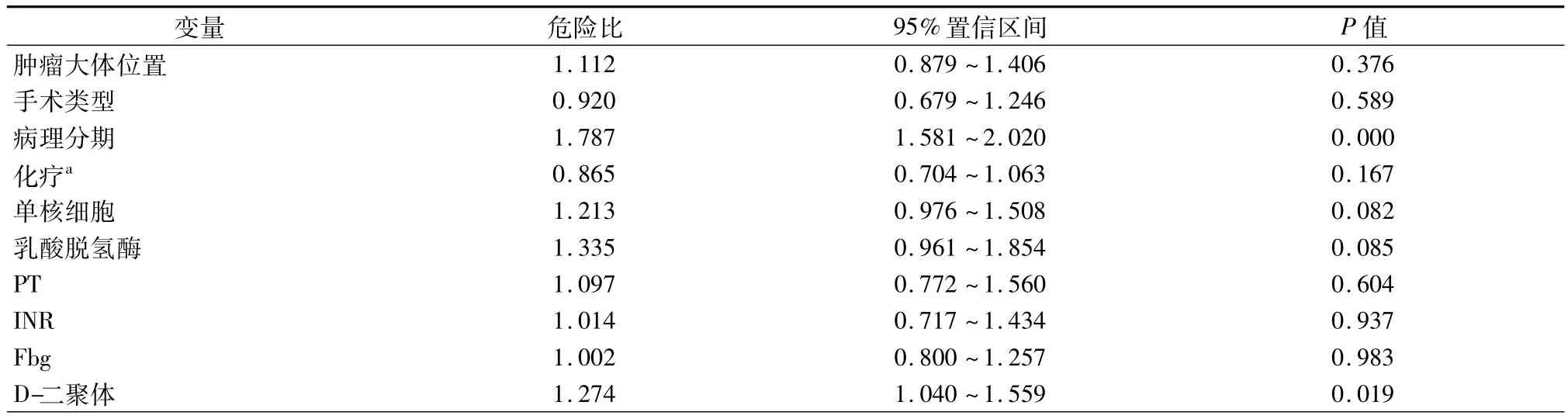
表5 NSCLC患者的多因素分析
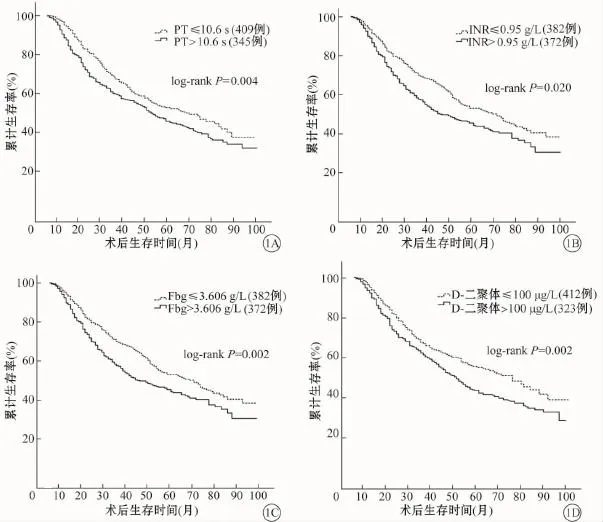
图1 不同NSCLC患者预后比较。A为不同PT组间比较;B为不同INR组间比较;C为不同Fbg组间比较;D为不同D-二聚体组间比较
讨论
凝血与纤溶系统激活时常伴随有恶性肿瘤,虽然许多研究涉及血液高凝状态和恶性肿瘤患者血栓栓塞并发症的原因,所涉及的机制尚不完全清楚。约90%的癌症伴转移患者和约一半的癌症患者有凝血参数异常现象[13]。已经报道了通过凝血参数异常的程度来评估许多恶性肿瘤,如肺癌、乳腺癌、结直肠癌等肿瘤分期及预后[14-15]。
本研究探讨NSCLC患者术前凝血检测评估预后的价值。有一些研究报道了肿瘤病理组织学亚型和凝血因子[9-10,16-17]之间不尽相同的关系。Jones等[17]报道了肺鳞癌患者与腺癌患者相比,血浆中Fbg水平更高。Tas等[16]发现肺鳞状细胞癌患者D-二聚体水平显著高于肺腺癌患者。在我们的研究中发现,肺癌患者组织学亚型和凝血因子之间有统计学意义,与腺癌患者相比,鳞癌患者显示更高的凝血倾向。尽管凝血因子没有显示与肺癌组织学亚型的联系[9-10],但是凝血因子与肿瘤分期有典型的关联[9,17]。在目前研究中已经证实了T分期和病理分期的NSCLC和所有凝血因子显著相关性。我们的研究结果提示NSCLC进展的过程中凝血系统级联反应激活,这与此前的研究报道肺癌患者凝血激活与肿瘤进展显著相关[17]相一致。在肺癌以及其他恶性肿瘤中已经观察到凝血功能异常,其中涉及PLT数量增多以及Fbg、D-二聚体水平升高[18-19]。PLT数量增多见于转移性疾病患者中,已与广泛的疾病相关联,也包括肺癌[20]。几项研究报道PLT增多在肺癌患者中是一个独立的预后因素[20-21],而在其他疾病中不是一个独立的预后因素[22]。在我们的研究中观察到751例肺癌中164名患者(22%) PLT高于300×109/L,因此,作者认为血小板在肺癌组织中的预后价值有待于进一步研究。在肺癌患者中发现 Fbg水平升高亦有 PLT数量增高的表现[23]。当Fbg水平正常,PT水平延长提示凝血因子的损耗或存在特异性的抑制因子参与此凝血级联反应[23]。与Ferrigno等[24]报道一致,PT延长在NSCLC患者预后较差,多变量分析未能证实PT在NSCLC中的预后价值。然而,Tas等[16]揭示延长PT和INR的单因素分析和多因素分析中的意义。同样对PT和INR仅单因素分析有意义。Tas等[16]报道APTT延长缩短患者的生存期,但差异无统计学意义(P=0.104)。
Fbg通过凝血酶激活形成纤维蛋白,在凝血机制中起着关键的作用,同时在肿瘤的血管生成中发挥重要症作用[25]。由肿瘤细胞分泌的炎症介质因子白细胞介素6(interleukin-6,IL-6)诱使肝脏生成Fbg,促进肿瘤血管生成[26]。国内学者发现NSCLC进展期患者化疗有效导致血浆Fbg含量减少,提出了Fbg可作为如CEA、CA125对中晚期NSCLC化疗疗效评价的一种生物标志物[27]。本研究中我们发现术前血浆Fbg水平升高患者预后较差,此结果与Ferrigno等[24]的报道一致。D-二聚体是凝血过程中降解纤维蛋白形成的小的交联纤维蛋白片段,是纤溶增强的敏感标记[28]。各种研究已经表明,D-二聚体水平升高提示乳腺癌[29]、大肠癌和肺癌[14-15,30-31]患者预后差。一项包含826例肺癌患者的调查显示,多变量分析中D-二聚体被确定为一个独立的预后因子,这项研究包括 37%(305/826)Ⅳ期患者[14]。Taquchi等[15]表明血浆中D-二聚体水平升高是肺癌患者预后不良的预测因子。多项研究报道,在进展期肺癌患者中,D-二聚体水平升高,生存率下降[15,30-31]。此外,由于上述三项研究的样本量太小,小细胞肺癌患者也被列入其研究中。术前D-二聚体在NSCLC患者中的临床意义一直未进行深入的调研。在本研究中进行了多因素生存分析,发现D-二聚体水平是影响NSCLC患者预后的危险因素,且通过血浆中D-二聚体水平反映了凝血激活与预后更差、侵袭性更强的肿瘤之间的关系,充分说明血浆D-二聚体在NSCLC患者的预后和纤溶激活之间扮演着重要角色。本研究提示对于NSCLC患者抗凝治疗效果不相一致,总体来说没有足够证据显示NSCLC患者能从口服抗凝血剂获益,所以对于发现哪些肺癌患者能从抗凝治疗获益是必要的。本研究表明,术前PT延长、INR增大以及Fbg和D-二聚体水平升高的NSCLC患者预后较差。尤其是多因素模型分析证实了D-二聚体的预后价值。这些结果可能提示特定的患者能从抗凝治疗中获益。
总之,目前的研究证实凝血激活往往是存在于NSCLC患者中。在单因素分析中,术前外周血PT延长、INR增大以及Fbg和D-二聚体水平升高与患者预后较差相关。在多变量分析中,术前血浆D-二聚体水平是影响NSCLC患者行根治性切除后预后的独立危险因素。目前,在各医院中外周血凝血功能和D-二聚体水平检测均简便易行,成本低,可以用来评估肺癌患者的预后,因此,通过术前检测患者外周血中凝血功能以及D-二聚体水平,来评估NSCLC患者行根治性手术的预后将为临床提供方便、快捷的指导。关于凝血功能以及D-二聚体水平检测更深入的价值仍需通过临床多中心以及更大的样本量来证实。
1 Lyman GH,Khorana AA.Cancer,clots and consensus:new understanding of an old problem[J].J Clin Oncol,2009,27(29): 4821-4826.
2 Lyman GH,Bettigole RE,Robson E,et al.Fibrinogen kinetics in patients with neoplastic disease[J].Cancer,1978,41(3): 1113-1122.
3 Rak J,Milsom C,May L,et al.Tissue factor in cancer and angiogenesis:the molecular link between genetic tumor progression,tumor neovascularization, and cancer coagulopathy[J].Semin Thromb Hemost,2006,32(1):54-70.
4 Winter PC.The pathogenesis of venous thromboembolism in cancer: Emerging links with tumor biology[J].Hematol Oncol,2006,24 (3):126-133.
5 Dvorak HF.Thrombosis and cancer[J].Hum Pathol,1987,18(3): 275-284.
6 Amirkhosravi A,Meyer T,Amaya M et al.The role of tissue factor pathway inhibitor in tumor growth and metastasis[J].Semin Thromb Hemost,2007,33(7):643-652.
7 Rickles FR,Levine MN,Dvorak HF.Abnormalities of hemostasis in malignancy//In:Colman RW,Hirsh J,Marder VJ,et al.Hemostasis and thrombosis.Basic principles and clinical practice[M].4th ed.Philadelphia:Lippincott Williams and Wilkins,2001:1131-1152.
8 BuccheriG, Ferrigno D, GinardiC, et al. Haemostatic abnormalities in lung cancer:prognostic implications[J].Eur J Cancer,1997,33(1):50-55.
9 Seitz R,Rappe N,Drus M,et al.Activation of coagulation and fibrinolysis in patients with lung cancer:relation to tumor stage and prognosis[J].Blood Coagul Fibrinolysis,1993,4(2):249-254.
10 GabazzaEC, TaguchiO, YamakamiT, etal.Evaluating prethrombotic state in lung cancer using molecular markers.Chest,1993,103(1):196-200.
11 Brambilla E,Travis WD,Colby TV,et al.The new World Health Organization classification of lung tumors[J].Eur Respir J,2001,18(6):1059-1068.
12 Detterbeck FC,Boffa DJ,Tanoue LT.The new lung cancer staging system[J].Chest,2009,136(1):260-271.
13 Goad KE,Gralnick HR.Coagulation disorders in cancer[J].Hematol Oncol Clin North Am,1996,10(2):457-484.
14 Buccheri G,Torchio P,Ferringo D.Plasma levels of D-dimer in lung cancer[J].Cancer,2003,97(12):3044-3052.
15 Taguchi O,Gabazza EC,Yasui H,et al.Prognostic significance of plasma D-dimer levels in patients with lung cancer[J].Throax,1997,52(6):563-565.
16 Tas F, Kilic L, Serilmez M, et al.Clinical and prognostic significance of coagulation assays in lung cancer[J].Respir Med,2013,107(3):451-457.
17 Jones JM,McGonigle NC,McAnespie M,et al.Plasma fibrinogen and serum C-reactive protein are associated with non-small cell lung cancer[J].Lung Cancer,2006,53(1):97-101.
18 Edwards RL,Rickles FR,Moritz TE,et al.Abnormalities of blood coagulation tests in patients with cancer[J].Am J Pathol,1987,88 (5):596-602.
19 Gouin-Thibault I, SamamaMM.Laboratorydiagnosisofthe thrombophilic state in cancer patients[J].Sem Throm Hemost,1999,25(2):167-172.
20 Pedersen LM,Milman N.Prognostic significance of thrombocytosis in patients with primary lung cancer[J].Eur Respir J,1996,9(9): 1826-1830.
21 Tomita M,Shimizu T,Hara M, et al.Prognostic impact of thrombocytosis in resectable non-small cell lung cancer[J].Interact Cardiovasc Thorac Surg,2008,7(4):613-615.
22 Cakar B,Karaoglanoglu M,Sayici Y,et al.The prognostic value of thrombocytosisin newly diagnosed lung cancer patients: a retrospective analysis[J].J BUON,2011,16(4):677-681.
23 Owen CAJ,Bowie EJW,Thompson JHJ.The diagnosis of bleeding disorders[M].Boston:Little,Brown&Company,1975.
24 Ferrigno D,Buccheri G,Ricca I.Prognostic significance of blood coagulation tests in lung cancer[J].Eur Respir J,2001,17(4): 667-673.
25 Staton CA,Brown NJ,Lewis CE.The role of fibrinogen and related fragments in tumor angiogenesis and metastasis[J].Expert Opin Biol Ther,2003,3(7):1105-1120.
26 Yamaguchi T,Yamamoto Y,Yokota S et al.Involvement of interleukin-6 in the elevation of plasma fibrinogen levels in lung cancer patients[J].Jpn J Clin Oncol,1998,28(12):740-744.
27 Zhao J,Zhao M,Jin B,et al.Tumor response and survival in patients with advanced non-small-cell lung cancer:the predictive value of chemotherapy-induced changes in fibrinogen[J].BMC,2012,12:330.
28 Francis CW,Marder VJ.Williams Hematology[M].New York: McGraw-Hill,1995:1252-1260.
29 Blackwell K,Haroon Z,Broadwater G,et al.Plasma D-dimer levels in operable breast cancer patients correlate with clinical stage and axillary lymph node status[J].J Clin Oncol,2000,18(3):600-608.
30 Antoniou D,Pavlakou G,Stathpoulos G,et al.Predictive value of D-dimer plasma levels in response and progressive disease in patients with lung cancer[J].Lung Cancer,2006,53(2):205-210.
31 Altiay G,Ciftci A,Demir M,et al.High plasma D-dimer level is associated with decreased survival in patients with lung cancer[J].Clin Oncol,2007,19(7):494-498.
Prognostic significance of preoperative coagulation assays in patients with non-small cell lung cancerafter complete resection
Suo Haijin,Zhang Hua,Zhu Jianquan,Liu Jun,Wang Changli.Department of Lung Cancer,Cancer Institute and Hospital of Tianjin Medical University,Tianjin 300060,China.
Wang Changli,Email:wangchangli@medmail.com.cn
Objective To evaluate the correlation between preoperative coagulation assays’levels and overall survival(OS)in patients with non-small cell lung cancer(NSCLC)after complete resection.MethodsA retrospective study of 754 patients with NSCLC undergoing complete resection was conducted at the Tianjin Medical University Cancer Institute and Hospital from January 2004 to December 2008.The correlation of preoperative coagulation assays’levels with other variables was evaluated by Kruskall-Wallis and Mann-Whitney U test.Univariate and multivariate analysis was employed to determine the association between the preoperative level of coagulation factors and OS.Results All preoperative coagulation tests’levels prothrombin time(PT);international normalized ratio(INR);activated partial thromboplastin time(APTT); thrombin time(TT);fibrinogen(Fbg);D-dimer)were associated with T stage and clinical stage.Univariate analysis of survival showed that preoperative prolonged prothrombin time(PT)(χ2=8.254,P=0.004)and International Normalized Ratio(INR)(χ2=5.404,P=0.020),and abnormally elevated fibrinogen(Fbg)(χ2=9.184,P=0.002)and D-dimer(χ2=9.184,P=0.002)were associated with a poor prognosis.And the multivariate model confirmed preoperative D-dimer was an independent prognostic factor for the patients with NSCLC(OR=1.274,95%CI:1.040-1.559,P=0.019).Conclusions Preoperative prolongation of PT and INR,and elevation of Fbg and D-dimer are associated with decreased survival in NSCLC patients,and preoperative plasma D-dimer level is an independent prognostic factor of survival in patients with NSCLC after complete resection.
Cancer,non-small cell lung; Prognosis; D-dimer
2015-01-12)
(本文编辑:周珠凤)
10.3877/cma.j.issn.2095-8773.2015.01.008
300060 天津医科大学肿瘤医院肺部肿瘤科
王长利,Email:wangchangli@medmail.com.cn
索海进,张华,朱建权,等.术前凝血检测对于评估根治性非小细胞肺癌患者预后的意义[J/CD].中华胸部外科电子杂志,2015,1(1):40-47.

