不同种植密度条件下单混种作物的生长曲线
关佳威,姬明飞,王志强,樊哲翾,冉金枝,邓建明
(草地农业生态系统国家重点实验室 兰州大学生命科学学院,甘肃 兰州730000)
20 世纪90 年代,West、Brown 和Enquist 等[1-4]利用分形填充网络模型从生物能量学的角度建立了生物体新陈代谢的模型,指出了个体大小与代谢速率之间存在着幂指数为3/4 的异速关系。West 等根据3/4 代谢理论建立了个体生长的模型,并得到了大量动物实验数据的验证[5],其公式如下所示:
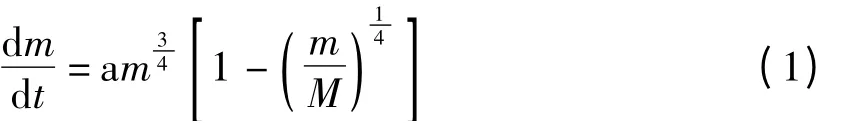
模型中,m 表示个体大小,t 为个体生长时间,M 代表了生物生长过程中可达到最大的个体大小,a 为归一化常数,值趋于不变。
Reich 等[6-7]通过测定43 种树木500 多个幼苗的个体整株呼吸速率发现,植株的呼吸速率与个体生物量的一次幂成正比,且此异速关系受氮元素含量的调控。针对Reich 等的研究,Enquist 等[8-9]认为前者实验中树木个体较小,个体内还没有形成充满个体体积的分形网络结构,因此代谢速率与个体大小的异速指数接近于1,随着个体成熟其体内分型网络结构日趋完善,异速指数则逐渐接近于3/4。个体发育过程中,异速指数是在1 ~3/4 之间变化。Mori 等[10]用大量的实验数据再次证明了灌木及乔木等大个体植物其代谢速率与生物量异速指数仍为3/4,而小个体植物以及幼苗时期的个体其异速指数却为1。
Deng 等[11]基于小个体植株资源利用速率与个体大小间异速指数为1 这一事实,提出了以逻辑斯谛方程为基础的生长模型,量化了资源在生物体内分配的问题,其公式如下

式中,m 表示在t 时的生物量,d m/d t 表示生长速率,g 为内禀增长率,Mmat为个体成熟后的最大生物量。此方程给出了经典的S 型曲线,表明在个体初期生长不断加快,但随着资源的不断分配以维持个体的各项生理功能,生长不断变慢直到成熟时完全停止,此时植物个体所获得的资源完全用于维持生物体的各项功能[12]。
上述动态生长模型(2)已经在不同环境条件下的植物种群中得到了很好的验证[11],但是由于植物群落植物物种组成比较复杂,有的物种生态位相近或相似,而有的物种间生态位分化很明显。因此,在群落水平上,对于拥有相近生态位的物种以及具有明显不同生态位物种的植物个体动态生长是否也遵循上述生长模型正是本研究拟探索的关键科学问题。
1 材料与方法
本试验于2011 年在榆中试验站开展,所选玉米(Zea mays)、春小麦(Triticum aestivum)、胡麻(Linum usitatissimum)3 种作物是当地常见的粮食及经济作物,3 种作物分别以低、中、高3 种密度进行单独栽培以及两两混合种植,样方面积2.25 m2,各物种每样方单独播种的低、中、高密度梯度分别为:春小麦,100、2 000 和10 000 粒种子;胡麻,100、2 000和10 000 粒种子;玉米,4、100 和2 000 粒种子。混合栽培有3 种组合方式,分别是:春小麦×胡麻;胡麻×玉米;玉米×春小麦。混合种植的密度由下列公式给出。
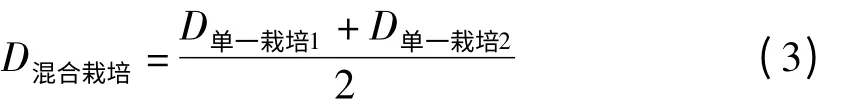
式中,D 为样方中作物种植个体数。样方的周边均预留0.3 m 宽的缓冲样带,以避免植物生长的边际效应。在每个样方之间亦留出一定的间隔距离,纵向间隔20 cm,横向间隔20 cm,以保证样方之间的作物相互之间不产生干扰。待所播种作物出苗后对所有样方中的作物进行定期浇水、施肥、除草、打药,以确保植物生长除了自身个体间竞争之外,不受水分、营养等其他环境因素的胁迫或干扰。
本试验对作物进行抽样跟踪测量,记录作物从幼苗期到成熟期植物个体大小变化。所有测量工作始于播种后一个月,此时各样方中每日新增加的个体数目渐趋近于零,样方中的出苗数目趋于稳定。对于每个样方,首先测量出每一样方内的个体数(密度)和冠层盖度,然后随机抽取每个样方内部分个体,测定其生长状态下的株高、基径、冠幅等形态学生理指标,将高密度样方内部分个体的地上部分剪下取样后带回实验室处理。所有取样都要避开外围0.3 m×0.3 m 的缓冲带,以避免边缘效应。所有样品需先置于烘箱内在115 ℃条件下杀青2 h,然后调至65 ℃恒温烘干72 h 至恒重,最后将植株个体分成茎、叶两部分,分别测定其生物量干重。每次测量工作间隔10 d,春小麦单混种样方共跟踪测量6次,玉米和胡麻单混种样方共跟踪测量7 次。
所有数据都经过方差分析,以证明在不同处理间的数据有显著性差异,同时对生物量等数据取对数,使用SMA 方法进行回归分析,用生长曲线模型(2)进行拟合并确定g、Mmat、达到最大生长速率所需时间(c)等参数。所有计算均是通过SPSS、origin、SMATR[13]等软件完成。
2 结果与分析
在本研究中,所有数据都经过方差分析,表明在不同的种植方式之间其生长曲线存在明显的差异,所得的结果为:春小麦,F =6.488,P =0.002;玉米,F = 3. 739,P = 0. 025;胡 麻,F = 27.775,P =0.000 01。根据逻辑斯谛生长模型对所跟踪测量的生物量数据进行拟合,从胡麻单独种植以及分别与春小麦玉米混种情况下胡麻的生长状况比较(图1),可以看出,在不同种植密度条件下,胡麻与春小麦混种情形下个体生长状况明显优于另外两种种植方式,而胡麻与玉米混种样方中其个体长势最差。从生长模型对生长曲线拟合所得的各参数值(表1)可知,各生长曲线拟合的相关性都非常高,R2的值均在0.98 以上。另从结果可知,不同种植方式之间内禀生长率相差不大,而成熟后最大生物量则相差较大。这很可能是因为内禀生长率是物种内在的生物特性,而与环境因素间的相关性并不大,但成熟时的最大生物量却与环境紧密相关。总体上,胡麻单独种植的内禀生长率最大,相应的达到最大生长速率所需的时间(c)最小;胡麻和玉米混种情形下的内禀生长率最小,相应的c 值最大。不过,在高密度梯度下3 种种植方式样方内c 值相差不大。
从玉米单混种生长状况的差异(图2)以及玉米分别在不同种植密度条件下以及单、混种情形下的生长状况(表2)可以看出,玉米与春小麦混合样方中玉米的生长状况优于另外两个处理样方内玉米生长状况,玉米与春小麦混种的样方在高、中、低密度下曲线的内禀生长率皆为最大,且在高、中、低密度条件下,其生长曲线的内禀生长率在不同种植方式间变化幅度较小,在低密度和中密度梯度条件下,玉米与春小麦混种样方其个体生长达到最大速率所需时间(c 值)最短,胡麻和玉米混作样方c 值最大,高密度梯度下玉米与春小麦混种样方其c 值最大,玉米单独种植样方其生长曲线c 值最小。
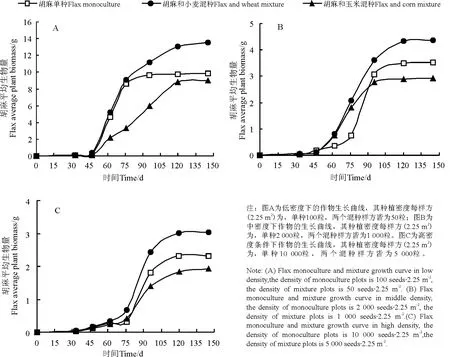
图1 不同种植密度下胡麻单混种生长曲线比较Fig.1 The comparison of flax growth curve between flax monoculture plots and mixture plots in three density gradients
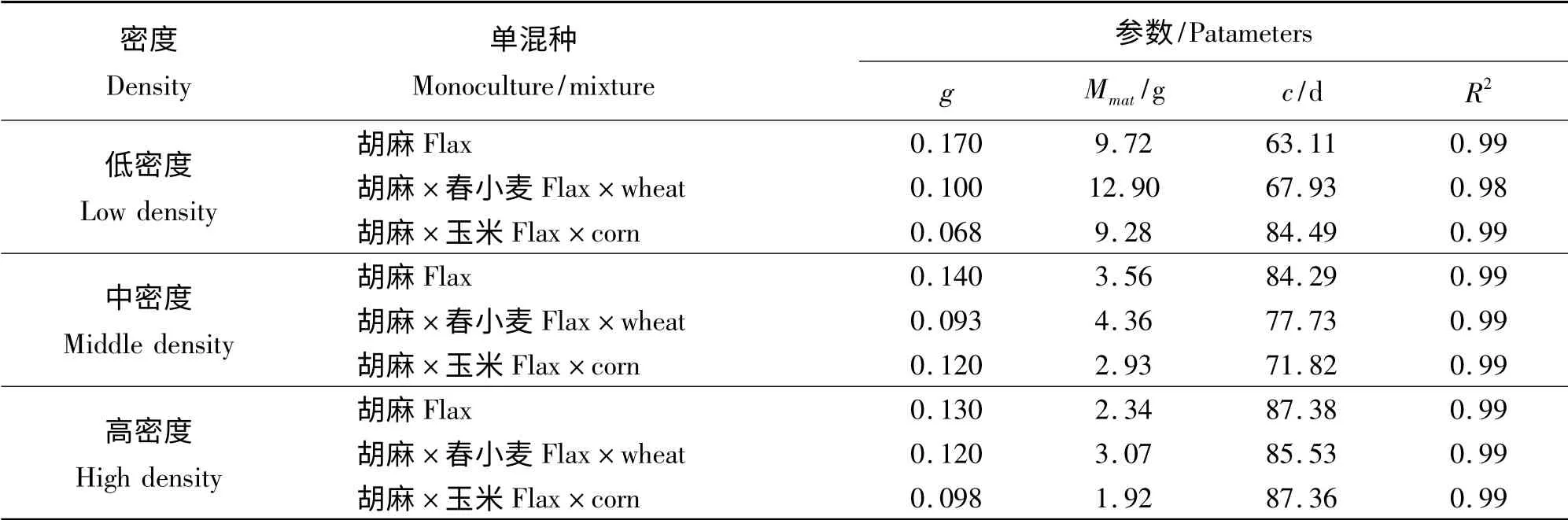
表1 不同种植密度下胡麻的生长曲线拟合参数值Table 1 Fitting parameters of flax growth curve in different density gradients and different planting ways
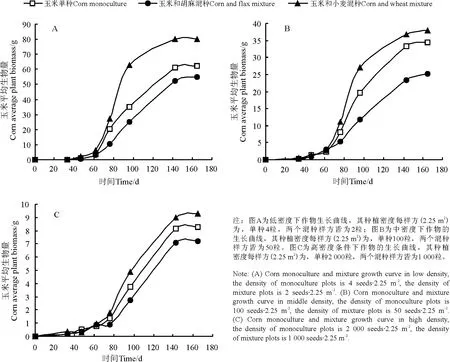
图2 不同种植密度下玉米单混种生长曲线比较Fig.2 The comparison of corn growth curve between flax monoculture plots and mixture plots in three density gradients
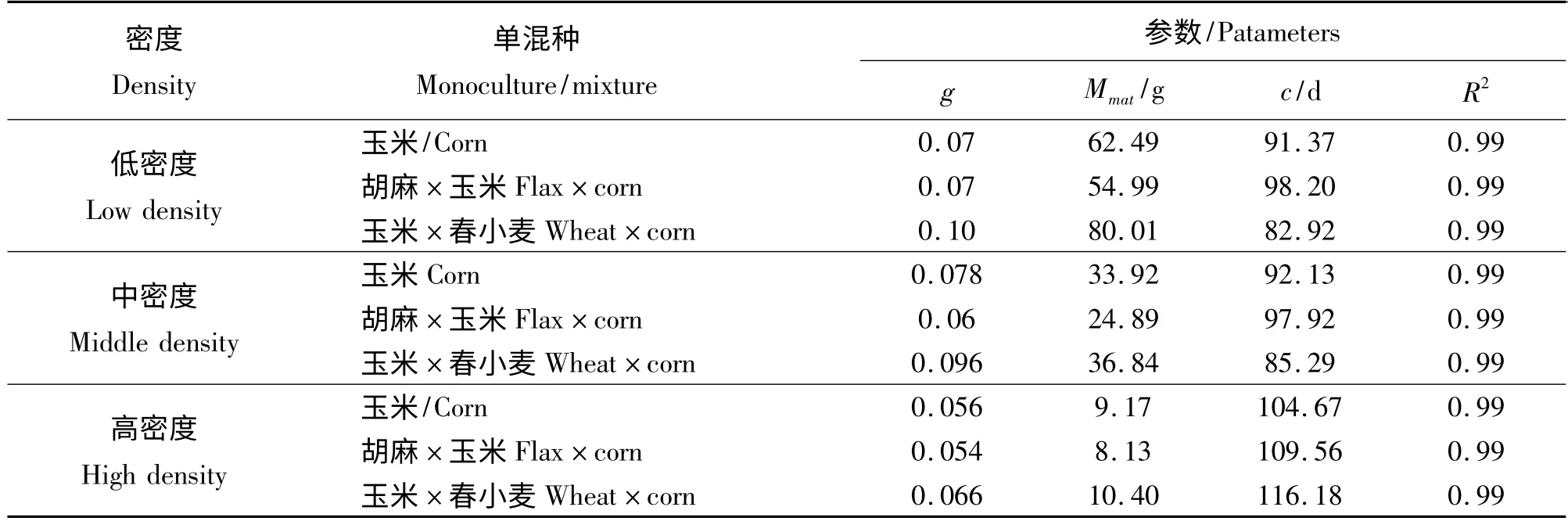
表2 不同种植密度下玉米的生长曲线拟合参数值Table 2 Fitting parameters of corn growth curve in different density gradients and different planting ways
从春小麦3种种植方式下各样方内个体生长状况的比较可知,其中胡麻和春小麦混种样方内春小麦个体生长状况最好,其次为春小麦单种样方,最后是玉米和春小麦混种样方。在低密度梯度下胡麻和春小麦混种与玉米和春小麦混种样方其g 值较大(表3),春小麦单种的样方g 值较小,对于中密度梯度,胡麻和春小麦混种样方g 值最大,而玉米和春小麦混种样方g 值最小,高密度梯度下春小麦单种样方其内禀生长率较大,而玉米和春小麦混种的样方g 值最小,中密度及低密度梯度下玉米和春小麦混种样方其c 值最小,胡麻和春小麦混种样方其c 值最大。高密度梯度下春小麦单独种植样方其c 值最小,而玉米和春小麦混种样方其c 值最大。
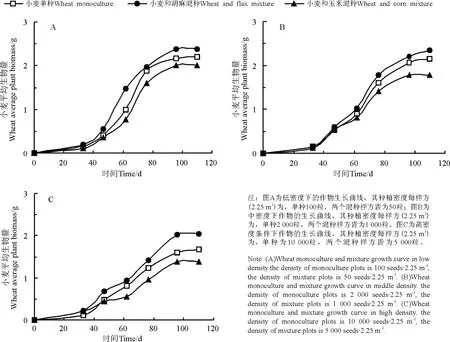
图3 不同种植密度的春小麦单混种生长曲线比较Fig.3 The comparison of wheat growth curve between flax monoculture plots and mixture plots in three density gradients
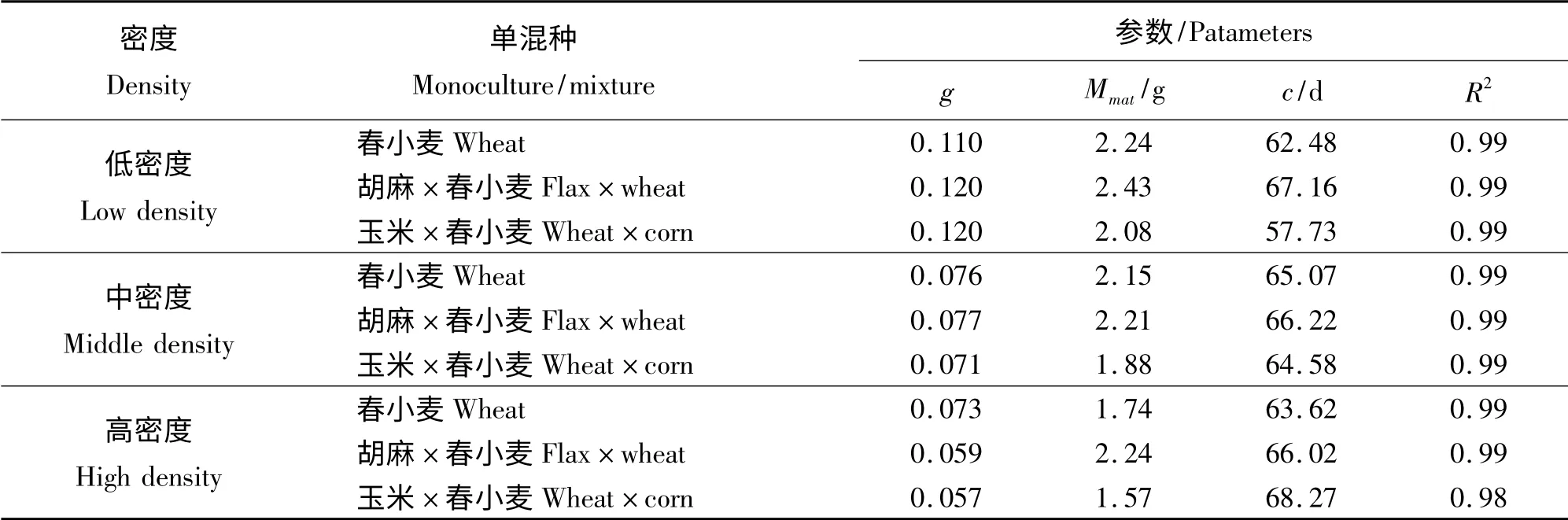
表3 不同种植密度下春小麦的生长曲线拟合参数值Table 3 Fitting parameters of wheat growth curve in different density gradients and different planting ways
同一种植方式下,3 种作物的个体生长曲线在不同种植密度梯度间的比较可知,单、混种样方中,不同作物生长状况虽各有差别,但总体上,各物种的各种植方式在低密度梯度下的个体长势均优于中密度及高密度梯度下的个体生长(图1、2、3)。春小麦与胡麻混种样方中的春小麦,在高、中、低3 个密度梯度下其个体成熟生物量相对而言差异相对较小;而包括玉米与胡麻单混种样方在内,高、中、低3 种密度梯度下个体生长状况差异较大(图1、2)。通过各曲线拟合参数可知,低密度条件下各样方内个体生长曲线内禀生长率高于中密度及高密度条件下其对应的样方个体生长曲线的内禀生长率,但玉米与胡麻相关样方中内禀生长率在不同密度梯度之间差异较小,而春小麦样方中的g 值却差异较大;低密度条件下种植作物达到最大生长速率所需时间(即c值)也普遍少于中密度及高密度条件下所对应的样方其作物达到最大生长速率所需的时间,但玉米与胡麻相关样方中其c 值差异较大,而春小麦各单混种样方在不同密度梯度下其生长曲线c 值差异较小。
3 讨论
利用逻辑斯谛方程对生物量进行拟合,从生长曲线的结果可得,混合种植的样方内植株个体比单独种植的样方个体生长状况有优势,进一步将结果作具体分析后可知与不同的物种混种其效果亦不尽相同。这主要是在混种情况下,种间竞争存在生态位分化进而导致竞争强度比在同等密度条件下的单种竞争强度低。无论在何种密度条件下,单种以及混种的样方内,胡麻与春小麦混种的样方其个体植株成熟时的生物量最大(图1),说明胡麻个体在与春小麦的混种中胡麻比春小麦具有竞争优势[14],但是在胡麻与玉米混种的样方中,由于玉米在样方中的竞争优势更为明显,胡麻在与其竞争中因被玉米遮阴而处于非常弱势的地位,不能得到充足的光资源,故而生长状况较差[15],甚至不如单种条件下胡麻的个体生长状况。在低密度条件下,胡麻和玉米混种样方中的胡麻达到生长速率最大时所用的时间(c 值)比另两个种植方式中的c 值大,而其内禀生长率亦低于胡麦混种的样方以及胡麻单种的样方,胡麻和春小麦混种的样方其内禀生长率最大而c 值最小。以上结果说明了在混种的样方中胡麻的个体生长状况受到混种物种竞争的影响,玉米个体较大,在样方中所要占用的生态位较大,故在种间竞争的过程中优势明显[16],对于胡麻植株个体的生长产生了较大抑制作用;但相对春小麦植物个体来说,胡麻却拥有较明显的竞争优势,同时对春小麦的生长产生了抑制作用。中密度以及高密度条件下亦是胡麦混种的样方中其个体生长状况最好,其个体成熟时的生物量(Mmat)最大,而胡麻和玉米混种的样方其个体成熟时的生物量最少,内禀生长率最小,与低密度条件下的胡麻和玉米混种的样方类似。值得注意的是,在中密度及高密度条件下3 种种植方式样方内其个体生长的c 值较为接近,这说明密度―竞争效应对植物的生长有相当的制约作用,然而对其成熟时间或完成生活史所需时间并没有显著影响[17]。
通过比较春小麦单混种各样方的个体生长曲线,发现春小麦与胡麻混种样方个体生长状况较另外两个处理样方来说较好,可能的原因为春小麦在生长过程中所占据的生态位虽与胡麻所占据的生态位有重叠,但二者生态位仍有一定的分化[18],从而使春小麦在与胡麻混种的过程中竞争作用的影响较小而使生物量增高[19]。但在春小麦与玉米混种的样方中,由于玉米所占的生态位较宽,较强烈的抑制了春小麦的生长,所以玉米和春小麦混种的样方中春小麦的个体生长状况较差。另通过分别比较各密度条件下不同处理的样方中春小麦生长曲线内禀生长率与达到最大生长速率所需的时间(c 值)发现,在不同处理的样方中单混种春小麦生长曲线的内禀生长率与c 值差异不明显,大概是由于春小麦竞争力较弱,而在对胡麻以及玉米的竞争中一直处于弱势地位,而使其生长速率普遍减小,故差异不明显。
玉米单混种的各样方中,不论在何种密度条件下,玉米与春小麦的混种的样方其个体生长状况好于胡玉混种以及玉米单独种植时的生长状况,其个体生长在成熟时的生物量总是最高,而与胡麻混种的样方个体成熟时的生物量最低,这主要是由于在通常情况下胡麻冠幅较大,而其在玉米幼苗时期就对玉米的植株产生较大影响,故造成现有的结果[20-21]。值得注意的是,玉米和春小麦混种的样方,在低密度及中密度条件下,其内禀生长率最大而达到最大生长速率所需的时间(c 值)最小,但是在高密度条件下,其内禀生长率依然最大,但c 值也最大,大概是由于在高密度条件下春小麦的种植密度较大,玉米个体的生长受到密度效应的制约,对其平均生长速率产生较大的影响的缘故。
比较不同密度的样方内其作物个体生长状况,可以发现低密度条件下作物个体生长状况好于中密度及高密度条件下相对应的样方内其作物的个体生长长势,而且生长曲线的各拟合参数均有较为显著的差异。但是相比较而言,种植有春小麦的各样方内其内禀生长率差异较大,但其余的两个参数包括个体成熟时的最大生物量以及c 值这两个参数在高、中、低3 个密度梯度之间的差异不明显,与其相反的是种有胡麻与玉米的各样方,包括胡麻与玉米的单种样方以及胡麦、胡玉、玉麦3 个混种样方中胡麻与玉米的个体生长曲钱,在统一种植方式下不同的密度梯度间比较达到最大生长速率所用的时间以及个体成熟时的最大生长速率这两个参数差异较大,而在内禀生长率方面的差异却较小。导致该结果的可能原因为,春小麦的个体竞争能力较弱,且密度制约效应的影响较大,进而导致其个体生长受到抑制,生长较为缓慢[22]。因此,虽然最大个体生物量以及平均生长速率变化不明显,而内禀生长率的波动较为明显[23],而种有玉米与胡麻的样方中这两种个体的竞争力较春小麦强,且个体的尺寸较大,故对于密度效应的制约,胡麻与玉米的个体生长曲线的变化多表现在最大个体生物量以及平均生长速率这两个指标上,但是对于内禀生长率的影响不大。
基于代谢异速理论[1]所提出的小个体动态生长模型[11]较为准确的模拟了小个体植物个体的生长规律,对于小个体植株具有较好的普适性,但是此模型并不适用于个体较大的植物或多年生植物。此模型对于农业生产也具有普遍的指导意义,但是在农业生产中,农作物特定部位的产量的大小往往比整体生物量更有意义,因此还需要结合特定农作物进行具体分析。
4 结论
本研究结果得出:1)不论何种密度梯度何种种植方式的样方内其个体生长均符合模型所给出形式;2)对于植物个体而言,对于具有相似或相近生态位的物种在混种条件下其个体生长状况总体上要好于相同密度梯度下各物种在单种条件下的个体生长状况,包括个体最大成熟生物量以及达到生长速率最大时所需的时间更短等;但对于生态位相差较大的物种混种在一起,其资源竞争处于劣势的物种,其个体生长明显受到竞争的负效应影响;3)低密度条件下的生长状况亦显著优于中、高密度样方个体生长状况。总之,在不同的竞争压力下,植物个体的生长规律仍符合生长模型的预测,模型的拟合度较高,这对于代谢理论的发展起到一定完善作用,同时也进一步验证了该理论的可靠性。
[1] West G B,Brown J H,Enquist B J.A general model for the origin of allometric scaling laws in biology[J].Science,1997,276:122-126.
[2] West G B,Brown J H,Enquist B J.The fourth dimension of life:Fractal geometry and allometric scaling of organisms[J].Science,1999,284:1677-1679.
[3] West G B,Brown J H,Enquist B J.A general model for the structure and allometry of plant vascular systems[J].Nature,1999,400:664-667.
[4] Enquist B J,West G B,Charnov E L,Brown J H. Allometric scaling of production and life-history variation in vascular plants[J].Nature,1999,401:907-911.
[5] West G B,Brown J H,Enquist B J.A general model for ontogenetic growth[J].Nature,2001,413(6856):628-631.
[6] Reich P B,Tjoelker M G,Machado J L,Oleksyn J.Universal scaling of respiratory metabolism,size and nitrogen in plants[J].Nature,2006,439:457-461.
[7] Glazier D S.A unifying explanation for diverse metabolic scaling in animals and plants[J].Biological Reviews of the Cambridge Philosophical Society,2010,85(1):111-138.
[8] Enquist B J,Allen A P,Brown J H,Gillooly J F,Kerkhoff A J,Niklas K J,Price C A,West G B.Biological scaling:Does the exception prove the rule?[J].Nature,2007,445:9-11.
[9] Enquist B J,Kerkhoff A J,Stark S C,Swenson N G,Mccarthy M C,Price C A. A general integrative model for scaling plant growth,carbon flux,and functional trait spectra[J].Nature,2007,449:218-222.
[10] Mori S,Yamaji K,Ishida A,Prokushkin S G,Masyagina O V,Hagihara A,Hoque A T,Suwa R,Osawa A,Nishizono T,Ueda T,Kinjo M,Miyagi T,Kajimoto T,Koike T,Matsuura Y,Toma T,Zyryanova O A,Abaimov A P,Awaya Y,Araki M G,Kawasaki T,Chiba Y,Umari M.Mixed-power scaling of whole-plant respiration from seedlings to giant trees[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(4):1447-1451.
[11] Deng J M,Ran J Z,Wang Z Q,Fan Z X,Wang G X,Ji M F,Liu J Q,Wang Y,Brown J H.Models and tests of optimal density and maximal yield for crop plants[J].Proceedings of the National Academy of Sciences,2012,109(39):15823-15828.
[12] Deng J M,Zuo W Y,Wang Z Q,Fan Z X,Ji M F,Wang G X,Ran J Z,Zhao C M,Liu J Q,Niklas K J.Insights into plant sizedensity relationships from models and agricultural crops[J].Proceedings of the National Academy of Sciences,2012,109(22):8600-8605.
[13] Warton D I,Wright I J,Falster D S,Westoby M. Bivariate line-fitting methods for allometry[J]. Biological Reviews,2006,81(2):259-291.
[14] Bai Y,Wu J,Pan Q,Huang J,Wang Q,Li F,Buyantuyev A,Han X.Positive linear relationship between productivity and diversity:Evidence from the Eurasian Steppe[J].Journal of Applied Ecology,2007,44(5):1023-1034.
[15] Pugnaire F I,Haase P,Puigdefabregas J. Facilitation between higher plant species in a semiarid environment[J]. Ecology,1996:1420-1426.
[16] Kefi S,Rietkerk M,Alados C L,Pueyo Y,Papanastasis V P,Elaich A,De Ruiter P C.Spatial vegetation patterns and imminent desertification in Mediterranean arid ecosystems[J].Nature,2007,449:213-217.
[17] Callaway R M,Walker L R.Competition and facilitation:a synthetic approach to interactions in plant communities[J].Ecology,1997,78(7):1958-1965.
[18] Levene H.Genetic equilibrium when more than one ecological niche is available[J].The American Naturalist,1953,87(836):331-333.
[19] Scanlon T M,Caylor K K,Levin S A,Rodriguez-Iturbe I.Positive feedbacks promote power-law clustering of Kalahari vegetation[J].Nature,2007,449:209-212.
[20] Hikosaka K.Leaf canopy as a dynamic system:Ecophysiology and optimality in leaf turnover[J]. Annals of Botany,2005,95(3):521-533.
[21] Thibault K M,Ernest S K M,Brown J H.Redundant or complementary?Impact of a colonizing species on community structure and function[J].Oikos,2010,119(11):1719-1726.
[22] Niklas K J,Midgley J J,Enquist B J.A general model for mass-growth-density relations across tree-dominated communities[J].Evolutionary Ecology Research,2003,5(3):459-468.
[23] Ackerman J L,Bellwood D R,Brown J H.The contribution of small individuals to density-body size relationships:examination of energetic equivalence in reef fishes[J].Oecologia,2004,139(4):568-571.

