精子冷冻技术及其对精子蛋白的影响
蒋旭平,王尚乾 综述;张 炜 审校
(1.南京医科大学第一附属医院泌尿外科,南京 210029;2.宜兴市人民医院泌尿外科,宜兴 214200)
·综 述·
精子冷冻技术及其对精子蛋白的影响
蒋旭平1,2,王尚乾1综述;张 炜1审校
(1.南京医科大学第一附属医院泌尿外科,南京 210029;2.宜兴市人民医院泌尿外科,宜兴 214200)
精子低温冷冻是保持精子无限期存活的一项技术,能够帮助保存男性生育力。然而,冷冻和复苏会对精子产生损伤并影响其功能。损伤的机制涉及物理和化学方面,比如冰晶形成、渗透压改变、DNA破坏和氧化应激等。在这些机制的研究中,很多都涉及精子蛋白的变化,本文就精子冷冻技术的发展及冷冻对精子蛋白的影响作一综述。
精子;冷冻;冷冻损伤;机制;蛋白
低温冷冻是指将生物组织或细胞等有机物质置于-196 ℃或以下的温度中,在此温度下,所有生命活动都会停止,包括一些导致细胞死亡的生物化学活动。人类精子冷冻已有70多年的历史,被广泛应用于人类辅助生殖技术,为一些因各种原因不能生育的患者提供了保存生育力的机会,如需要接受化疗和放疗的癌症患者、生殖器有缺陷的患者、少精弱精的患者等。但是冷冻复苏过程会对精子结构、功能造成不可逆转的损伤,世界各地的研究机构一直致力于精子损伤机制的研究并探索改进精子冷冻保存技术的方法。本文将介绍精子冷冻技术的发展并从蛋白质方面阐述冷冻损伤机制研究的最新进展。
1 精子冷冻技术
使细胞保持在“假死状态”的保存技术的出现对生殖医学是一个重大事件。在过去的70年,随着辅助生殖技术的发展,配子、睾丸组织、胚胎和卵巢组织的低温生物学也逐渐发展。精子低温冷藏的首次尝试见于1776年学者报道的精子可以冷藏于雪中[1]。BUNGE等[2]于1953年发现甘油可以保护精子对抗冷冻损伤使其可以冻存在-78 ℃的干冰中,并利用这些精子成功受孕3例,从此冷冻保护剂开始受到人们的关注。后来SHERMAN[3]发现,-196 ℃的液氮可以使精子保存更长久,并且保留了复苏后精子尾部的运动功能。在此基础上,各种冻存方法逐渐发展起来,常用的冷冻方法为快冷冻和慢冷冻。
1.1 快速冷冻法快速冷冻不需要借助昂贵的仪器,最常用的方法是在合适大小的冷冻容器中进行“垂直冷冻”。精子样品用保护剂稀释后在37 ℃放置10 min,用真空泵吸引至300 μL或500 μL的吸管进行悬浮。吸管密封后放置在氮气中8 min,然后浸入-196 ℃的液氮保存。液氮表面到底部存在热梯度,吸管置于液面以上15~20 cm,再缓慢降低到液面,产生大约20℃/min的冷冻速率。
另外一种快速冻存方法为玻璃化,将组织直接浸入液氮中,可达到10万℃/min的降温速度。标准的玻璃化使用高浓度的渗透性保护剂,会对精子产生致命损伤,所以只应用于卵子和胚胎。但是,ISACHENKO等[4]对上游法提取的精子进行玻璃化冻存而不使用保护剂,其效果优于传统的冻存法,并且避免了保护剂对精子产生毒性作用和渗透性休克。
1.2 慢速冷冻法慢冻存由BEHRMAN等[5]提出。它使用自动化设备以一定的速率将细胞从室温降低到保存温度。样品用保护剂稀释后以0.5~1 ℃/min的速率从室温降低到5 ℃,然后以1~10 ℃/min降到-80 ℃,最后浸入液氮中[6],降温过快或过慢都容易导致结冰。
1.3 其他冷冻方法有研究发现,将精子注射入人透明带空腔进行冻存,相比于传统的方法,有更高的精子复苏率,而不影响精子的功能[7]。而全精液的冻存能更好地对抗冷冻损伤,可以提高复苏后精子的运动能力和DNA完整性[8-9],这可能是由于精液中含有大量的抗氧化剂,对精子起到保护作用。
1.4 精子复苏精子的复苏一般有以下几种方案:①吸管置于室温10 min再置于37 ℃ 10 min;②吸管置于室温下复温15 min;③吸管置于37 ℃恒温槽内复温10 min[1]。也有在①法的基础上添加含有10%人血清白蛋白的复苏培养液,相比其他方法可能有更好的临床应用价值[10]。
2 冻存保护剂
冻存保护剂内含有各种化合物,可以使细胞外环境在凝固点以下时仍保持液态,从而减少损伤。一般均含以下成分:甘油,防止热休克损伤;糖,供能并优化渗透压和氢离子浓度;卵黄,提高质膜流动性,提供结构和功能上的保护,并通过其脂蛋白成分保护精子完整性;抗生素,对抗可能出现的病原体。尽管各种保护剂的成分不同,但都高度溶于水,并且有剂量相关的毒性[11-12]。它们通过静电相互作用直接影响质膜,降低溶液的凝固点,调整细胞内外环境,减少冰晶形成。
2.1 渗透性保护剂包括甘油、DMSO(二甲基亚砜)和PROF(丙二醇)等。这些亲水物质分子量小于400,很容易跨过质膜,形成渗透压梯度使水分转运出细胞。甘油最早也最常用于精子的保存[13],它作用于质膜结构,影响脂质双分子层的渗透性和稳定性,还影响表面蛋白和细胞代谢。但单独应用甘油会影响质膜、细胞骨架和线粒体膜电位,并引起脂质过氧化[14]。其他物质如DMSO和PROH因对精子有损伤而应用的比较少。
2.2 非渗透性保护剂包括蔗糖、果糖、葡聚糖等。这些大分子物质分子量大于1 000,增加细胞外溶质浓度,产生渗透压使水分在结冰前转移到细胞外。
2.3 冻存添加剂在保护剂内加入某些添加剂会对精子产生更好的保护作用。槲皮素是一种主要的食物黄酮,能够增加精子的动力、活力和DNA完整性[15],神经节糖苷胶粒也具有相似的效果[16]。TEST-蛋黄缓冲液可以降低冻存产生的精子形态改变和染色体损伤,也可以作为一种良好的保护剂[17]。而对于无活力的精子,激肽释放酶和咖啡因具有很好的保护作用,因此很适合少精症的患者[18]。
3 冻融对精子蛋白的影响
冻存会对精子的质膜、顶体、DNA完整性及其动力、活力等产生影响[8, 19-22],这可能是由于冻存期间的冷休克、渗透压改变和细胞内冰晶形成所致[23-24]。蛋白质是细胞功能的最终执行者,对蛋白质的研究可以更好地揭示冷冻损伤的原理,并且为提高冻存后精子生育力寻找新的方法。冷冻复苏对精子蛋白的影响参见表1。
3.1 凋亡通路冻存的各个过程都会对精子产生损伤。有研究者对牛精子进行冻存,在冻存前的稀释阶段,就发现有线粒体膜电位降低,这可能是由于促凋亡因子Bax从线粒体的释放。线粒体膜电位的降低导致凋亡诱导因子AIF和细胞色素C的释放,继而导致caspase(半胱天冬酶)激活[25],这就是“似凋亡”假说,这在其他动物实验中也得到证实[26-28]。Caspase 3是凋亡通路中最重要的蛋白,是一种凋亡指示物,在冻融后的人类精子中Caspase3活性升高,伴随DNA碎片的增加和DNA氧化水平的升高[15]。但其他研究发现,冻存并未使人类精子Caspase3活性增高,而增加了Caspase1、8、9的活性[29-30],还有研究报道冻存会导致4种caspase酶的活性均增高[31]。这种差异可能是由于实验方法、条件、人群的不同,但都证实了凋亡通路在冻存过程中的激活。凋亡通路是破坏DNA完整性的一个可能原因[32],继而导致细胞损伤甚至死亡。
3.2 氧化应激氧化应激也是冷冻损伤的一个重要因素。在冻存和复苏过程中,精子线粒体会产生过量的ROS,对细胞成分产生损伤[33],包括质膜和线粒体等。质膜损伤的标志是不饱和脂肪酸的过氧化程度,由于SOD(超氧化物歧化酶)活性降低,氧自由基增多,脂质过氧化水平在冻存后增高[34]。谷胱甘肽和谷胱甘肽过氧化物酶能够消除氧自由基,其含量的高低可作为新鲜精子对抗冻融损伤能力的标志[35]。冻融会降低精子中谷胱甘肽的含量,而在冻存液中添加谷胱甘肽可以降低精子半胱氨酸自由残基含量(核蛋白间二硫键的标识物),保护核蛋白完整性[36],但只有在复苏过程中添加谷胱甘肽能起到保护精子的作用,在冻存过程中添加却不能,提示谷胱甘肽是在复苏阶段保护精子的生育力[37]。HSP90(热休克蛋白90)在精子冻存后表达量也会下降[38-39],它在应激抵抗、蛋白折叠、信号转导等方面发挥重要作用,可以保护细胞免受ROS的损伤[40],而且会激活NOS(一氧化氮合酶),增加精子的活力[41]。冻存前后的精液中均未能检测到HSP90,推测其下降的机制可能是由于蛋白降解[38],而不是向质膜外的流失。
3.3 获能样现象我们的研究发现一些与能量代谢、精子动力、活力等有关的蛋白在冻融后含量下降,如ACO2、TEKT1、CYB5R2等,同时很多蛋白如ENO1(α烯醇化酶)、PKM2(M2型丙酮酸激酶)等在冻融后含量增加,伴随增高的磷酸化水平,说明在冻融过程中某些蛋白会发生蛋白磷酸化,从而影响顶体完整性和获能反应[42],蛋白磷酸化在动物精子冻存的实验中也被证实[43-44]。磷酸化可能是由于质膜的改变,引起了蛋白构象的变化[45],或者是由于促进了钙离子内流[46]。含巯基蛋白在冻融后的公牛精子中发生定位的改变和表达量的增加[47],巯基表达的增加与精子获能密切相关,由此推测冻融可能使精子发生获能样现象,影响了精子质量,而不是真正的获能[48]。与获能有关的BSP(牛精浆蛋白)在公牛精子冻存后[49],以及位于精子顶体的酪氨酸相关蛋白TyrP32在猪精子的复苏阶段[50],出现表达量的增加,都为获能样现象提供了证据。
3.4 对质膜的影响质膜损伤不仅表现为脂质过氧化,还表现为质膜结构和流动性的改变。质膜结构和流动性改变会对膜上很多蛋白产生影响[51],包括一些胞膜窖连接蛋白,如葡萄糖转运蛋白。葡萄糖转运蛋白是细胞膜上的跨膜糖蛋白,介导细胞内外的葡萄糖转运,维持细胞能量。冻存会改变猪精子内葡萄糖转运蛋白-3的定位并降低其含量,导致精子质量的下降[52]。
P34H和P25b是人和牛的同源蛋白,表达于质膜表面,可以作为精子生育力的指标,冻融导致了人精子P34H的下降[53]和牛精子P25b的下降[54],降低精子的质量。另一种精子生育力的标志是发生顶体反应的能力,冻存会使精子表面的孕激素受体构型发生改变和密度降低[55],并且降低精子顶体酶的活性[56-57],减少孕激素刺激下的顶体反应,导致其生育力降低。
另外,在质膜损伤的早期阶段,PS(磷脂酰丝氨酸)会从膜内转移到膜外,这个外显化现象可用Ca依赖性磷脂结合蛋白annexin V进行评价[58-59], 有学者利用annexin V联合PI(碘化丙啶)染色检测冻存过程中精子的PS外显化,发现这种方法可以很好的预测精子冻存结果[60]。
3.5 DNA和线粒体损伤在冻融后精子活力较低的不耐冻组中,半胱氨酸自由残基的含量高于耐冻组,而两组间的ROS水平没有明显差别,说明冻存通过ROS以外的机制破坏了精子核蛋白结构的完整性,影响精子活性[61]。同样的,FLORES等[62]发现冻存增高了猪精子中半胱氨酸自由残基的含量,同时组蛋白H1-DNA聚合体也增加,并且从精子头部的末端蔓延到了头端,证实了冻存对DNA核蛋白的影响。
Mfn2(线粒体融合蛋白-2)和肌动蛋白是线粒体功能的主要调节因素,在猪精子的冷冻过程中,Mfn2表达增加,并从精子中段的顶端扩增到整个中段,而肌动蛋白表达下降,位置也发生改变,这两个蛋白表达和定位的改变会引起线粒体体积的变化,影响线粒体功能[63]。肌动蛋白的改变还可能影响肌动蛋白-核周膜的相互作用,导致染色质核凝聚,最终影响精子的生育力[64]。
3.6 对其他蛋白的影响在细胞骨架方面,我们发现vimentin(中间丝蛋白)在冻融后会降低,它是细胞骨架成分之一,它的减少破坏了顶体的完整性[42]。而另外一种细胞骨架成分α微管蛋白会随着冻存时间的延长而增加,其增加的原因可能是冻融过程中一些含微管蛋白结构的破坏、抗微管蛋白识别位点的改变和钙离子内流后的解聚合作用[53]。
蛋白质组学分析在精子冻融的研究中得到了广泛的应用[65]。LI等对冻融前后的鲤鱼精子进行蛋白质组学比较分析,发现冻融对14个蛋白位点产生了明显影响,如α-SNAP(N-乙基马来酰亚胺敏感性融合蛋白附件蛋白α)、SAHH(S-腺苷高半胱氨酸水解酶)、转铁蛋白C和F等,这些蛋白与精子运动、能量代谢、信号转导和氧化应激等有关[66]。ZILLI等[67]对冻融前后的海鲈鱼精子进行分析,也得到了很多差异位点,冻融使一些蛋白降解,导致精子的活力和致孕率降低。
有学者利用二维电泳对冻融后的高复苏率和低复苏率的人类精子进行蛋白质组学比较分析,发现了与冷冻损伤有关的22个精子和精浆蛋白,其中与能量代谢有关的蛋白包括精子中的胆固醇26-羟化酶,精浆中的6-磷酸果糖-2-激酶等,与精子成熟相关的蛋白有精子细胞中的Ras相关蛋白和精浆中的Rho2样蛋白等,这些蛋白是如何影响精子对低温的耐受能力,尚需进一步研究[68]。VILAGRAN等[69]根据复苏后活力将冻融前的精子分组并进行蛋白质组学研究,发现与精子获能有关的ACRBP(顶体素结合蛋白)、与能量代谢有关的TPI(磷酸丙糖异构酶)在耐冻组和不耐冻组中表达差异最大,可以作为预测猪精子抗冻能力的标志。而HSP90AA1对猪精子也有同样的预测作用[70]。
4 小 结
精子冷冻是人类辅助生殖技术中很重要的一种方法,但是它对精子产生的损伤影响了其临床应用效果,为了推动精子冷冻技术的发展,阐明冷冻损伤的机制是个迫切的问题。在将来,我们需要进行更深入的研究,探索损伤的机制,改善冻存方法,研究新的保护剂,从而推动人类辅助生殖技术的发展。
表1 冷冻复苏对精子蛋白的影响

影响分类名称物种冻存后变化功能凋亡通路Bax人类、小牛升高促凋亡因子半胱天冬酶(Caspase)人类、猪、犬、马升高与细胞凋亡密切相关,并参与细胞生长、分化调节
续表1 冷冻复苏对精子蛋白的影响

分类名称物种冻存后变化功能氧化应激超氧化物歧化酶(SOD)人类降低消除新陈代谢过程中产生的有害物质谷胱甘肽(GSH)人类、猪降低清除自由基、抗氧化、抗衰老热休克蛋白90(HSP90)人类、猪降低对抗热应激,防止蛋白聚集,调节细胞死亡转铁蛋白C、F鲤鱼升高对抗氧化应激获能样现象α烯醇化酶(ENO1)人类升高参与糖酵解,与精子成熟和获能时的转录后修饰有关M2型丙酮酸激酶(PKM2)人类升高参与糖酵解、转录调控、蛋白修饰含巯基蛋白公牛表达升高,定位改变与精子获能有关牛精浆蛋白(BSP)公牛升高与精子获能、顶体反应有关酪氨酸相关蛋白TyrP32猪升高与精子获能、顶体反应有关对质膜影响葡萄糖转运蛋白(GLUT)猪表达降低,定位改变介导葡萄糖转运,维持细胞能量精子表面蛋白P34H人类降低精子生育力的标志物精子表面蛋白P25B牛降低精子生育力的标志物孕激素受体犬表达降低,构型改变作为精子生育力激活剂的受体磷脂酰丝氨酸(PS)人类、羊、猪向膜外转移质膜早期损伤的标志物DNA和线粒体损伤半胱氨酸自由残基猪升高核蛋白二硫键完整性的标志物组蛋白H1-DNA聚合体猪升高组蛋白-DNA结构的标志物线粒体融合蛋白-2(Mfn2)猪升高调控线粒体功能,与细胞凋亡有关肌动蛋白猪表达降低,定位改变调控线粒体功能,维持细胞结构,参与细胞运动结构蛋白波形蛋白(vimentin)人类降低构成细胞骨架α微管蛋白(α-tubulin)人类升高构成细胞骨架,参与细胞运动、胞内物质运输卷曲螺旋结构域蛋白113人类低冷冻复苏率组明显升高构成细胞骨架,与DNA稳定性有关锌指蛋白879人类低冷冻复苏率组明显降低构成细胞骨架,参与基因表达调控、细胞分化能量代谢顺乌头酸酶2(ACO2)人类降低参与三羧酸循环CYB5R2人类降低参与调解氧化还原反应胆固醇-26-羟化酶人类低冷冻复苏率组明显降低参与能量代谢过程溶质载体家族12(SLC12)、ATP结合盒亚家族D1人类精浆低冷冻复苏率组明显降低参与能量代谢过程6-磷酸果糖-2-激酶(PFK-2)人类精浆低冷冻复苏率组明显降低参与糖酵解S-腺苷高半胱氨酸水解酶(SAHH)鲤鱼降低参与细胞代谢过程
续表1 冷冻复苏对精子蛋白的影响
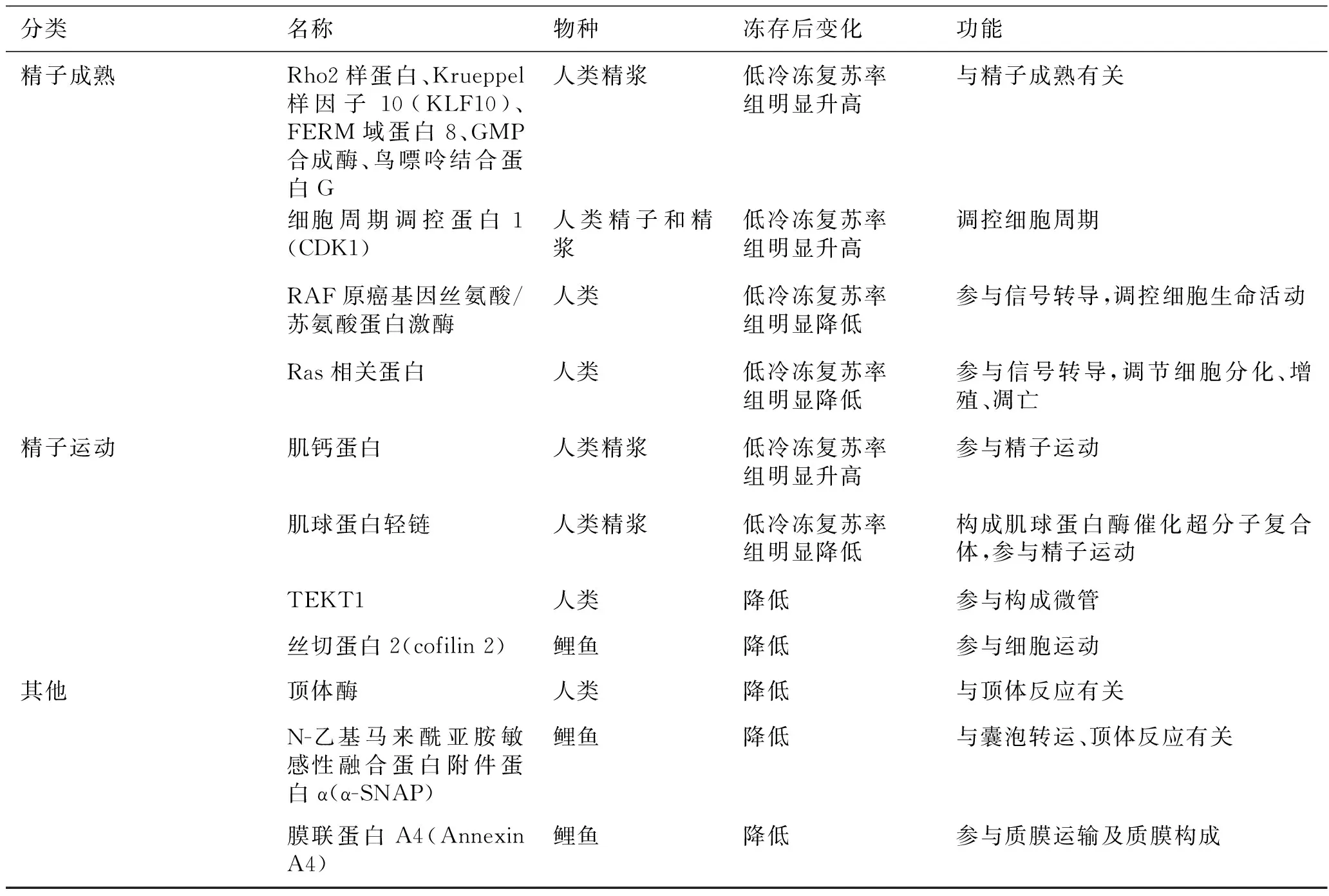
分类名称物种冻存后变化功能精子成熟Rho2样蛋白、Krueppel样因子10(KLF10)、FERM域蛋白8、GMP合成酶、鸟嘌呤结合蛋白G人类精浆低冷冻复苏率组明显升高与精子成熟有关细胞周期调控蛋白1(CDK1)人类精子和精浆低冷冻复苏率组明显升高调控细胞周期RAF原癌基因丝氨酸/苏氨酸蛋白激酶人类低冷冻复苏率组明显降低参与信号转导,调控细胞生命活动Ras相关蛋白人类低冷冻复苏率组明显降低参与信号转导,调节细胞分化、增殖、凋亡精子运动肌钙蛋白人类精浆低冷冻复苏率组明显升高参与精子运动肌球蛋白轻链人类精浆低冷冻复苏率组明显降低构成肌球蛋白酶催化超分子复合体,参与精子运动TEKT1人类降低参与构成微管丝切蛋白2(cofilin2)鲤鱼降低参与细胞运动其他顶体酶人类降低与顶体反应有关N-乙基马来酰亚胺敏感性融合蛋白附件蛋白α(α-SNAP)鲤鱼降低与囊泡转运、顶体反应有关膜联蛋白A4(AnnexinA4)鲤鱼降低参与质膜运输及质膜构成
[1] PAOLI D, LOMBARDO F, LENZI A, et al. Sperm cryopreservation: effects on chromatin structure[J]. Adv Exp Med Biol,2014,791:137-150.
[2] BUNGE RG, SHERMAN JK. Fertilizing capacity of frozen human spermatozoa[J]. Nature,1953,172(4382):767-768.
[3] SHERMAN JK. Improved methods of preservation of human spermatozoa by freezing and freeze-drying[J]. Fertil Steril,1963,14:49-64.
[4] NAWROTH F, ISACHENKO V, DESSOLE S, et al. Vitrification of human spermatozoa without cryoprotectants[J]. Cryo Letters,2002,23(2):93-102.
[5] BEHRMAN S J, SAWADA Y. Heterologous and homologous inseminations with human semen frozen and stored in a liquid-nitrogen refrigerator[J]. Fertil Steril,1966,17(4):457-466.
[6] MAHADEVAN M, TROUNSON AO. Effect of cooling, freezing and thawing rates and storage conditions on preservation of human spermatozoa[J]. Andrologia,1984,16(1):52-60.
[7] YE Y, XU C, QIAN Y, et al. Evaluation of human sperm function after being cryopreserved within the zona pellucida[J]. Fertil Steril,2009,92(3):1002-1008.
[8] DONNELLY ET, MCCLURE N, LEWIS SE. Cryopreservation of human semen and prepared sperm: effects on motility parameters and DNA integrity[J]. Fertil Steril,2001,76(5):892-900.
[9] SAID TM, TELLEZ S, EVENSON DP, et al. Assessment of sperm quality, DNA integrity and cryopreservation protocols in men diagnosed with testicular and systemic malignancies[J]. Andrologia,2009,41(6):377-382.
[10] MARTINEZ-SOTO JC, GARCIA-VAZQUEZ FA, GUMBAO D, et al. Assessment of two thawing processes of cryopreserved human sperm in pellets[J]. Cryobiology,2011,63(3):131-136.
[11] 马春杰,江芳,庄嘉明,等. 甘油-卵黄-柠檬酸钠型冷冻保护剂未经冷冻对人精子运动学参数的影响[J]. 中国男科学杂志,2010(11):37-39, 42.
[12] 朱伟杰,刘学高,李世勤,等. 四种人类精液冷冻保护剂的比较研究[J]. 中华泌尿外科杂志,1990,11(5):315-317.
[13] POLGE C, SMITH AU, PARKES AS. Revival of spermatozoa after vitrification and dehydration at low temperatures[J]. Nature,1949,164(4172):666.
[14] MACIAS GB, ORTEGA FC, APARICIO IM, et al. Toxicity of glycerol for the stallion spermatozoa: effects on membrane integrity and cytoskeleton, lipid peroxidation and mitochondrial membrane potential[J]. Theriogenology,2012,77(7):1280-1289.
[15] ZRIBI N, CHAKROUN NF, BEN AF, et al. Effect of freezing-thawing process and quercetin on human sperm survival and DNA integrity[J]. Cryobiology,2012,65(3):326-331.
[16] GAVELLA M, LIPOVAC V, GARAJ-VRHOVAC V, et al. Protective effect of gangliosides on DNA in human spermatozoa exposed to cryopreservation[J]. J Androl,2012,33(5):1016-1024.
[17] HAMMADEH M E, GREINER S, ROSENBAUM P, et al. Comparison between human sperm preservation medium and TEST-yolk buffer on protecting chromatin and morphology integrity of human spermatozoa in fertile and subfertile men after freeze-thawing procedure[J]. J Androl,2001,22(6):1012-1018.
[18] TASHIRO H, WATANABE K, TAKIZAWA H, et al. The effect of kallikrein and caffeine on the sperm survival of cryopreserved semen in patients with oligozoospermia[J]. Nihon Hinyokika Gakkai Zasshi,1992,83(2):190-196.
[19] DARVISHNIA H, LAKPOUR N, LAHIJANI MS, et al. Effects of very rapid versus vapor phase freezing on human sperm parameters[J]. Cell Tissue Bank,2013,14(4):679-685.
[20] DEJARKOM S, KUNATHIKOM S. Evaluation of cryo-injury of sperm chromatin according to computer controlled rate freezing method part 2[J]. J Med Assoc Thai,2007,90(5):852-856.
[21] NGAMWUTTIWONG T, KUNATHIKOM S. Evaluation of cryoinjury of sperm chromatin according to liquid nitrogen vapour method (I)[J]. J Med Assoc Thai,2007,90(2):224-228.
[22] 邓顺美,唐运革,唐立新,等. 冷冻对精子顶体酶活性及精子功能影响的研究[J]. 中国计划生育学杂志,2013,21(2):102-104.
[23] WATSON PF. The causes of reduced fertility with cryopreserved semen[J]. Anim Reprod Sci,2000,60-61:481-492.
[24] BROTHERTON J. Cryopreservation of human semen[J]. Arch Androl,1990,25(2):181-195.
[25] MARTIN G, CAGNON N, SABIDO O, et al. Kinetics of occurrence of some features of apoptosis during the cryopreservation process of bovine spermatozoa[J]. Hum Reprod,2007,22(2):380-388.
[26] SOKOLOWSKA A, GARCIA BM, FERNANDEZ LG, et al. Activated caspases are present in frozen-thawed canine sperm and may be related to post thaw sperm quality[J]. Zygote,2009,17(4):297-305.
[27] ORTEGA-FERRUSOLA C, SOTILLO-GALAN Y, VARELA-FERNANDEZ E, et al. Detection of "apoptosis-like" changes during the cryopreservation process in equine sperm[J]. J Androl,2008,29(2):213-221.
[28] 赵娜,甄林青,胡启蒙,等. 超低温冷冻过程引起猪精子产生“似凋亡"变化[J]. 畜牧兽医学报,2013,44(11):1766-1774.
[29] WUNDRICH K, PAASCH U, LEICHT M, et al. Activation of caspases in human spermatozoa during cryopreservation-an immunoblot study[J]. Cell Tissue Bank,2006,7(2):81-90.
[30] GRUNEWALD S, PAASCH U, WUENDRICH K, et al. Sperm caspases become more activated in infertility patients than in healthy donors during cryopreservation[J]. Arch Androl,2005,51(6):449-460.
[31] PAASCH U, GRUNEWALD S, AGARWAL A, et al. Activation pattern of caspases in human spermatozoa[J]. Fertil Steril,2004,81 Suppl 1:802-809.
[32] PAASCH U, SHARMA RK, GUPTA AK, et al. Cryopreservation and thawing is associated with varying extent of activation of apoptotic machinery in subsets of ejaculated human spermatozoa[J]. Biol Reprod,2004,71(6):1828-1837.
[33] WANG AW, ZHANG H, IKEMOTO I, et al. Reactive oxygen species generation by seminal cells during cryopreservation[J]. Urology,1997,49(6):921-925.
[34] 宋亚丽,邢福祺,陈思梅. 低温冷冻和孵育对人精子氧化应激水平的影响[J]. 中国计划生育学杂志,2007,15(5):296-298.
[35] MESEGUER M, GARRIDO N, SIMON C, et al. Concentration of glutathione and expression of glutathione peroxidases 1 and 4 in fresh sperm provide a forecast of the outcome of cryopreservation of human spermatozoa[J]. J Androl,2004,25(5):773-780.
[36] YESTE M, FLORES E, ESTRADA E, et al. Reduced glutathione and procaine hydrochloride protect the nucleoprotein structure of boar spermatozoa during freeze-thawing by stabilising disulfide bonds[J]. Reprod Fertil Dev,2013,25(7):1036-1050.
[37] GADEA J, SELLES E, MARCO MA, et al. Decrease in glutathione content in boar sperm after cryopreservation. Effect of the addition of reduced glutathione to the freezing and thawing extenders[J]. Theriogenology,2004,62(3-4):690-701.
[38] CAO WL, WANG YX, XIANG ZQ, et al. Cryopreservation-induced decrease in heat-shock protein 90 in human spermatozoa and its mechanism[J]. Asian J Androl,2003,5(1):43-46.
[39] HUANG SY, KUO YH, LEE WC, et al. Substantial decrease of heat-shock protein 90 precedes the decline of sperm motility during cooling of boar spermatozoa[J]. Theriogenology,1999,51(5):1007-1016.
[40] FUKUDA A, OSAWA T, ODA H, et al. Oxidative stress response in iron-induced acute nephrotoxicity: enhanced expression of heat shock protein 90[J]. Biochem Biophys Res Commun,1996,219(1):76-81.
[41] GARCIA-CARDENA G, FAN R, SHAH V, et al. Dynamic activation of endothelial nitric oxide synthase by HSP90[J]. Nature,1998,392(6678):821-824.
[42] WANG S, WANG W, XU Y, et al. Proteomic characteristics of human sperm cryopreservation[J]. Proteomics,2014,14(2-3):298-310.
[43] KUMARESAN A, SIQUEIRA AP, HOSSAIN MS, et al. Cryopreservation-induced alterations in protein tyrosine phosphorylation of spermatozoa from different portions of the boar ejaculate[J]. Cryobiology,2011,63(3):137-144.
[44] HARAYAMA H, NISHIJIMA K, MURASE T, et al. Relationship of protein tyrosine phosphorylation state with tolerance to frozen storage and the potential to undergo cyclic AMP-dependent hyperactivation in the spermatozoa of Japanese Black bulls[J]. Mol Reprod Dev,2010,77(10):910-921.
[45] PEREZ-PE R, GRASA P, FERNANDEZ-JUAN M, et al. Seminal plasma proteins reduce protein tyrosine phosphorylation in the plasma membrane of cold-shocked ram spermatozoa[J]. Mol Reprod Dev,2002,61(2):226-233.
[46] MCLAUGHLIN EA, FORD WC. Effects of cryopreservation on the intracellular calcium concentration of human spermatozoa and its response to progesterone[J]. Mol Reprod Dev,1994,37(2):241-246.
[47] CHATTERJEE S, DE LAMIRANDE E, GAGNON C. Cryopreservation alters membrane sulfhydryl status of bull spermatozoa: protection by oxidized glutathione[J]. Mol Reprod Dev,2001,60(4):498-506.
[48] THOMAS AD, MEYERS SA, BALL BA. Capacitation-like changes in equine spermatozoa following cryopreservation[J]. Theriogenology,2006,65(8):1531-1550.
[49] ARDON F, SUAREZ SS. Cryopreservation increases coating of bull sperm by seminal plasma binder of sperm proteins BSP1, BSP3, and BSP5[J]. Reproduction,2013,146(2):111-117.
[50] TABUCHI T, SHIDARA O, HARAYAMA H. A 32-kDa tyrosine-phosphorylated protein shows a protease-dependent increase in dead boar spermatozoa[J]. J Reprod Dev,2008,54(6):502-507.
[51] ZILLI L, SCHIAVONE R, ZONNO V, et al. Effect of cryopreservation on sea bass sperm proteins[J]. Biol Reprod,2005,72(5):1262-1267.
[52] SANCHO S, CASAS I, EKWALL H, et al. Effects of cryopreservation on semen quality and the expression of sperm membrane hexose transporters in the spermatozoa of Iberian pigs[J]. Reproduction,2007,134(1):111-121.
[53] DESROSIERS P, LEGARE C, LECLERC P, et al. Membranous and structural damage that occur during cryopreservation of human sperm may be time-related events[J]. Fertil Steril,2006,85(6):1744-1752.
[54] LESSARD C, PARENT S, LECLERC P, et al. Cryopreservation alters the levels of the bull sperm surface protein P25b[J]. J Androl,2000,21(5):700-707.
[55] CHENG FP, WU JT, TSAI PS, et al. Effects of cryo-injury on progesterone receptor(s) of canine spermatozoa and its response to progesterone[J]. Theriogenology,2005,64(4):844-854.
[56] 张红国,刘睿智,许宗革,等. 优选和冻融对精子顶体反应及顶体反应释放的顶体酶活性影响[J]. 中国妇幼保健,2006,21(7):970-973.
[57] 刘睿智,郭航,孙妍,等. 冷冻保存对人精子顶体酶活性影响[J]. 中国实验诊断学,2004,8(6):647-648.
[58] MULLER K, POMORSKI T, MULLER P, et al. Stability of transbilayer phospholipid asymmetry in viable ram sperm cells after cryotreatment[J]. J Cell Sci,1999,112 (Pt 1):11-20.
[59] GLANDER HJ, SCHALLER J. Binding of annexin V to plasma membranes of human spermatozoa: a rapid assay for detection of membrane changes after cryostorage[J]. Mol Hum Reprod,1999,5(2):109-115.
[60] SION B, JANNY L, BOUCHER D, et al. Annexin V binding to plasma membrane predicts the quality of human cryopreserved spermatozoa[J]. Int J Androl,2004,27(2):108-114.
[61] YESTE M, ESTRADA E, CASAS I, et al. Good and bad freezability boar ejaculates differ in the integrity of nucleoprotein structure after freeze-thawing but not in ROS levels[J]. Theriogenology,2013,79(6):929-939.
[62] FLORES E, RAMIO-LLUCH L, BUCCI D, et al. Freezing-thawing induces alterations in histone H1-DNA binding and the breaking of protein-DNA disulfide bonds in boar sperm[J]. Theriogenology,2011,76(8):1450-1464.
[63] FLORES E, FERNANDEZ-NOVELL J M, PENA A, et al. Cryopreservation-induced alterations in boar spermatozoa mitochondrial function are related to changes in the expression and location of midpiece mitofusin-2 and actin network[J]. Theriogenology,2010,74(3):354-363.
[64] GUTIERREZ-PEREZ O, JUAREZ-MOSQUEDA ML, MOTA D, et al. The disruption in actin-perinuclear theca interactions are related with changes induced by cryopreservation observed on sperm chromatin nuclear decondensation of boar semen[J]. Cryobiology,2011,62(1):32-39.
[65] 陈龙,朱化彬,沙里金,等. 牛精子蛋白质组学技术平台的建立及冻融前后精子差异蛋白初步分析[J]. 中国生物工程杂志,2008,28(7):37-42.
[66] LI P, HULAK M, KOUBEK P, et al. Ice-age endurance: the effects of cryopreservation on proteins of sperm of common carp, Cyprinus carpio L[J]. Theriogenology,2010,74(3):413-423.
[67] ZILLI L, SCHIAVONE R, ZONNO V, et al. Effect of cryopreservation on sea bass sperm proteins[J]. Biol Reprod,2005,72(5):1262-1267.
[68] 张欣宗,熊承良. 影响人类精子耐冻性的蛋白质分析[J]. 中华男科学杂志,2013,19(3):214-217.
[69] VILAGRAN I, CASTILLO J, BONET S, et al. Acrosin-binding protein (ACRBP) and triosephosphate isomerase (TPI) are good markers to predict boar sperm freezing capacity[J]. Theriogenology,2013,80(5):443-450.
[70] CASAS I, SANCHO S, BALLESTER J, et al. The HSP90AA1 sperm content and the prediction of the boar ejaculate freezability[J]. Theriogenology,2010,74(6):940-950.
(编辑 王 玮)
2014-12-05
2015-01-29
张炜,教授,主任医师,博士生导师.E-mail: zhangwei@medmail.com.cn
蒋旭平(1990-),男(汉族),硕士研究生在读.研究方向:男科学与泌尿系统先天畸形.E-mail: medical_jxp@163.com
R321.1
A
10.3969/j.issn.1009-8291.2015-04-021

