诱导/封闭自噬相关基因7对肾癌786-0细胞自噬的调控作用研究
王振龙,邓 骞,王子明
(西安交通大学医学院第二附属医院泌尿外科,陕西西安 710004)
·基础研究·
诱导/封闭自噬相关基因7对肾癌786-0细胞自噬的调控作用研究
王振龙,邓 骞,王子明
(西安交通大学医学院第二附属医院泌尿外科,陕西西安 710004)
目的 探讨诱导/封闭Atg7对肾癌786-0细胞自噬的调控作用。方法 构建上调Atg7的慢病毒载体plenti6.3-Atg7,下调Atg7的慢病毒载体sh-Atg-1 lv、sh-Atg-2 lv,空载对照慢病毒载体sh-scramb-con lv、plenti6.3-GFP,分别转染肾癌786-0细胞系,未转染的786-0细胞系为空白对照。RT-PCR和Western blot检测各组Atg7的表达,研究plenti6.3-Atg7激活Atg7效率和sh-Atg-1 lv、sh-Atg-2 lv抑制Atg7效率。 Western blot检测上述各组细胞LCII/LC3I蛋白比值,研究上调及下调Atg7对肾癌786-0细胞自噬的激活及抑制作用。结果 经过筛选,成功构建稳定上调Atg7的786-0/plenti6.3-Atg7xbx细胞系、稳定下调Atg7的786-0/sh-Atg-2 lv细胞系、空载对照786-0/sh-scramb-con lv、786-0/plenti6.3-GFP细胞系。与空白对照组比较,Atg7上调组786-0细胞LCII/LC3I比值显著升高(3.31±0.12vs. 2.23±0.10P<0.01),具有稳定的自噬激活作用;Atg7下调组的786-0细胞LCII/LC3I比值显著降低(1.45±0.11vs. 2.23±0.10P<0.01),具有稳定自噬抑制作用。结论 上调Atg7对肾癌786-0细胞系具有自噬激活作用,下调Atg7对肾癌786-0细胞系具有自噬抑制作用。
自噬;肾透明细胞癌;自噬相关基因7;sh-Atg7;plenti6.3-Atg7.
肾癌(renal cell carcinoma,RCC)是泌尿系统常见肿瘤,其发病率约以每年2%的速度增长,特别是晚期肾癌病例明显增加[1]。肾癌中凋亡处于受损和低表达状态,抗凋亡机制是肾癌细胞增殖进展,并对诸多治疗不敏感的原因之一[2]。自噬作为不同于凋亡的细胞程序性死亡方式,在抑制肿瘤细胞增殖中发挥重要调节作用。我们前期研究发现肾癌多种细胞系及肾癌组织中自噬呈受抑制状态,肾癌组织中自噬水平与肿瘤分期、分级负相关。提示自噬在肾癌中起诱导细胞死亡的作用[3]。通过调控自噬能否影响肾癌细胞增殖以及肾癌自噬的调控方法,目前文献报道不多。本研究通过调控自噬相关基因(autophagy-related genes7, Atg7),探讨以Atg7作为靶点调控肾癌786-0细胞自噬的作用及由此建立自噬激活/抑制肾癌786-0细胞系模型的可行性,为后续进行肾癌自噬作用及机制研究奠定基础。
1 资料与方法
1.1 实验材料本实验选用研究人员普遍采用的肾癌786-0细胞系作为研究对象,细胞系购于中国科学院典型培养物保藏委员会细胞库。兔抗人ATG7多克隆抗体,兔抗人Beclin1多克隆抗体购于英国abcam生物公司,兔抗人LC3多克隆抗体购于美国Sigma生物公司,小鼠抗人β-actin单克隆抗体,HRP标记山羊抗兔IgG、HRP标记山羊抗小鼠IgG购于北京TransGen生物公司,Western-blot Lumious发光试剂购于美国Millipore公司,N-N’亚甲双丙烯酰胺购于北京索莱宝生物公司,蛋白Maker购于北京TransGen生物公司。
1.2 实验方法
1.2.1 Atg7高表达慢病毒的构建 ①Atg7全基因合成。根据Genebank提供的人Atg7基因全长序列分析检查基因内部是否含有复杂二级结构和重复序列。根据序列分析结果,进行单链oligo合成。利用PCR对合成的oligo进行拼接反应。将拼接的PCR产物TA克隆到T载体中,将载体转入宿主菌中。测序验证,如有突变,进行突变修复后,再次验证直到序列正确无误。②设计和构建Atg7高表达慢病毒。将目的基因构建入plenti6.3-MCS-IRES-GFP载体上,测序验证。将包装细胞培养至对数期。进行Atg7高表达慢病毒包装,获得病毒粗液。微孔过滤清除杂质,高速离心浓缩病毒,并测定滴度。将未重组的空载体慢病毒包装。以上过程均由上海诺百生物有限公司完成。
1.2.2 Atg7低表达慢病毒及空载体慢病毒的建立 ①sh-Atg7的设计和合成 根据生物信息学的方法筛选得到2条干扰序列sh-Atg7-1及sh-Atg7-2,其作用于Atg7的位点见表1。根据设计结果合成shRNA。将片段插入构建重组质粒。②Atg7低表达慢病毒的构建将重组质粒酶切,将启动子连同插入片段一起转克隆至工作质粒。测序验证。Atg7低表达慢病毒及将未重组的空载体慢病毒包装。以上过程均由西安博达生物有限公司完成。
表1 RNA干扰序列的靶向作用位点
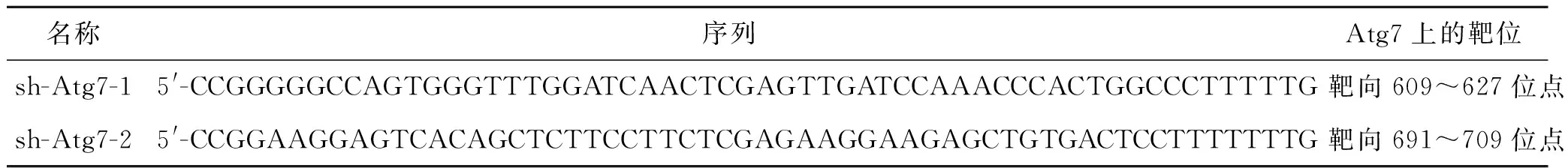
名称序列Atg7上的靶位sh-Atg7-15'-CCGGGGGCCAGTGGGTTTGGATCAACTCGAGTTGATCCAAACCCACTGGCCCTTTTTG靶向609~627位点sh-Atg7-25'-CCGGAAGGAGTCACAGCTCTTCCTTCTCGAGAAGGAAGAGCTGTGACTCCTTTTTTTG靶向691~709位点
1.2.3 Puromycin最低耐受实验 进行肾癌细胞786-0的Puromycin最低耐受实验,及ATG7慢病毒转染稳定抗性克隆的筛选。
1.2.4 RP-CR法检测ATG7基因的表达 将各种稳定转染细胞以5×105个/瓶的密度种植于25 cm2细胞培养瓶中,待细胞生长融合至90%左右时,弃去培养液,PBS反复冲洗后,使用Trizol提取各种细胞总mRNA。使用广谱分光光度计及琼脂糖凝胶电泳对RNA纯度进行鉴定。结果进一步证明我们提取的mRNA符合实验对RNA纯度的要求。
进行逆转录反应(cDNA合成),使用TransGen公司TranscriptTM逆转录试剂盒进行反转录,建立反转录反应体系,按照说明书步骤进行操作。引物设计及合成如下:Forward,LC3 5′-GAGCAGCATCCAACCAAA-3′;Revers,5′- CGTCTCCTGGAGGCATA-3′。进行聚合酶链反应,反应结束后,确认β-actin和各组目的基因的扩增曲线和融合曲线,检查扩增的特异性,并求出各个基因的标准曲线。用IQTM5多重实时定量PCR仪中自带的结果分析软件求得各样本的CT值,按照文献报道的方法,以2-△△CT法计算各实验组基因表达与对照组比较的比值。
1.2.5 Western blot法检测Atg7的表达 将各种生长状态良好的细胞以5×105个/瓶的密度种植于25 cm2细胞培养瓶中,待细胞生长融合至90%左右时,弃去培养液,PBS反复冲洗后,使用RIPA裂解液提取各种细胞总蛋白。BCA法测定蛋白浓度。将上述得到的蛋白提取液,加入适量上样缓冲液后,与沸水中煮8 min,使蛋白得以变性。-20℃冰箱内保存。进行聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,检测目的蛋白。一抗为:Atg7(1∶10 000)、β-actin(1∶10 000)。在凝胶成像系统中照相,以图片形式保存。蛋白免疫图像结果分析。使用Quanlity One图像分析系统对获得的图像进行灰度分析。将统一样品的目的蛋白灰度值和相应的内参灰度值相比,得到蛋白相对表达量,实验结果取3次试验的平均值。
1.2.6 Western blot法检测LC3基因的表达 方法同上,转膜时间为30 min,一抗浓度为1∶800。
1.3 统计学处理使用SPSS 17.0软件对相关实验数据进行统计学分析,组间比较使用ANOVA单因素方差分析,P<0.05表示为具有统计学差异。
2 结 果
2.1 Atg7慢病毒转染786-0细胞系结果构建上调Atg7的慢病毒载体plenti6.3-Atg7及空载对照plenti6.3-GFP,下调Atg7的慢病毒载体sh-Atg-1 lv、sh-Atg-2 lv及空载对照sh-scramb-con lv,分别转染786-0细胞系,未转染786-0细胞为空白对照组。(图1)所示,与空载对照组相比,在mRNA水平上,plenti6.3-Atg7和sh-Atg-2 lv显著上调和下调Atg7mRNA的表达(P<0.05),而sh-Atg7-1 lv的下调作用与空载对照组无差异。在蛋白水平上,plenti6.3-Atg7和sh-Atg-2 lv显著上调和下调Atg7蛋白的表达(P<0.05),而sh-Atg7-1 lv的下调作用与空载对照组无差异。证实我们成功构建了稳定上调Atg7的786-0/plenti6.3-Atg7细胞系和稳定下调Atg7的786-0/sh-Atg-2 lv细胞系。
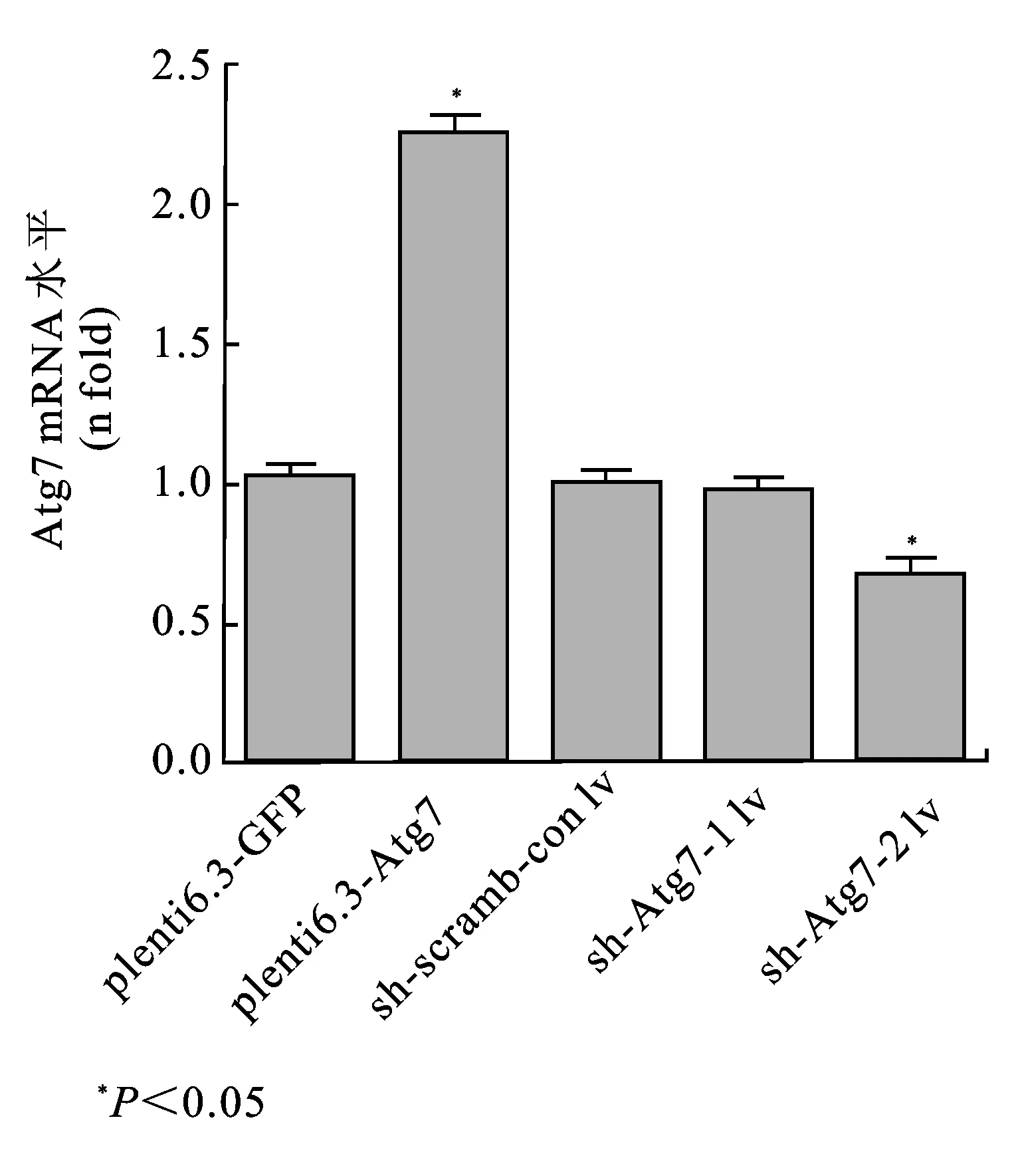
图1 慢病毒转染转染后Atg7的mRNA表达水平
与plenti6.3-GFP阴性对照相比,plenti6.3-Atg7转染细胞Atg7表达水平升高,差异具有显著性(P<0.05);与sh-scramb-con lv阴性对照相比,sh-Atg-2 lv转染细胞Atg7表达水平下降,差异具有显著性(P<0.05),而sh-Atg-1 lv转染细胞则无显著性差异(P>0.05)。
2.2 调控Atg7基因表达对786-0细胞自噬的影响调控Atg7基因表达对786-0细胞自噬的影响见图2。在蛋白水平上,与空白对照组相比,Atg7上调组786-0细胞LCII/LC3I比值显著升高(3.31±0.12vs.2.23±0.10,P<0.01),具有自噬激活作用;Atg7下调组的786-0细胞LCII/LC3I比值显著降低(1.45±0.11vs.2.23±0.10,P<0.01),具有自噬抑制作用。通过上调和下调Atg7成功构建了自噬激活及自噬抑制的786-0肾癌细胞系。
与786-0细胞和plenti6.3-GFP阴性对照相比,plenti6.3-Atg7转染细胞Atg7和LC3II蛋白表达水平升高,差异具有显著性(P<0.01);与786-0细胞和sh-scramb-con lv阴性对照相比,sh-Atg-2 lv转染细胞Atg7和LC3II蛋白表达水平升高,差异具有显著性(P<0.01)。
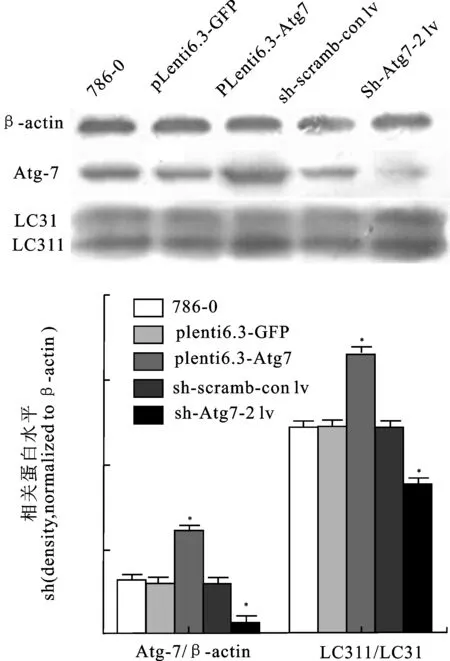
图2 慢病毒转染后Atg7和LC3蛋白表达水平
3 讨 论
细胞自噬是真核细胞在不利的外源刺激下通过双层膜包裹自身受损的细胞器和大分子物质形成自噬体,并降解其内容物, 实现细胞的代谢需要细胞器的更新。自噬一方面为细胞提供能量再循环,避免凋亡和坏死。另一方面过度自噬导致细胞必需成分过度清除,引起细胞发生不同于凋亡的另一种细胞程序性死亡——自噬性死亡[4]。自噬与多种疾病特别是肿瘤发生及发展密切相关[5]。通过调控细胞自噬,影响肿瘤增殖、侵袭目前已有部分研究。某些肿瘤中通过抑制自噬抑制肿瘤增殖,他莫昔芬可抑制乳腺癌MCF-7自噬,降低了细胞对不利外源刺激的保护作用,表现为凋亡增加,抑制肿瘤增殖进展,同时也具有放疗增敏作用[6]。某些肿瘤中促进自噬抑制肿瘤增殖。微管相关化疗药物(长春新碱、紫杉醇等)可诱导胃癌转移灶细胞自噬性死亡。多西紫杉醇可诱导细胞自噬进而促进凋亡,抑制宫颈癌HeLa细胞增殖侵袭。肾癌多种细胞系及肾癌组织中自噬呈受抑制状态,且自噬水平与肿瘤分期、分级负相关。提示自噬在肾癌中起诱导细胞死亡的作用[3]。自噬是否在肾癌发生发展中起着关键作用,自噬与凋亡的关系,自噬在诱导肾癌细胞死亡中是否占主导地位,调控肾癌细胞自噬对肾癌增殖能力的影响及机制,上述问题尚缺少相关研究文献,需要进一步研究。选择一种有效、特异的调控肾癌细胞自噬的靶点及方法是上述研究首要解决的问题,也是本研究的目的。
自噬调控靶点的选择关系到调控效果,目前没有“金方法”。调控自噬的方式有外源性调控和内源性调控两种。外源性自噬调控药物如自噬诱导剂如雷帕霉素(rapamycin),能够抑制mTOR,促进自噬。自噬抑制剂如氯喹和轻氯喹,能阻断自噬体和溶酶体融合过程,抑制自噬体成熟及降解。外源性的调控剂均非特异性地激活或抑制自噬,往往伴随细胞其他功能的改变,因此,不适合用于对肾癌自噬作用的研究。自噬的内源性调控以自噬信号通路的调节为主要方式,如:雷帕霉素的靶位TOR(target of rapamycin)、PI3K (phosphoinositide-3 kinase)、钙、激素、氨基酸。Beclin1、LC3(mierotubule-associated protein lightchain3)、Atg7等自噬体形成过程中的关键因子是目前自噬研究中常选择的调控靶点。调控它们的表达水平就可能实现对自噬活性的调控。但Beclin1在常态下与抗凋亡蛋白Bcl-2相结合[7],调控Beclin1的表达水平可能直接影响细胞的凋亡。TIAN等[8]发现有非Beclin1依赖性的自噬通路,并且与细胞死亡联系紧密,因此调控Beclin1不是最佳调控靶点。KUMA等[9]研究发现通过转染并过表达LC3,LC3有聚集的趋势,反而不参与自噬体的形成,也不符合研究要求。
Atg7在自噬小体膜的形成和延伸过程中参与了两种共扼结合系统。第一种共扼活动里,Atg7和Atg3作为E1和E2两种生物酶同系物分别参与泛素化的过程,首先Atg8/LC3被半胧氨酸蛋白酶Atg4分解,分解后得到激活了的LC3-I,随后LC3被Atg7所激活,进一步转运到Atg3。Atg3与Atg8/LC3一起共扼结合到磷脂酞乙醇胺上形成LC3-II,它是一种脂质结合体,与自噬小体膜的形成有关[10]。另一个自噬反应的共扼活动里,Atg7和Atg10分别作为El和EZ生物酶同系物[11],Atg7水解ATP并通激活Atg12,具有活性的Atg12通过Atg10转移到Atgs上,Atgs/ag12复合物通过非共价键结合Atg16寡聚体化后形成一个大分子复合物,这种复合体在Atgs/LC3参与的自噬小体膜形成和延伸过程中起重要作用。Atg7同时参与了Beclin1和LC3的活化,因此,Atg7可能是一种调控自噬的有效靶点。多项研究以Atg7作为自噬调控靶点,获得满意结果[13-14]。而调控Atg7对肾癌细胞自噬的作用,鲜有文献报道,因此调控Atg7对肾癌细胞自噬的作用我们进行了进一步研究。
我们前期选取了目前肾癌研究中最常使用的具有代表性的4种肾癌细胞株ACHN、OS-RC-2、769-P、786-0同正常肾小管上皮细胞HK-2比较上述肾癌细胞系自噬水平,研究发现786-0细胞系中自噬相关基因Atg7、Beclin1 mRNA 和蛋白表达水平相较其他肾癌细胞系表达最低,自噬抑制最明显,具有较好的典型性[3],因此,我们选择786-0细胞系作为我们研究的细胞系。
慢病毒载体plenti6.3-Atg7及sh-Atg-1 lv转染肾癌786-0细胞否具有上调/下调细胞Atg7表达的作用,本课题进行了以下研究。本研究构建了自噬相关基因的Atg7的慢病毒载体plenti6.3-GFP、plenti6.3-Atg7、sh-scramb-con lv、sh-Atg-1 lv、sh-Atg-2 lv及空载对照细胞plenti6.3-GFP、sh-scramb-con lv分别转染肾癌786-0细胞。慢病毒plenti6.3-Atg7转染786-0细胞与plenti6.3-GFP空载对照相比,plenti6.3-Atg7转染的细胞Atg7表达水平升高,差异具有显著性(P<0.05)。sh-Atg-1 lv、sh-Atg-2 lv分别转染786-0细胞与sh-scramb-con lv空载对照组相比,sh-Atg-2 lv转染细胞Atg7表达水平下降,差异具有显著性(P<0.05),而sh-Atg-1 lv转染细胞则无显著性差异(P>0.05)。说明慢病毒plenti6.3-Atg7转染786-0细胞后可以稳定上调细胞Atg7的表达,sh-Atg-2 lv转染786-0细胞可以稳定下调细胞Atg7的表达。慢病毒plenti6.3-Atg7和sh-Atg-2 lv转染效率和表达效率均较高,说明通过慢病毒转染及构建si-RNA基因敲除方式具有上调/下调肾癌786-0细胞系Atg7表达的作用。
调控Atg7对细胞自噬的作用目前已有部分研究,PATTISON等[12]将Atg7作为自噬调控点,通过上调和下调Atg7的方法到可以达到调节自噬活性的目的,MORTENSEN等[13]也获得了类似的效果。而调控Atg7对肾癌自噬的作用鲜有报道。我们研究发现,与786-0细胞空白对照组和plenti6.3-GFP空载对照相比,plenti6.3-Atg7转染细胞LCII/LC3I比值显著升高(P<0.01),sh-Atg-2 lv转染细胞LCII/LC3I比值显著降低(P<0.01),说明上调Atg7基因后,细胞自噬水平升高,下调Atg7基因后,细胞自噬水平被抑制。以上结果提示,plenti6.3-Atg7和sh-Atg-2 lv可以有效的抑制和激活肾癌786-0细胞的自噬水平。本研究发现调控自噬相关基因Atg-7是有效地调节肾癌786-0细胞自噬水平的方法。并成功构建了自噬激活/抑制肾癌786-0细胞系,为后续进行肾癌自噬作用及机制研究奠定基础。
[1] ANTONIO R, VIVAR C, MICHAEL E, et al. The biology of interleukin-2 efficacy in the treatment of patients with renal cell carcinoma[J]. Med Oncol,2009,26:13-19.
[2] SCHELTEMA JM, ROMIJN JC, VAN STEENBRUGGE GJ, et al. Inhibition of apoptotic proteins causes multidrug resistance in renal carcinoma cells [J]. Anticancer Res, 2001, 21(5):3161-3166.
[3] DENG Q, WANG ZL, WANG L, et al. LowermRNA and protein expression levels of LC3 and Beclin1, markers of autophagy, were correlatedwith progression of Renal Clear Cell Carcinoma [J]. Jpn J Clin Oncol,2013,43(12):1261-1268.
[4] ALTMAN BJ, RATHMELL JC. Metabolic stress in autophagy and cell death pathways[J]. Cold spr harb persp biol,2012,4(9):a008763.
[5] CUERVO AM,CELL BIOLOGY. Autophagy’s top chef[J]. Science,2011, 332(6036): 1392-1393.
[6] PEL A, HERR I, SCHWARZ H, et al. Blocked autophagy sensitizes resistant carcinoma cells to radiation therapy[J]. Cancer Res 2008;68(5):1485-1494.
[7] JACOB M GUMP, ANDREW THORBURN. Autophagy and apoptosis: what is the connection? [J]. Trend Cell Biol, 2011, 21(7):387-392.
[8] TIAN SH, LIN JA, ZHOU J, et al. Beclin 1-independent autophagy induced by a Bcl-X(L)/Bcl-2 targeting compound, Z18 [J]. Autophagy, 2010, 6(8):1032-1041.
[9] KUMA A, MATSUI M, MIZUSHIMA N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy [J]. Autophagy, 2007, 3(4):323-328.
[10] VON MUHLINEN N, AKUTSU M, RAVENHILL BJ, et al. An essential role for the ATG8 ortholog LC3C in antibacterial autophagy[J]. Autophagy, 2013, 9 (5). 784-786.
[11] SHPILKA T, WEIDBERG H, PIETROKOVSKI S, et al. Atg8: an autophagy-related ubiquitin-like protein family[J]. Genome Biol, 2011, 12 (7): 226.
[12] PATTISON JS, OSINSKA H, ROBBINS J. Atg7 induces basal autophagy and rescues autophagic deficiency in CryAB(R120G) cardiomyocytes [J]. Circul Rese, 2011, 109(2):151-160.
[13] MORTENSEN M, WATSON AS, SIMON AK. Lack of autophagy in the hematopoietic system leads to loss of hematopoietic stem cell function and dysregulated myeloid proliferation [J]. Autophagy, 2011, 7(9):1069-1070.
(编辑 王 玮)
Effect of overexpression/knockdown Atg7 on the autophagy of 786-0 renal clear carcinoma cell lines
WANG Zhen-long, DENG Qian, WANG Zi-ming
(Department of Urology, the Second Affiliated Hospital, Medical School of Xi’an Jiaotong University, Xi’an 710004, China)
Objective To explore the regulative effect of autophagy-related gene Atg7 on the autophagy of 786-0 cell line in renal cell carcinoma (RCC). Methods Atg7-overexpression plasmid plenti6.3-Atg7 and Atg7 specific microRNA- expressing plasmid sh-Atg-2 lv were established and identified. Plenti6.3-Atg7 and sh-Atg-2 lv were transfected into 786-0 cells, Western blot was used to detect LCII/LC3I respectively. Results 786-0 cells with Atg7-overexpression and Atg7-knockdown were obtained. Cells with Atg7-overexpression showed increased LC3II/LC3I compared with controls(3.31±0.12vs. 2.23±0.10,P<0.01), while cells with Atg7-knockdown showed reduced LC3II/LC3I compared with controls(1.45±0.11vs. 2.23±0.10,P<0.01). Conclusions 786-0 cells with Atg7-overexpression promote autophagy while 786-0 cells with Atg7-knockdown inhibit autophagy.
autophagy; renal clear cell carcinoma; Atg7; sh-Atg7; plenti6.3-Atg7
2014-09-11
2015-01-22
王子明,主任医师,教授.E-mial: ziming-w@263.net
王振龙(1979-),男(汉族),博士,副主任医师.研究方向:泌尿系肿瘤及腔内微创技术.E-mial:zhenlongw2001@163.com
R737.11
A
10.3969/j.issn.1009-8291.2015-04-016

